Тканевая инженерия в реконструкции височно-нижнечелюстного сустава
Tradução automática
O artigo original está escrito em EN language (link para lê-lo).
Введение
Реконструкция височно-нижнечелюстного сустава (ВНЧС) представляет собой множество проблем. Необходимо тщательно подходить к разработке протоколов исследований, чтобы избежать ошибочных или сомнительных результатов. Также крайне важно правильно выбрать тип животного для включения в исследования. Ошибки прошлого, связанные с использованием силиконовых и тефлоновых материалов в ВНЧС, стали ключевыми уроками для будущего. Постепенный рост тканевой инженерии (ТИ) может стать многообещающей областью для новых биоматериалов ВНЧС, если будут соблюдены основные принципы для достижения безопасных и эффективных решений для ВНЧС.
Животная модель для тканевой инженерии височно-нижнечелюстного сустава
Для улучшения здоровья человека научные открытия и технологии должны быть переведены в практические приложения. Такие достижения классически начинаются с базовых исследований, а затем переходят на клинический уровень. Неотъемлемой частью разработки новых технологий является роль доклинических испытаний с использованием животных моделей. Хотя ни одна животная модель не может полностью воспроизвести человеческие условия, животные модели являются ключевыми для оценки механизмов заболевания, тестирования новых технологий, применения новых процедур и прогресса ТИ.
Отсутствие хорошо установленной животной модели для исследования ВНЧС было ограничивающим фактором для потенциального прогресса в области тканевой инженерии ВНЧС. Выбор животного для экспериментального дизайна не является простым, в основном из-за физиологических и анатомических различий. ВНЧС является кардинальной особенностью, которая определяет класс Млекопитающие и отделяет млекопитающих от других позвоночных. ВНЧС демонстрирует замечательные морфологические и функциональные вариации между различными видами, отражая не только большую адаптацию млекопитающих к механизмам кормления, но и различное биомеханическое поведение. Морфологические вариации в основном коррелируют с нагрузкой (например, размером суставных поверхностей) или движением (например, ориентацией сустава), или тем и другим. Нагрузка на ВНЧС является реакционной силой, возникающей в результате сокращения жевательных мышц; её величина сильно зависит от положения точки укуса относительно линии действия мышцы. Многие доклинические исследования использовали лабораторных животных, особенно грызунов; однако они попадают в категорию минимальной нагрузки на ВНЧС, особенно во время жевания. В отличие от этого, хищники, такие как собаки, испытывают нагрузки на ВНЧС, которые выше, чем у приматов. Открытие челюсти обычно включает комбинацию вращения и переднего скольжения (перевода), но некоторые хищники утратили способность скользить, а некоторые специализированные муравьеды вместо этого используют вращение вокруг длинной оси изогнутой нижней челюсти. Самые экстремальные эволюционные варианты включают потерю синовиальной полости у некоторых усатых китов; потерю (или, возможно, примитивное отсутствие) диска у однопроходных, некоторых сумчатых и беззубых (муравьедов и ленивцев); вариации в ориентации суставной полости от сагиттальной (многие грызуны) до поперечной (многие хищники); обратное соотношение обычного выпуклого/вогнутого, так что processus condylaris становится женским элементом (многие парнокопытные, такие как овцы и крупный рогатый скот). Кроме того, размер сустава крайне переменчив. Свинья, овца, кролик и обезьяна использовались в качестве моделей дефекта диска ВНЧС в многих исследованиях. Модель обезьяны почти не используется в последние годы, учитывая высокую стоимость, сложность хирургической операции и этическое одобрение. Кролик часто используется в качестве модели для исследований смещения диска. Однако те же ограничения присутствуют и у кролика: (1) маленький размер ВНЧС, увеличивающий сложность хирургического доступа; (2) иногда необходимо удалить скуловую дугу для доступа к суставу; (3) нагрузка на ВНЧС снижена, что может вызвать возможный перекос в результатах. Наиболее цитируемое исследование модели смещения диска ВНЧС использовало взрослых самцов новозеландских белых кроликов для хирургического индуцирования переднего смещения диска. Процедура требовала разреза над скуловым отростком и перелома скулового отростка чешуйчатой височной кости для доступа к суставу. Один только хирургический подход мог повлиять на результаты и является ограничением этой модели.
Одной из основных причин, по которой для изучения хирургических методов лечения ВНЧС чаще используются крупные животные, а не мыши, крысы и кролики, является адекватный хирургический доступ и достаточная нагрузка на ВНЧС, что увеличивает точность возможных механических испытаний. По этой причине мыши, крысы и кролики представляют собой технические проблемы, которые часто вызывают вопросы относительно трансляционной значимости для человеческого ВНЧС, что оправдывает, почему эти животные не рекомендуются для строгих доклинических испытаний для ТЕ ВНЧС.
В разделе крупных животных исторически свинья считалась золотым стандартом, основываясь на общих сходствах с человеческой анатомией, в частности, на размере суставных структур ВНЧС и форме диска. Более того, недавнее комплексное исследование подтвердило использование юкатанской мини-свиньи в качестве животной модели для исследований ТЕ ВНЧС. Однако скуловая дуга защищает суставное пространство у сельскохозяйственной свиньи, что, по мнению авторов, является ограничением для использования этой модели. Более того, биомеханические силы мини-свиньи могут компрометировать результаты.
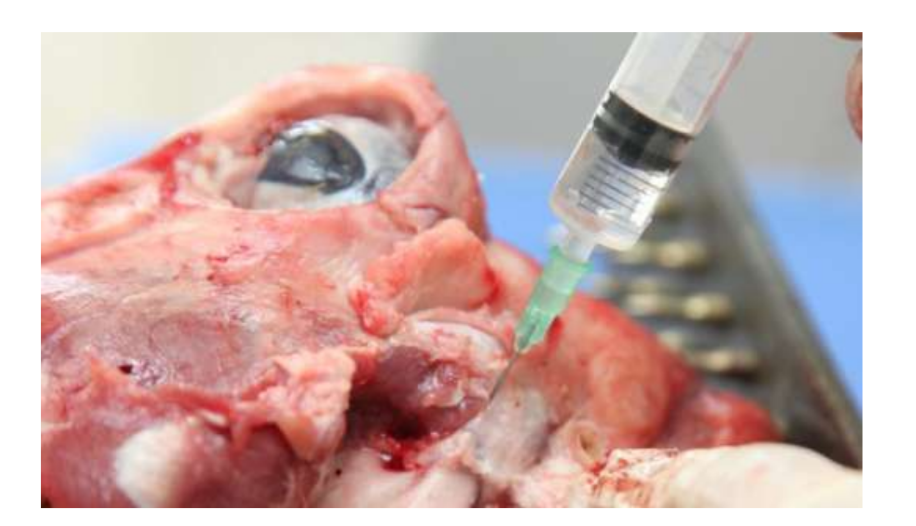
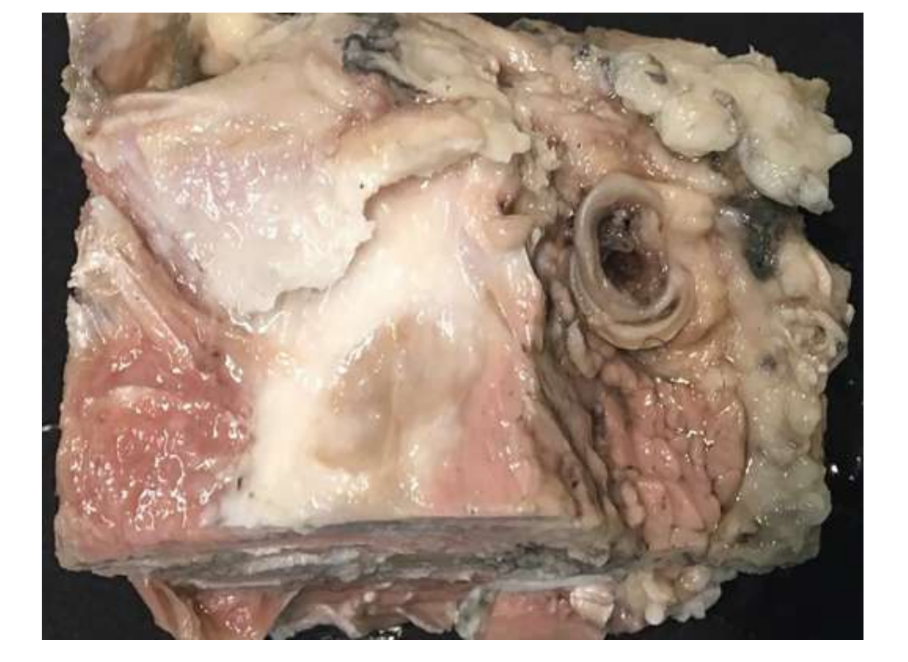
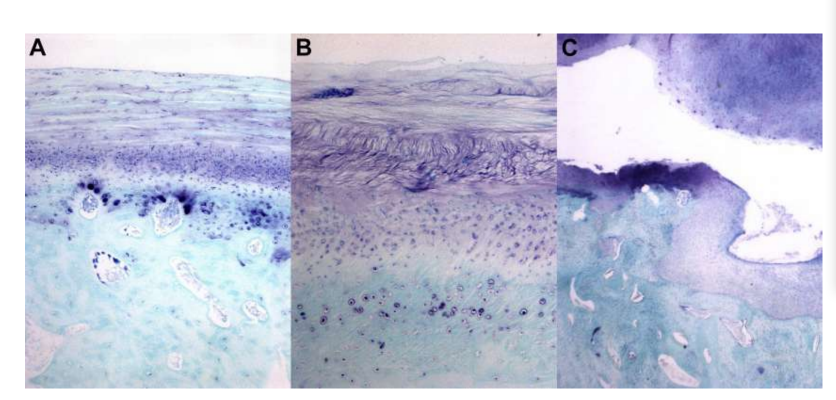
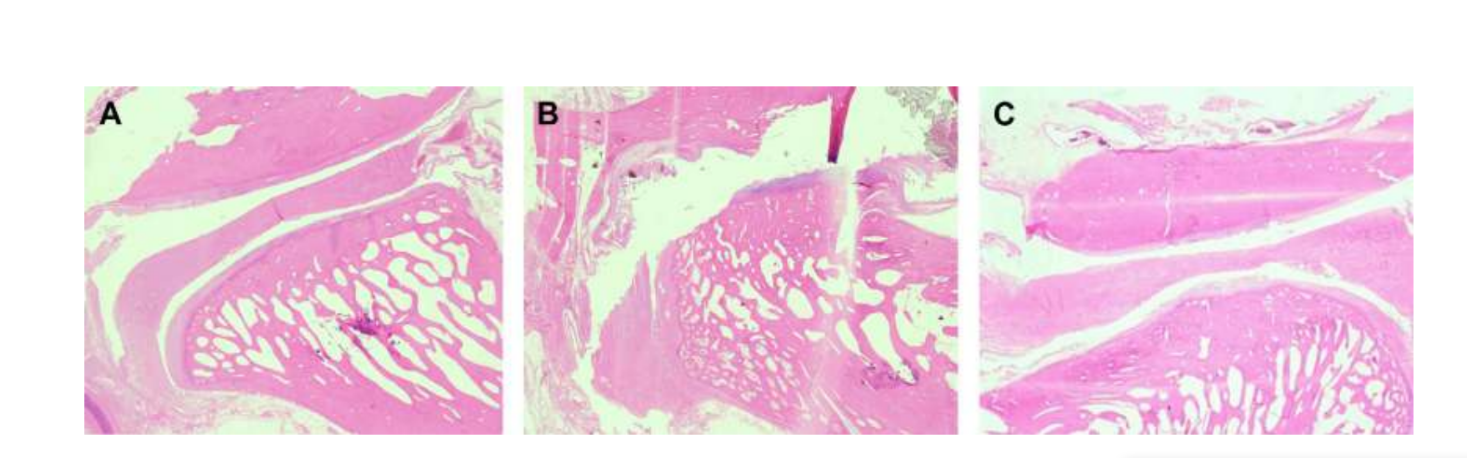
Анатомия, гистология и биомеханика височно-нижнечелюстного сустава черных мериносов также были изучены (Рис. 1). С помощью предушного разреза и тупой диссекции капсула ВНЧС может быть легко доступна (Рис. 2 и 4), даже для артроцентеза ВНЧС. Одним из преимуществ является то, что скуловая дуга не закрывает суставное пространство, как это происходит у домашних свиней. Диск ВНЧС разделяет верхнюю и нижнюю камеры (Рис. 3 и 4). Мыщелок овцы медиолатерально вогнут с эллипсоидной формой и с более длинной осью в медиолатеральном положении (Рис. 5 и 6). Эти анатомические сходства с человеческим ВНЧС, связанные с большим опытом в in-vivo хирургическом исследовании ВНЧС, предполагают, что овцу можно считать подходящей моделью для проведения строгих хирургических исследований ВНЧС.
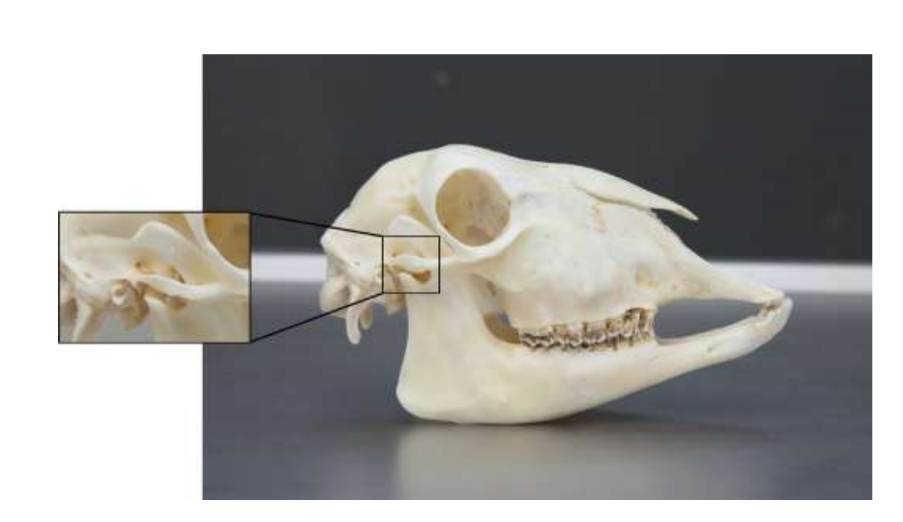
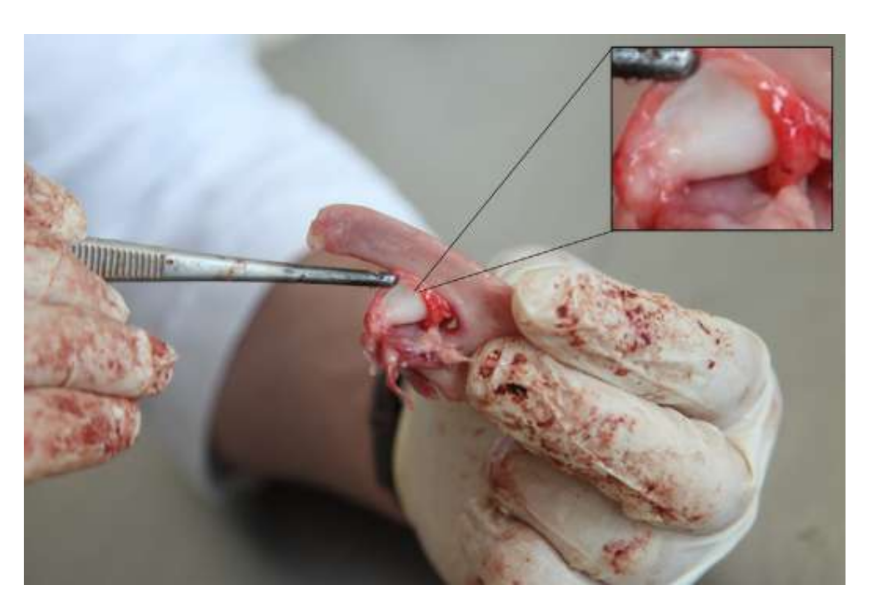
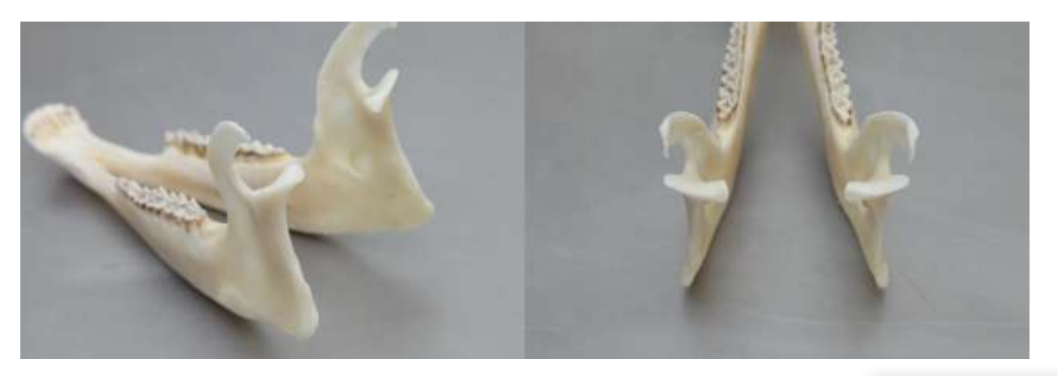
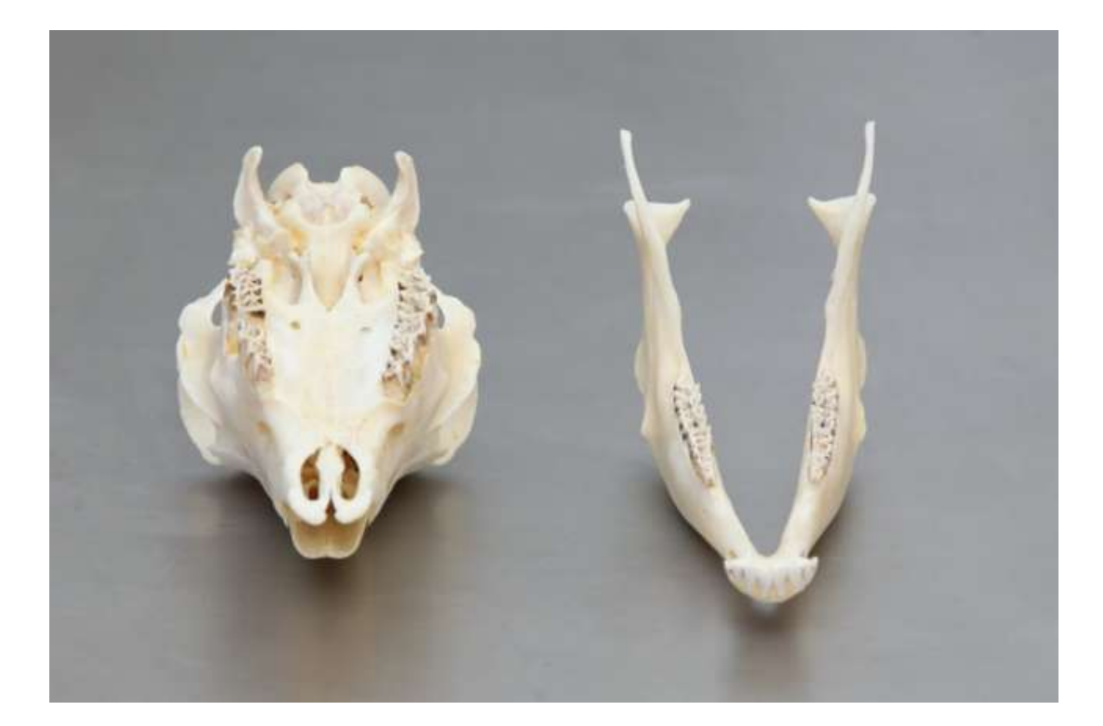
Овцы являются действительным вариантом для исследований ВНЧС, учитывая размер ВНЧС, форму processus condylaris и fossa mandibularis, размер диска, морфологию и прикрепления. Гистологический анализ имеет большое сходство с человеческой ВНЧС (Рис. 7 и 8). Еще одно важное преимущество овечьей модели - это процесс жевания (Рис. 9), обеспечивающий дополнительную биомеханическую нагрузку на ВНЧС, что идеально подходит для тестирования in-vivo прочности материалов TE. В последнее время овечья модель была успешно использована в предклиническом исследовании аллопластической реконструкции ВНЧС.
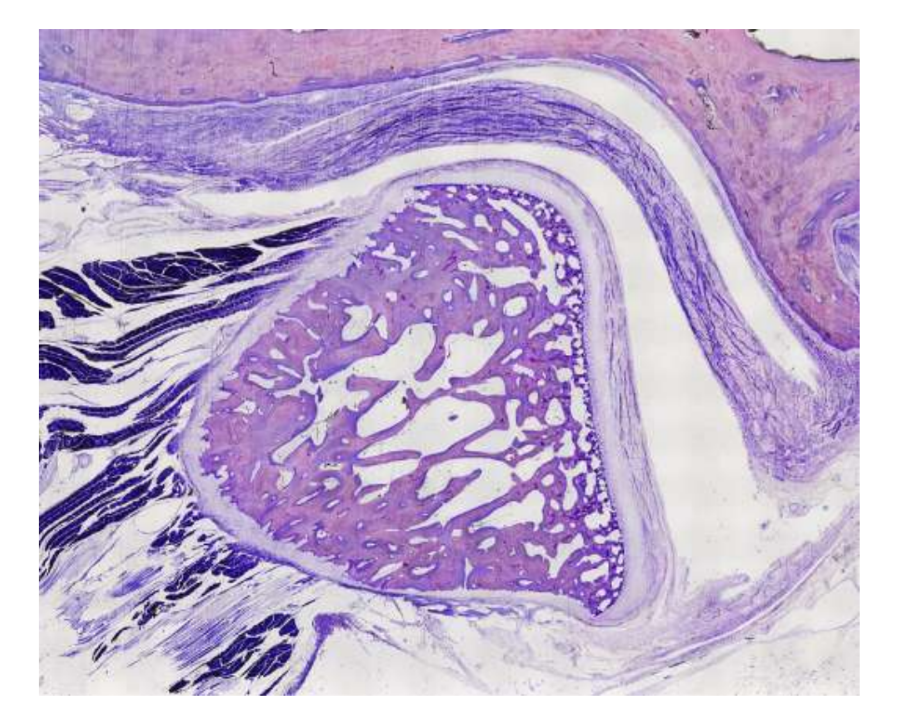
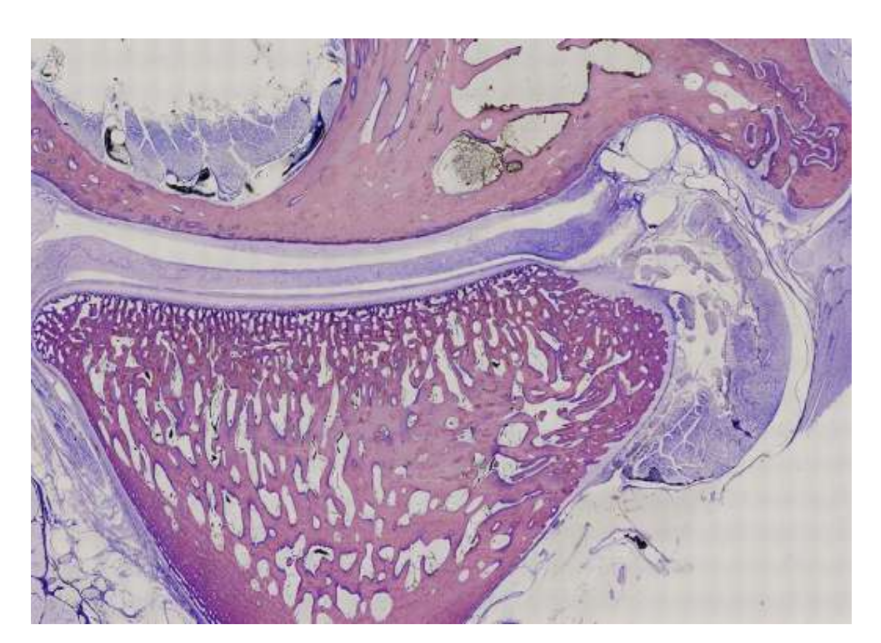

Хотя ни один вид не является золотым стандартом для всех доклинических исследований тканевой инженерии ВНЧС, овцы стали ведущим вариантом. Минисвиньи и сельскохозяйственные свиньи могут рассматриваться, когда доступны адекватные ресурсы, и служат приемлемыми альтернативами.
Дизайн исследования для доклинической тканевой инженерии височно-нижнечелюстного сустава
Отсутствие эффективных вариантов замены диска ВНЧС может быть связано с трудностями в трансляции данных, полученных на животных, в клиническую практику у людей. Эти ограничения, вероятно, связаны со следующим:
- Использование гетерогенных моделей животных с противоречивыми результатами, возможно, из-за переменной анатомии и внутрисуставной нагрузки между видами;
- Использование контралатерального ВНЧС в качестве контроля, что может быть связано с перегрузкой контралатеральной стороны;
- Биоматериалы, используемые для замены диска, которые не учитывают морфологические и биомеханические характеристики естественного диска ВНЧС;
- Отсутствие рандомизированных контролируемых испытаний с ослеплением оценщиков результатов;
- Недостаток многопрофильных команд, участвующих в проекте.
Предклинические исследования должны способствовать эффективному переводу знаний в практику. Ранее упомянутые аспекты могут ограничивать эффективный перевод качественных научных знаний в клиническую практику, и они могут представлять потенциальные проблемы для пациентов, клиницистов и научного прогресса.
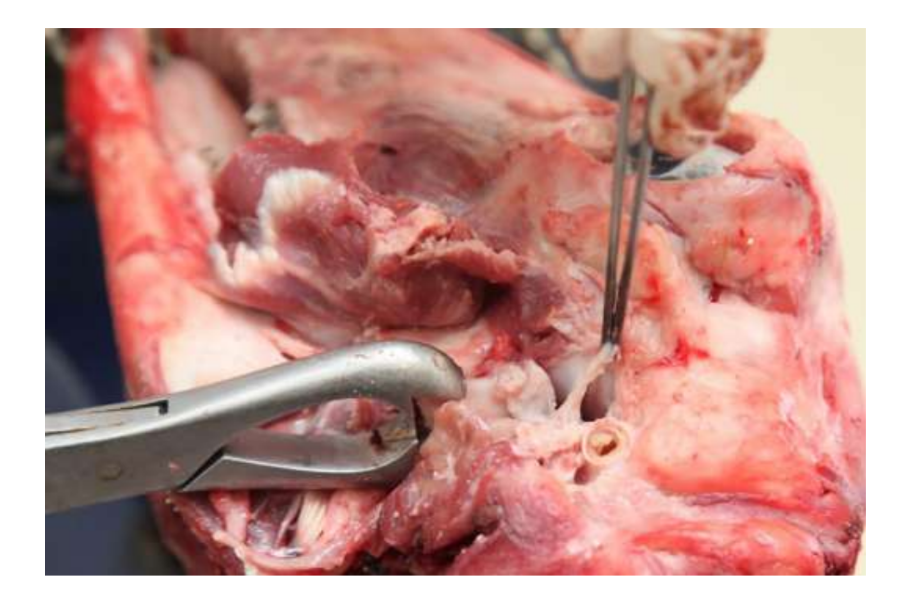
Современное отсутствие успешных вариантов замены диска ВНЧС по-прежнему является серьезной проблемой для общественного здоровья. За последнее десятилетие мало что изменилось в отношении дизайна исследований для изучения ВНЧС, и лечение пациентов с тяжелыми височно-нижнечелюстными расстройствами (ВНЧР) остается спорным. По этой причине будущие исследования должны быть строгими в дизайне исследования, соблюдая рекомендации ARRIVE. TEMPOJIMS - это строгое предклиническое исследование, протокол которого доступен для общественности. Основным результатом должно быть гистопатологическое исследование. Для этого авторы рекомендуют осторожно удалить блок ВНЧС, как показано на Рис. 10. Гистологическая подготовка является сложной, но протокол хорошо детализирован нашей группой, большая часть трудностей связана с процессом декальцинации. Протокол исследования использовался в фазе 1 TEMPOJIMS: сравнение результатов диссекции диска ВНЧС с дископексией ВНЧС и имитационной операцией на ВНЧС, получая базу для интерпретации будущих результатов ТЕ диска ВНЧС.
Обоснование тканевой инженерии височно-нижнечелюстного сустава
Чтобы обосновать исследование ТИ в ВНЧС, необходимо продемонстрировать клиническую необходимость в замене диска ВНЧС. Насколько известно, дисэктомия ВНЧС связана с благоприятными долгосрочными результатами, так почему же стоит инвестировать время и ресурсы в замену диска ВНЧС?
Вероятно, это связано с тем, что, помимо сильных доказательств, некоторые результаты по дисцектомии противоречивы. В предыдущих доклинических исследованиях в этой области исследователи использовали контрлатеральную неоперационную сторону в качестве контроля и спорные модели животных. Использование контрлатеральной стороны в качестве контроля может быть неуместным, учитывая влияние контрлатеральной перегрузки. Теоретически, двусторонний подход мог бы уменьшить предвзятость. Животная изменчивость в различных исследованиях является предупреждением о важности использования одной и той же модели животных в дальнейших исследованиях, касающихся ТМЖ ТЭ. Поэтому группа авторов провела различные доклинические исследования на черных мериносах, но первое исследование было направлено на понимание необходимости замены диска ТМЖ, используя группу контроля с симуляцией операции - TEMPOJIMS фаза 1.
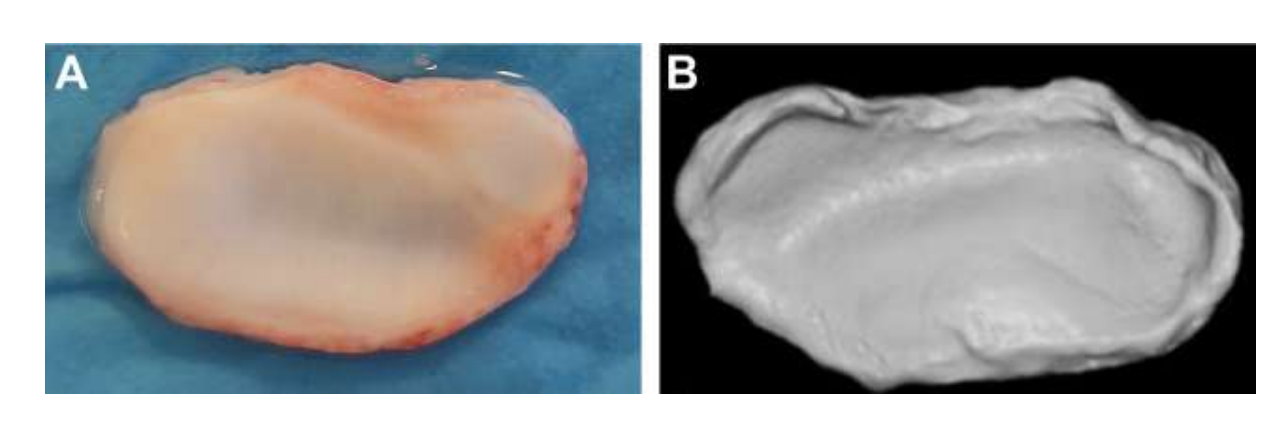
Двусторонняя дисцектомия ТМЖ у черных мериносов была проведена, и серьезные изменения в ТМЖ были обнаружены как при гистопатологическом, так и при визуальном анализе (Рис. 11 и 12). В посмертной макроскопической оценке был обнаружен серьезный дегенеративный процесс (Рис. 13). В гистологическом анализе исследователи подтвердили увеличение протеогликанов и округлых клеток, а также утолщение хряща после дисцектомии. Также была отмечена более серьезная синовит в результате дисцектомии, что указывает на возможный воспалительный процесс. Структурно были обнаружены различия в форме, склерозе мыщелка, склерозе височной кости, костном мозге мыщелка, эрозии височной кости, эрозии мыщелка и височном мозге (Рис. 14). Однако дисцектомия оказала влияние только на абсолютное время жевания, время жевания за цикл и площадь жевания в первые 2 месяца, а после начального периода значительных изменений не было замечено. У Macaca fascicularis Яйлен и коллеги после односторонней дисцектомии описали анкилоз между мыщелком и височной костью. В клинических исследованиях аф Бьёркестен и Боман в 1947 году были первыми исследователями, которые сообщили о радиографических морфологических изменениях, вызванных дисцектомией, описывая «уплощение суставной поверхности». В 1980-х годах были описаны серьезные уплощения мыщелка и склероз у пациентов после дисцектомии. Позже Эрикссон и Вестессон в обзоре 52 пациентов также подтвердили, что у большинства суставов были радиографические признаки остеофитов, уплощения и склероза.
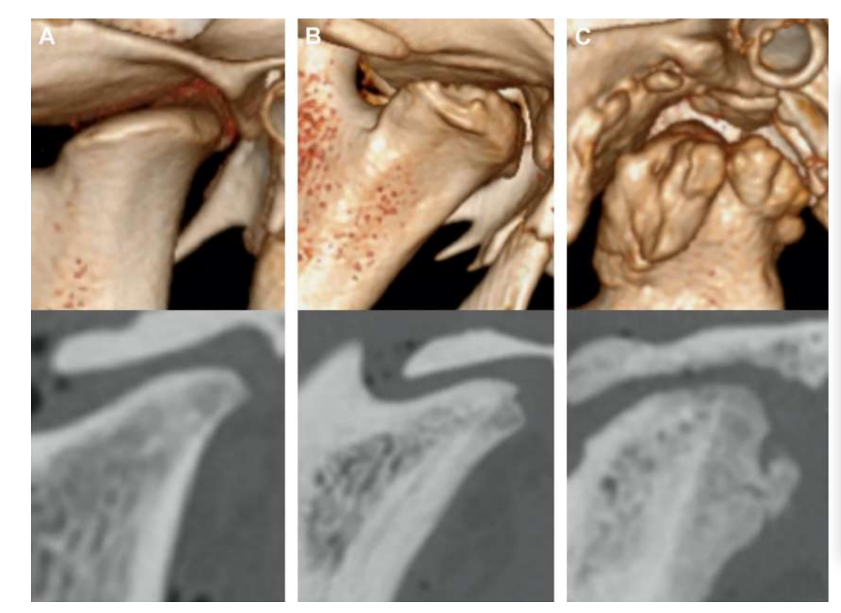
Бьёрнланд и Лархейм описали фиброзный анкилоз через 6 месяцев после односторонней дисцэктомии. В совокупности эти результаты подчеркнули важность изучения эффективного межпозиционного материала для замены диска ВНЧС.
Имплантаты, созданные с помощью Tissue Engineering
Попытка заменить диск ВНЧС начала изучаться примерно в середине 1960-х и 1970-х годов. Первые испытанные материалы были силиконовая резина (Dow-Corning, Midland, MI, USA) и Proplast-Teflon (Vitek, Inc, Houston, TX, USA). Силиконовая резина была введена Робинсоном в 1968 году в области эстетической хирургии, замены суставов и оральной и челюстно-лицевой реконструктивной хирургии. Хотя этот материал обладает интересными свойствами легкой обработки и хорошей прочности и эластичности, его использование быстро стало не рекомендоваться. У некоторых пациентов наблюдались серьезные иммунные реакции, такие как реакции на силиконовые частицы и синовит. Замена силиконового диска также была связана с миграцией этого материала в соседние ткани. У овец имплантация листа силиконовой резины (имплантат из силиконовой резины) была причиной разрушения кости во всех 4 оперированных суставах и сопровождалась реакцией на инородное тело по всей фиброзной капсуле, которая образовалась вокруг имплантата. Также Сандерс и коллеги в повторной оценке 30 пациентов сообщили о фиброзной капсуле как псевдодиске и фиброзном барьере между мыщелком и ямкой.
Proplast-тефлон (политетрафторэтилен или PTFE) также был другим материалом, использованным в качестве замены диска ВНЧС. Введенный в 1976 году доктором Чарльзом Хомси, он был представлен как стабильный и пористый материал, позволяющий клеточной адгезии. Однако этот материал быстро изнашивался, вызывая серьезные реакции, включая гранулемы инородного тела, фиброз, морфологические изменения мыщелка и боль. В 1990 году Управление по контролю за продуктами и лекарствами рекомендовало удалять эти имплантаты в случаях, когда наблюдались дегенеративные изменения в ВНЧС.
Учитывая последующие неудачи этих заменяющих материалов, тканевая инженерия (TE) набирает важность, представляя собой возможный жизнеспособный путь к замене диска ВНЧС. Эффективный и безопасный суставной диск должен соответствовать некоторым критериям, таким как следующие:
- Биодеградируемость, чтобы позволить замену подходящей тканью и биосовместимость с хозяином, чтобы избежать воспалительной реакции;
- Высокая несущая способность, чтобы выдерживать механические нагрузки;
- Подходящая пористость и химия поверхности для клеточной дифференциации и для обеспечения транспорта и обмена кислородом, питательными веществами и отходами.
В этом контексте авторы охарактеризовали морфологическую, гистологическую и биомеханическую характеристику диска височно-нижнечелюстного сустава черной овцы Мерино (Рис. 15). Результаты этого исследования были крайне важны для понимания геометрии, биомеханических и биологических свойств суставного диска, чтобы иметь возможность разрабатывать заменяющие материалы. На самом деле, великой задачей тканевой инженерии было разработать стратегию, в которой биоматериал содержал бы все эти характеристики. В случае ВНЧС исследования сосредоточились на 2 типах биоматериалов: синтетических и натуральных.
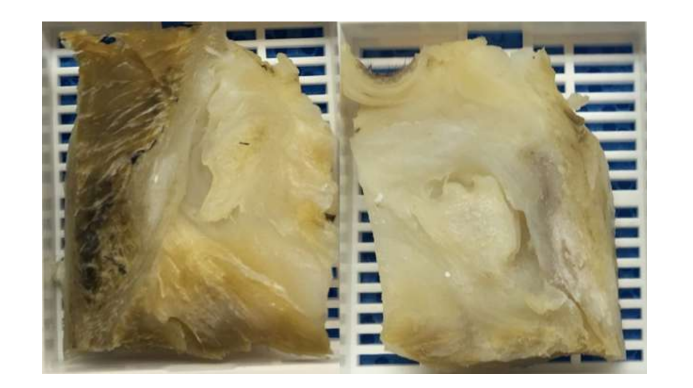
Природные биоматериалы получены из природных источников и обладают лучшими биологическими свойствами, такими как биосовместимость, биодеградируемость и биоактивность, а также способствуют адгезии клеток, их пролиферации и дифференцировке, что необходимо для тканевой инженерии. Однако они обычно имеют худшие механические свойства и больше трудностей в обработке материала. Из-за этих трудностей лишь несколько исследований продемонстрировали потенциальное использование этих биоматериалов в ВНЧС. Первое пилотное исследование использовало гибрид фибрина/хитозана в сочетании с синовиальными стволовыми клетками ВНЧС. Исследователи показали, что имплантация каркаса способствовала образованию внеклеточного матрикса у мышей. Несмотря на эти многообещающие результаты, исследование не продвинулось дальше, и многое из этого могло быть связано с тем, что после 7-го дня посева клеток количество клеток начало резко снижаться. В другом исследовании была оценена комбинация каркаса из коллагеновой губки и аутологичных мезенхимальных клеток костного мозга на перфорированных дисках ВНЧС японских кроликов. Исследователи наблюдали образование новой соединительной ткани через 2 недели, в то время как в контрольной группе через 8 недель перфорация все еще не закрылась полностью. Однако, как уже упоминалось, использование кроликов/мышей в этом типе исследования имеет много ограничений. Альгинат также изучался в инвитро подходе с клетками дисков ВНЧС, но результаты не были многообещающими, и образование коллагена или ГАГ не было подтверждено, а количество клеток со временем уменьшалось. Еще одной стратегией, которая была исследована, является деклеточная внеклеточная матрица (dECM). dECM обладает отличными свойствами, сохраняя природные органические и механические свойства, такие как коллагеновая сеть ткани, поскольку иммуногенные компоненты удаляются, чтобы обеспечить адгезию и пролиферацию клеток. Лишь несколько исследований сосредоточились на лучшем методе эффективной деклеточности диска ВНЧС. Совсем недавно был произведен инъекционный гидрогель на основе деклеточных дисков свиней ВНЧС, который был введен в мышь. Гидрогель показал хорошую цитосовместимость, и лишь незначительное воспаление наблюдалось в течение 7 дней после имплантации. Однако этому исследованию не хватает проверки терапевтической эффективности. Исследования, связанные с наиболее эффективным протоколом деклеточности диска, скудны. Таким образом, исследовательская группа авторов в настоящее время активно изучает другие методы деклеточности черных дисков ВНЧС Мерино (Рис. 16), такие как химические, физические и ферментативные, чтобы найти наиболее эффективную стратегию.
Синтетические биоматериалы по сравнению с натуральными имеют недостатки в структурных различиях по сравнению с естественной тканью и возможными осложнениями, связанными с токсичностью и биосовместимостью. Однако они имеют некоторые значительные преимущества, такие как более высокая доступность, более простая обработка и лучшие биомеханические и физические свойства. По этим причинам синтетические материалы исследуются в качестве заменителей дисков ВНЧС.
Поли(lactide) (PLA), который имеет более длительное время разложения, был одним из первых синтетических материалов, изученных. PLA в сочетании с жировыми стволовыми клетками увеличивал экспрессию агрекана и коллагена типов I и II в хондрогенном среде, но степень дифференцировки клеток была ниже по сравнению с клетками, полученными из диска ВНЧС.
Поли(glycolic acid) (PGA) также является биодеградируемым полимером, изученным в области ВНЧС. Клетки диска ВНЧС свиней были посеяны на каркас PGA, и было подтверждено увеличение производства матрицы. Другие исследователи предположили, что нетканые сетки поли-L-молочной кислоты (PLLA) будут ограничивать сокращение, позволят провести всестороннюю механическую оценку и поддерживать жизнеспособность по сравнению с контролем нетканой сетки PGA. Эти конструкции имели возможность поддерживать свой объем в течение
6 недель по сравнению с PGA, но имели низкую механическую прочность. Поли(ε-caprolactone) (PCL) является еще одним биоматериалом, который был изучен благодаря его медленному разложению. Каркасы PCL, где ориентация волокон представляла собой коллагеновую сеть, были инкапсулированы микросферами
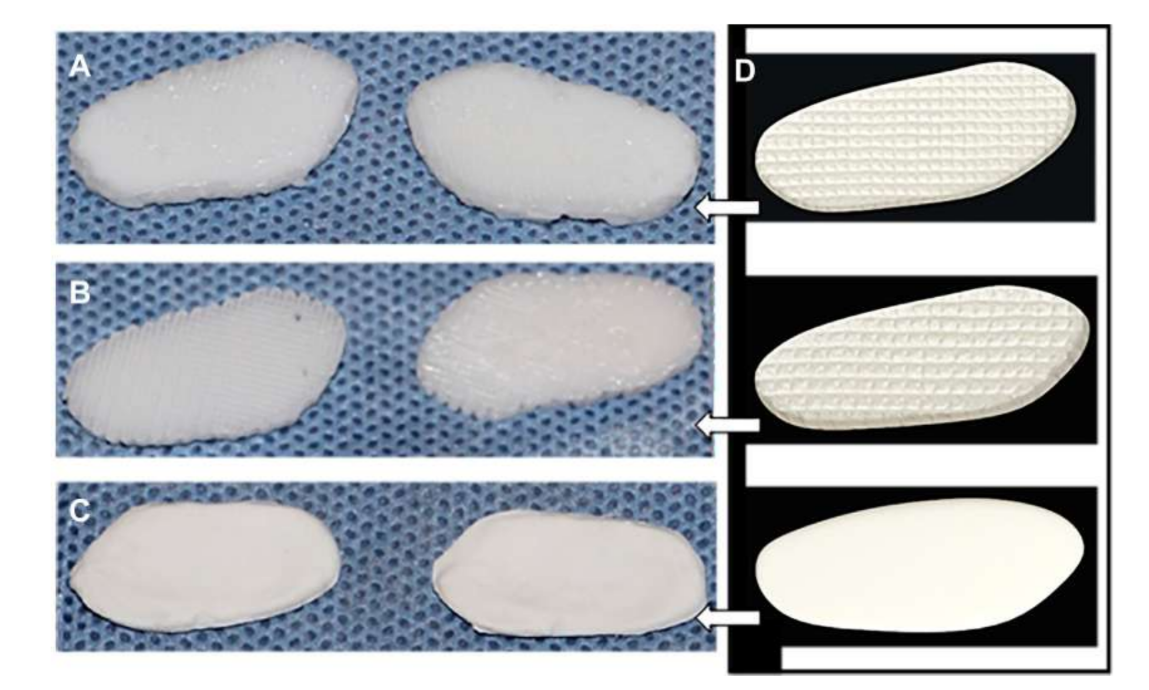
фактора роста соединительной ткани (CTGF) и трансформирующего фактора роста бета 3 (TGFb3). При культуре с человеческими мезенхимальными стволовыми/предшественническими клетками этот каркас оказался эффективным в создании гетерогенной фиброхрящевой матрицы и вискоэластичных свойств. Исследователи утверждают, что необходимо провести тесты на деградацию каркаса in vivo и в долгосрочной перспективе. Цзян и коллеги изучали гидрогель поли(vinyl alcohol), сшитый циклическим замораживанием и оттаиванием, и усиленный трехмерным (3D) PCL, который был имплантирован в коз в течение 12 недель. Исследователи описали этот заменитель как обладающий способностью поддерживать стабильность сустава и защищать мыщелковый хрящ и кость от повреждений. Однако также сообщалось о прорастании фиброзной ткани в окружающей области PCL. На самом деле, PCL, похоже, не обладает идеальными свойствами для использования в качестве заменителя в проведенных работах. Исследовательская группа авторов также изучила биоматериалы на основе каркасов и гидрогелей, имитирующих диск ВНЧС черных мериносов, используя различные материалы, PCL и диакрилат полиэтиленгликоля (PEGDA), а также как многокомпонентную структуру, объединяющую PEGDA с 3D-печатными каркасами PCL (Рис. 17). Результаты авторов показали, что гидрогель PEGDA в качестве ядра в каркасе более точно имитирует механические свойства родной ткани (Рис. 18). Совсем недавно были разработаны имплантаты диска ВНЧС, адаптированные по 3D, и имплантированы в черных мериносов:
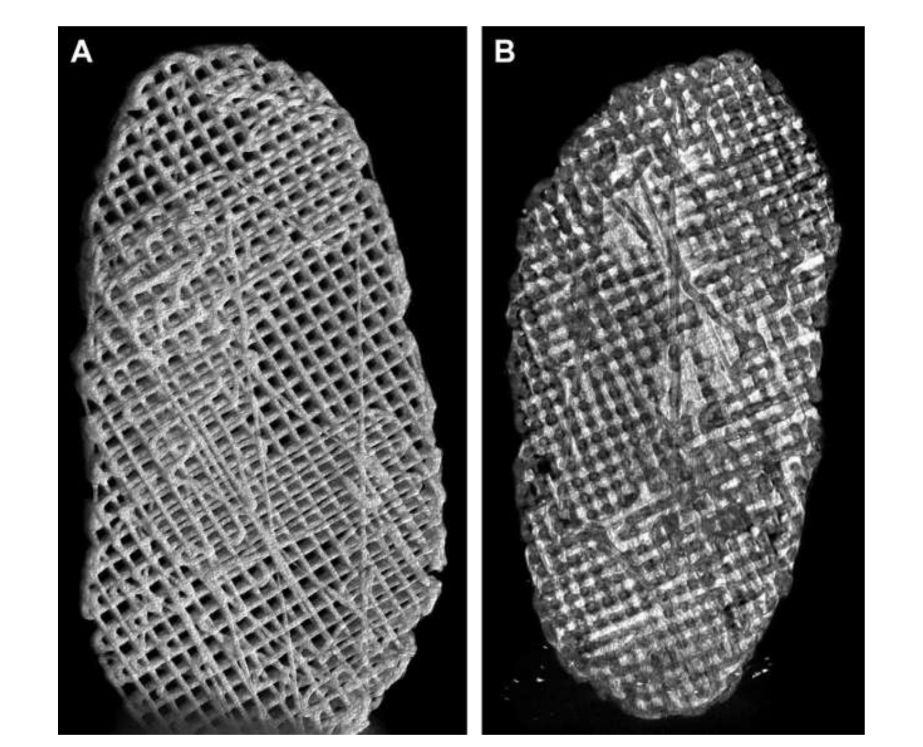
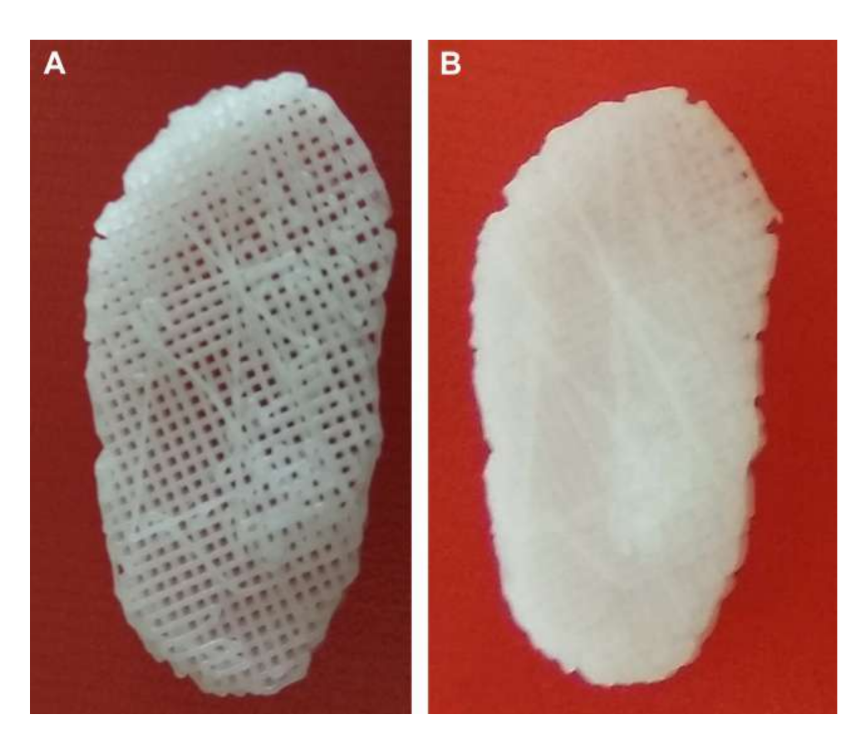
(1) Сетка из поли(глицерол себаката) (PGS), усиленная электроспиненными волокнами PCL на внешней поверхности (PGS + PCL); (2) PCL и PEGDA (PCL + PEGDA); и (3) PCL (Рис. 19 и 20). Результаты показали, что диски PCL и PCL + PEGDA представляют более высокий риск увеличения дегенеративных изменений из-за фрагментации материала. Ни один из протестированных дисков не регенерирует новый аутологичный диск; однако PGS + PCL был безопасен, продемонстрировал быструю резорбцию и был способен предотвращать дегенеративные изменения в мыщелке. Хагандора в исследовании in vitro также указал на отличное свойство PGS, учитывая, что фиброхондроциты реагируют на применение механических сил, производя повышенные количества внеклеточного матрикса.

Несмотря на исследования, проводимые в последние годы, биоматериал, который соответствует всем необходимым характеристикам для замены диска ВНЧС, все еще не доступен для клинических испытаний. Ожидается, что в ближайшие несколько лет это станет возможным.
Еще одной важной областью исследований тканевой инженерии являются мультипотентные клетки. Среди этих клеток наиболее изучены мезенхимальные стволовые клетки (МСК), особенно в лечении остеоартрита ВНЧС. Происходя из различных тканей, включая кость, жировую и синовиальную, МСК обладают множеством свойств: хондрогенной дифференциацией, противовоспалительной активностью, регенерацией фибро-хряща и остеогенной дифференциацией. Несмотря на некоторые многообещающие результаты в защите от остеоартрита и резорбции мыщелка, исследования в основном основаны на интраартикулярных инъекциях. Использование этих клеток в регенерации суставного диска встречается реже и в основном применяется с другими биоматериалами. У кроликов Ахтиайнен и коллеги разработали диск из PLA с жировыми стволовыми клетками и наблюдали, что эти клетки улучшили морфологический паттерн кости, более похожий на естественный, и была замечена регенерация соседних тканей. Совсем недавно было разработано исследование с использованием стволовых клеток, полученных из жира, для дифференциации этих клеток в клетки диска ВНЧС с помощью лазерной индукции. Более 90% клеток были жизнеспособны с фибробластическими и хондрогенными фенотипами. Применение этого подхода не было использовано в in vivo испытаниях. В пилотном исследовании, используя гибридные каркасы из фибрина/хитозана с МСК, полученными из синовиума, исследователи наблюдали регенеративную способность и гиперэкспрессию у крыс с перфорированным диском ВНЧС. Стволовые клетки зубной пульпы также использовались в каркасах из хитозана/альгината и оценивались в in vitro культуре. Эти стволовые клетки показали увеличение модуль хранения и эластичных свойств, увеличивая адгезию клеток и экспрессию фибро-хрящевых маркеров. Однако их эффективность в in vivo испытаниях еще предстоит продемонстрировать. Также мультипотентные мезенхимальные стромальные клетки были идентифицированы и изолированы из дисков ВНЧС и показали способности к пролиферации и дифференциации. В ближайшем будущем ожидается, что исследования с этими клетками покажут эффективность в регенерации диска ВНЧС.
Для улучшения свойств, проявляемых стволовыми клетками и каркасами, были изучены некоторые факторы роста с целью улучшения дифференцировки, пролиферации, производства ГАГ и коллагена. Наиболее заметные факторы роста включают сосудистый эндотелиальный фактор роста, белок морфогенетический кости-2, фактор роста фибробластов (FGF), TGF-b1, белок группы высокой подвижности 1, инсулиноподобный фактор роста-1 (IGF-1); фактор роста, производимый тромбоцитами, эпидермальный фактор роста, интерлейкин 1 и фактор некроза опухоли-альфа. В литературе некоторые исследователи изучали потенциал внедрения этих факторов роста в различные каркасы. ДетаМор и Афанасию были пионерами, которые внедрили 3 фактора роста (FGF, TGF-b и IGF) в каркасы PGA. Все факторы роста улучшили механическую и структурную целостность; однако IGF и TGF-b были наиболее эффективными в стимулировании синтеза коллагена. В каркасах PLLA, обработанных IGF1 или TGF-b1 или TGF-b3, результаты были лучше, при этом TGF-b1 способствовал большему количеству клеток, коллагена и гликозаминогликанов. PCL также был инкапсулирован в микросферы CTGF и TGFb3. При культивировании с человеческими мезенхимальными стволовыми/предшествующими клетками этот каркас оказался эффективным в создании гетерогенной фиброкартилагинозной матрицы и вискоэластичных свойств. В будущем ожидается возможность изучения этой концепции, сочетая биоматериалы со стволовыми клетками и факторами роста; однако бюрократические и этические ограничения должны быть пересмотрены, чтобы усилить ожидания использования этих техник у людей.
Резюме
Спрос на замену диска ВНЧС продолжает представлять собой серьезную проблему на сегодняшний день. Основная трудность заключается в разработке биоматериала, который обладает биомеханическими и биохимическими свойствами, чтобы стать жизнеспособной альтернативой.
Область тканевой инженерии активно способствует возможности достижения новых результатов в поиске нового и долговечного материала, который эффективно заменяет/регенерирует диск ВНЧС. Исследования должны учитывать естественные свойства диска, такие как механические, физические и биологические. Также следует применять стандартизацию исследований на крупных животных, таких как овцы и свиньи.
Хотя идеальный биоматериал еще не был достигнут, работа, проведенная в последние годы, позволяет надеяться, что эта цель стала ближе.
Давид Фаустино Âнгело, Флоренсио Монхе Гил
Ссылки
- Херринг СВ. Анатомия ВНЧС и животные модели. J Musculoskelet neuronal interactions 2003;3(4):391-407.
- Наплес ВЛ. Морфология, эволюция и функция кормления у гигантского муравьеда (Myrmecophaga tridactyla). J Zool 1999;249(1): 19-41.
- Ли ЙК, Мун ХД. Взаимное влияние жевательного аппарата, краниофациальной структуры и гомеостаза всего организма. Med Hypotheses 2012;79(6):761-6.
- Херринг СВ, Лю ЗД. Нагрузки на височно-нижнечелюстной сустав: анатомические и in vivo доказательства из костей. Cells Tissues Organs 2001;169(3):193-200.
- Босанкет А, Ишимару Дж, Госс АН. Влияние экспериментального перфорации диска на височно-нижнечелюстные суставы овец. Int J Oral Maxill Surg 1991;20(3):177-81.
- Босанкет АГ, Госс АН. Овца как модель для хирургии височно-нижнечелюстного сустава. Int J Oral Maxill Surg 1987;16(5):600-3.
- Ишимару Дж-И, Госс АН. Модель остеоартрита височно-нижнечелюстного сустава. J Oral Maxillofacial Surg 1992;50(11):1191-5.
- Лонг Х, Госс АН. Модель овцы для внутрисуставного перелома мыщелка. J Oral Maxillofac Surg 2007;65(6):1102-8.
- Хелгеланд Е, Шанбхаг С, Педерсен ТО и др. Регенерация тканей височно-нижнечелюстного сустава на основе каркасов в экспериментальных животных моделях: систематический обзор. Tissue Eng B Rev 2018;24(4): 300-16.
- Ванг КХ, Чан ВП, Чиу ЛХ и др. Гистологические и иммуногистохимические анализы восстановления диска в височно-нижнечелюстном суставе кролика с использованием коллагенового шаблона. Materials (Basel) 2017; 10(8).
- Шарави ММ, Хелми ЕС, Бейс РА и др. Восстановление перфорации диска височно-нижнечелюстного сустава с использованием лоскута синовиальной мембраны у обезьян Macaca fascicularis: исследования световой и электронной микроскопии. J Oral Maxillofac Surg 1994;52(3):259-70.
- Али АМ, Шарави ММ. Гистопатологические изменения в кроличьих краниомандибулярных суставах, связанные с экспериментально вызванным передним смещением диска (ADD). J Oral Pathol Med 1994;23(8): 364-74.
- Миллс ДК, Даниэль ДжК, Херцог С и др. Животная модель для изучения механизмов в нарушении диска височно-нижнечелюстного сустава у человека. J Oral Maxillofac Surg 1994;52(12):1279-92.
- Талленс РХ, Мачер ДЖ, Риволи П и др. Животная модель для смещения диска. J Craniomandib Disord 1990;4(4):233-40.
- Легрелл ПЕ, Исберг А. Ассиметрия высоты нижней челюсти после экспериментально вызванного смещения диска височно-нижнечелюстного сустава у кроликов. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1998;86(3):280-5.
- Синделар БД, Херринг СВ. Механика мягких тканей височно-нижнечелюстного сустава. Cells Tissues Organs 2005;180(1):36-43.
- Сунь З, Лю ЗД, Херринг СВ. Движение тканей височно-нижнечелюстного сустава во время жевания и пассивной манипуляции у мини-пигов. Arch Oral Biol 2002;47(4):293-305.
- Херринг СВ, Деккер ДжД, Лю ЗД и др. Височно-нижнечелюстной сустав у мини-пигов: анатомия, клеточная репликация и связь с нагрузкой. Anat Rec 2002;266(3):152-66.
- Лю ЗД, Херринг СВ. Жевательные нагрузки на костные и связочные компоненты височно-нижнечелюстного сустава у мини-пигов. J Orofac Pain 2000;14(4):265-78.
- Синделар БД, Эванко СП, Алонсо Т и др. Влияние ношения интраоральной шины на протеогликаны в диске височно-нижнечелюстного сустава. Arch Biochem Biophys 2000;379(1):64-70.
- Вапниарский Н, Арьяи А, Арзи Б и др. Структурно-функциональные отношения диска височно-нижнечелюстного сустава юкатанского мини-пига поддерживают его пригодность для сравнительных исследований у человека. Tissue Eng C Methods 2017;23(11):700-9.
- Тома КХ. Гиперостоз мыщелка нижней челюсти: с отчетом о двух случаях. Am J Orthod Oral Surg 1945;31(10):597-607.
- Анжело ДФ, Моруко П, Алвеш Н и др. Выбор овец (Ovis aries) в качестве животной модели для исследований височно-нижнечелюстного сустава: морфологическая, гистологическая и биомеханическая характеристика диска сустава. Morphologie 2016;100(331):223-33.
- Анжело ДФ, Монье ФГ, Гонсалес-Гарсия Р и др. Биоинженерные имплантаты диска височно-нижнечелюстного сустава: протокол исследования для двухфазного исследовательского рандомизированного предклинического пилотного испытания на 18 черных мериносов (TEMPOJIMS). JMIR Res Protoc 2017;6(3):e37.
- Херринг СВ. Анатомия ВНЧС и животные модели. J Musculoskelet Neuronal Interactions 2003;3(4):391-4.
- Де Мюрши Н, Моммарц М. Аллопластические системы замены височно-нижнечелюстного сустава: систематический обзор их истории. Int J Oral Maxill Surg 2018;47.
- Анжело ДФ, Моруко П, Монье Гил Ф и др. Предклиническое рандомизированное контролируемое испытание двусторонней дисцектомии против двусторонней дископексии в височно-нижнечелюстном суставе черных мериносов: TEMPOJIMS - фаза 1 - результаты гистологии, визуализации и массы тела. J Craniomaxillofac Surg 2018;46(4):688-96.
- Коэн ВА, Сервейс ЖМ, Полур И и др. Дегенерация суставного хряща в контралатеральном несущем височно-нижнечелюстном суставе у мышей с односторонней частичной дисцектомией. J Oral Pathol Med 2014; 43(2):162-5.
- Аhtiainen К, Маунo Дж, Элла В и др. Автологичные жировые стволовые клетки и полилактидные диски в замене диска височно-нижнечелюстного сустава у кроликов. J R Soc Interf 2013;10(85):20130287.
- Бьорнланд Т, Хаанес ХР. Дисцектомия височно-нижнечелюстного сустава: экспериментальное исследование на обезьянах. J Craniomaxillofac Surg 1999;27(2):113-6.
- Ли Л, Ванг Л, Сунь Й и др. Установление и гистологическая оценка модели травматического височно-нижнечелюстного сустава у коз. J Oral Maxillofac Surg 2015;73(5):943-50.
- Сюй Л, Полур И, Лим Ч и др. Остеоартрит височно-нижнечелюстного сустава у мышей, вызванный частичной дисцектомией. Osteoarthritis Cartil 2009;17(7):917-22.
- Димитрулис Г, Славин Дж. Влияние односторонней дисцектомии и кондилэктомии на контралатеральный неповрежденный краниомандибулярный сустав кролика. J Oral Maxillofac Surg 2006;64(8):1261-6.
- Анжело ДФ, Гил ФМ, Гонсалес-Гарсия Р и др. Влияние двусторонней дисцектомии и двусторонней дископексии на кинематику жевания черных мериносов: TEMPOJIMS - фаза 1 - пилотное слепое рандомизированное предклиническое исследование. J Craniomaxillofac Surg 2018;46(2):346-55.
- Яйлен ДМ, Шапиро ПА, Лушей ЭС и др. Менискэктомия височно-нижнечелюстного сустава – влияние на структуру сустава и жевательную функцию у Macaca fascicularis. J Maxillofac Surg 1979;7(4):255-64.
- Боман КА. Артроз височно-нижнечелюстного сустава и его лечение эксцизией диска: клиническое исследование. Университет Мичигана: Альмквист и Викселл; 1947.
- Тольванен М, Ойкаринен ВД, Вольф Дж. 30-летнее наблюдение за менискэктомиями височно-нижнечелюстного сустава: отчет о пяти пациентах. Br J Oral Maxill Surg 1988;26(4):311-6.
- Эрикссон Л, Вестессон ПЛ. Дисцектомия как эффективное лечение болезненного внутреннего нарушения височно-нижнечелюстного сустава: 5-летнее клиническое и рентгенографическое наблюдение. J Oral Maxillofac Surg 2001; 59(7):750-8.
- Бьорнланд Т, Лархейм ТА. Дисцектомия височно-нижнечелюстного сустава: 3-летнее наблюдение как предсказатель 10-летнего результата. J Oral Maxillofac Surg 2003;61(1):55-60.
- Хартман ЛС, Бессетт РВ, Байер РЕ и др. Замены мениска височно-нижнечелюстного сустава из силиконовой резины: постимплантационная гистопатологическая и материальная оценка. J Biomed Mater Res 1988;22(6):475-84.
- Хенри ЧХ, Вольфорд ЛМ. Результаты лечения реконструкции височно-нижнечелюстного сустава после неудачи имплантата Proplast-Teflon. J Oral Maxillofacial Surg 1993;51(4):352-8.
- Такер МР, Беркс ЕД мл. Временная имплантация силиконовой резины после дисцектомии в височно-нижнечелюстном суставе приматов. J Oral Maxillofacial Surg 1989;47(12):1290-5.
- Босанкет АГ, Ишимару Дж, Госс АН. Влияние замены силиконовой резиной после дисцектомии на височно-нижнечелюстные суставы овец. J Oral Maxillofac Surg 1991;49(11):1204-9.
- Сандерс Б, Буонкристини РД, Джонсон Л. Удаление имплантата из силиконовой резины через частичную артротомию с последующим артроскопическим исследованием внутренней поверхности фиброзной капсулы. Oral Surg Oral Med Oral Pathol 1990;70(3):369-71.
- Бавариан Р, Шатман МЕ, Кит ДА. Постоянная боль после имплантатов Proplast-Teflon височно-нижнечелюстного сустава: отчет о случае и 35-летняя перспектива управления. J Pain Res 2021;14: 3033-46.
- Хеффез Л, Мафи МФ, Розенберг Х и др. Оценка КТ замены диска ВНЧС с использованием ламинированного Proplast-Teflon. J Oral Maxillofacial Surg 1987;45(8):657-65.
- У В, Гонг З, Ли Дж и др. Пилотное исследование фибрина с использованием стволовых клеток синовиальной ткани, полученных из височно-нижнечелюстного сустава, для восстановления перфорации диска ВНЧС. Biomed Res Int 2014;2014:454021.
- Кобаяси Е, Накахара Т, Иноуэ М и др. Экспериментальное исследование in situ тканевой инженерии диска височно-нижнечелюстного сустава с использованием автологичной костного мозга и коллагенового губчатого каркаса. J Hard Tissue Biol 2015;24:211-8.
- Алмарза АД, Афанасию КА. Техники посева и выбор каркаса для тканевой инженерии диска височно-нижнечелюстного сустава. Tissue Eng 2004;10(11-12):1787-95.
- Юран СМ, Долвик МФ, Маунфетридж ПС. Инженерная микропористость: повышение раннего регенеративного потенциала деклеточенных дисков височно-нижнечелюстного сустава. Tissue Eng A 2015;21(3-4): 829-39.
- Матуска АМ, Маунфетридж ПС. Лазерная микроабляция фиброзной ткани: влияние обработки ткани на модификацию пористости и механику. J Biomed Mater Res B Appl Biomater 2018;106(5): 1858-68.
- Лян Дж, Ий П, Ванг Х и др. Ацеллюлярный матричный гидрогель для восстановления диска височно-нижнечелюстного сустава. J Biomed Mater Res B Appl Biomater 2020;108(7):2995-3007.
- Мяэнпяа К, Элла В, Маунo Дж и др. Использование жировых стволовых клеток и полилактидных дисков для тканевой инженерии диска височно-нижнечелюстного сустава. J R Soc Interf 2010;7(42):177-88.
- Детамор МС, Афанасию КА. Использование вращающегося биореактора для тканевой инженерии диска височно-нижнечелюстного сустава. Tissue Eng 2005;11(7e8):1188-97.
- Аллен КД, Афанасию КА. Выбор каркаса и фактора роста в инженерии диска височно-нижнечелюстного сустава. J dental Res 2008; 87(2):180-5.
- Легемате К, Тарафдер С, Джун Й и др. Инженерия дисков ВНЧС человека с использованием каркасов, выделяющих белок, напечатанных на 3D-принтере. J dental Res 2016; 95(7):800-7.
- Цзян Н, Ян Й, Чжан Л и др. 3D-печатный поли(гидроксибутират) усиленный гидрогель в качестве искусственного диска ВНЧС. J dental Res 2021; 100(8):839-46.
- Мура К, Триндаде Д, Виейра М и др. Мультиматериальные имплантаты для восстановления диска височно-нижнечелюстного сустава: индивидуальное аддитивное производство. Front Bioeng Biotechnol 2020;8:342.
- Анжело ДФ, Ванг Й, Моруко П и др. Рандомизированное контролируемое предклиническое испытание на 3 имплантатах диска височно-нижнечелюстного сустава: TEMPOJIMS-Phase 2. J Tissue Eng regenerative Med 2021; 15(10):852-68.
- Хагандора КК, Гао Дж, Ванг Й и др. Поли(глицерол себакат): новый материал каркаса для инженерии диска височно-нижнечелюстного сустава. Tissue Eng Part A 2013;19(5e6):729-37.

/social-network-service/media/default/6809/fbab08d0.jpg)