Influenza dell'uso di strumenti a file singola reciprocanti e rotativi sulla riduzione batterica nei canali radicolari infetti
Tradução automática
O artigo original está escrito em EN language (link para lê-lo).
Abstract
Obiettivo: Confrontare la riduzione batterica ottenuta con sistemi reciprocanti e rotanti durante la preparazione del canale radicolare.
Metodologia: Sessanta canali radicolari distobuccali di molari mascellari sono stati contaminati con coltura di brodo di Enterococcus faecalis. Dopo un periodo di incubazione di 21 giorni, i campioni batterici sono stati raccolti e coltivati su piastre di agar m-Enterococcus. I canali radicolari sono stati suddivisi in cinque gruppi, in base al sistema utilizzato per l'istrumentazione: WaveOne, Reciproc, ProTaper, Mtwo e istrumentazione manuale. I controlli negativi consistevano in cinque canali radicolari non contaminati che sono stati sottoposti alla stessa strumentazione di ciascun gruppo sperimentale. I campioni batterici sono stati raccolti immediatamente e 7 giorni dopo l'istrumentazione. L'analisi statistica è stata eseguita mediante test t appaiati e test ANOVA.
Risultati: Rispetto ai campioni prima dell'istrumentazione, il conteggio batterico è stato significativamente ridotto dopo l'istrumentazione in tutti i gruppi, senza differenze significative nella riduzione del conteggio batterico tra le tecniche reciprocanti, rotanti e manuali. Tuttavia, i campioni testati 7 giorni dopo l'istrumentazione hanno mostrato conteggi batterici significativamente più elevati rispetto ai campioni testati immediatamente dopo l'istrumentazione.
Introduzione
La presenza di batteri è la causa principale dell'infezione parodontale e dello sviluppo della parodontite apicale (Kakehashi et al. 1965). Tra le diverse specie batteriche presenti nelle infezioni endodontiche, Enterococcus faecalis si distingue per la sua resistenza, la sopravvivenza in ambienti poveri di nutrienti e l'associazione con la parodontite apicale persistente (Sedgley et al. 2005, Sakamoto et al. 2007). Sebbene gli agenti chimici siano importanti nell'istrumentazione dei canali radicolari, alcuni agenti non sono completamente efficaci contro tutte le specie batteriche nei biofilm (Pappen et al. 2010). Inoltre, i biofilm maturi sono più resistenti all'azione dei prodotti chimici (Shen et al. 2011).
La rimozione meccanica tramite strumentazione è particolarmente efficace nel disturbare il biofilm batterico e ridurre la presenza di batteri nel canale radicolare principale (Aydin et al. 2007, Machado et al. 2010, Gorduysus et al. 2011, Matos Neto et al. 2012). Sebbene l'istrumentazione manuale sia comunemente utilizzata dai professionisti, i sistemi rotanti automatizzati sono associati a diversi vantaggi rispetto alle tecniche manuali, inclusi procedure più rapide (Guelzow et al. 2005, Yin et al. 2010), preparazioni più centrate (Taşdemir et al. 2005, Aguiar et al. 2009) e minore estrusione apicale di detriti (Madhusudhana et al. 2010). In particolare, i sistemi ProTaper (Dentsply Maillefer, Ballaigues, Svizzera) e Mtwo (VDW, Monaco, Germania) hanno dimostrato di fornire una geometria adeguata (Yang et al. 2011) e una sostanziale riduzione batterica nel canale radicolare (Machado et al. 2010).
Recentemente, è stata proposta l'uso di strumenti con un file singolo a movimento reciproco. I sistemi che utilizzano questo approccio includono WaveOne (Dentsply Maillefer) e Reciproc (VDW), che differiscono essenzialmente nella loro sezione trasversale, ma sono simili a ProTaper e Mtwo, rispettivamente. Studi iniziali hanno dimostrato che l'uso di Reciproc o Mtwo porta a canali più puliti nel terzo apicale rispetto all'uso di WaveOne o ProTaper (Bürklein et al. 2012). Inoltre, è stato dimostrato che l'uso di WaveOne riduce la modifica morfologica del canale rispetto all'uso di ProTaper (Berutti et al. 2012). Tuttavia, pochi studi hanno valutato l'azione meccanica di questi sistemi in canali infetti.
L'obiettivo di questo studio era confrontare la riduzione batterica ottenuta da sistemi a movimento reciproco e rotatorio in canali radicolari contaminati con E. faecalis. La tecnica manuale è stata utilizzata come riferimento per il confronto. L'ipotesi nulla testata era che non ci siano differenze nella riduzione batterica promossa dai sistemi a movimento reciproco e rotatorio.
Materiali e metodi
Preparazione dei campioni
È stata ottenuta l'approvazione per questo studio dal Comitato Etico della Scuola di Odontoiatria dell'Università di São Paulo (194/2010). Sessantacinque canali radicolari distobuccali dei molari mascellari sono stati standardizzati a 12 mm e strumentati fino a una lunghezza di lavoro di 11 mm con un file K di dimensione 15 (Dentsply Maillefer) sotto irrigazione con acqua distillata. I canali radicolari sono stati riempiti con EDTA al 17% (Fórmula & Acão, São Paulo, SP, Brasile) per 3 minuti per rimuovere il film di smalto e lavati con 5 mL di acqua distillata. L'apice è stato coperto con resina composita (3M, Saint Paul, MN, USA) e la superficie radicolare esterna è stata sigillata con resina epossidica (Araldite; Brascola, Joinvile, SC, Brasile). I campioni sono stati fissati su piastre microtitolazione in polistirene a 24 pozzetti con resina acrilica e sterilizzati con ossido di etilene (Acecil, Campinas, SP, Brasile).
Contaminazione dei campioni
Una sospensione di E. faecalis (ATCC 29212) in brodo di soia triptica (TSB; Difco, Le Pont-de-Claix, RA, Francia) è stata preparata e standardizzata a 4 sulla scala di McFarland. Sessanta canali radicolari sono stati contaminati con la sospensione di E. faecalis tramite una siringa per insulina. I cinque canali radicolari rimanenti sono stati riempiti con TSB. I campioni sono stati incubati a 37 °C per 21 giorni. I contenuti dei canali radicolari sono stati sostituiti con TSB fresco ogni 48 h.
Dopo il periodo di incubazione, i canali radicolari sono stati riempiti con acqua distillata. I campioni (S1) sono stati raccolti con tre punti di carta sterilizzati di dimensione 15 (Dentsply Maillefer), che sono stati inseriti nei canali radicolari per 1 min ciascuno. I punti sono stati conservati in tubi contenenti 500 IL di acqua peptonata, e sono state preparate diluizioni seriali. Diverse diluizioni sono state piantate in triplice copia su terreno di coltura agar m-Enterococcus (Difco). Le piastre sono state incubate a 37 °C per 48 h, e il conteggio batterico è stato misurato (in CFU mL—1).
Strumentazione dei campioni
I campioni contaminati sono stati suddivisi in cinque gruppi, come descritto di seguito.
- Il Gruppo 1 è stato preparato con il file WaveOne Primary (dimensione punta 25, 0.08 taper) (Dentsply Maillefer). Con il motore in movimento reciproco (Dentsply Maillefer), il file è stato delicatamente inserito nel terzo cervicale e ritirato. Il file è stato inserito nel terzo medio e ritirato. Infine, il file è stato inserito nel terzo apicale fino alla lunghezza di lavoro con un'azione di spazzolamento eseguita contro le pareti.
- Il Gruppo 2 è stato preparato con il Reciproc R25 (dimensione punta 25, 0.08 taper) (VDW) in modo simile al gruppo 1.
- Il Gruppo 3 è stato preparato con il sistema ProTaper (Dentsply Maillefer). Il terzo cervicale è stato allargato con le punte Gates-Glidden 1, 2 e 3 (Dentsply Maillefer) e poi con la sequenza di strumenti SX e S2. I terzi medio e apicale sono stati strumentati con S1, S2, F1 e F2 (dimensione punta 25, 0.08 taper).
- Il Gruppo 4 è stato preparato con il sistema Mtwo (VDW). Il terzo cervicale è stato allargato con le punte Gates-Glidden 1, 2 e 3. I file sono stati introdotti direttamente fino alla lunghezza di lavoro con leggeri movimenti avanti e indietro, mentre la pressione in direzione apicale è stata gradualmente aumentata, e poi è stata eseguita un'azione di spazzolamento contro le pareti. La sequenza dei file era dimensione 10, 0.04 taper, dimensione 15, 0.05 taper, dimensione 20, 0.06 taper e dimensione 25, 0.06 taper.
- Il Gruppo 5 (controllo positivo) è stato preparato con la tecnica manuale crown-down. I terzi cervicale e medio sono stati allargati con le punte Gates-Glidden 1, 2 e 3, e poi un file K di dimensione 20 è stato inserito delicatamente fino alla lunghezza di lavoro utilizzando movimenti di un quarto di giro e limatura contro le pareti. Questo movimento è stato ripetuto fino a quando lo strumento non ha più incontrato resistenza, e il file era libero. Questi manovre sono state successivamente ripetute con file K di dimensione 25, 30 e 35.
I controlli negativi consistevano in cinque campioni non contaminati che sono stati strumentati secondo ciascun gruppo.
L'irrigazione durante la strumentazione è stata eseguita con un totale di 10 mL di acqua distillata utilizzando una siringa e un NaviTip da 29 gauge (Ultradent Products, South Jordan, UT, USA), che è stato inserito fino a 3 mm prima della lunghezza di lavoro con un movimento di avanti e indietro per un miglior flusso. Nei gruppi 1 e 2, l'irrigazione e l'esplorazione con un K-file di dimensione 15 sono state eseguite ogni volta dopo che lo strumento è stato ritirato. Nei gruppi 3, 4 e 5, l'irrigazione è stata ripetuta con ogni cambio di strumento.
Raccolta dati dopo la strumentazione
Per determinare il conteggio batterico (in CFU mL—1) immediatamente dopo la strumentazione (S2), è stata introdotta un'ulteriore quantità di 5 mL di acqua distillata dopo l'irrigazione finale. La limatura è stata quindi eseguita con un file Hedström di dimensione 25, introducendolo nel canale fino alla lunghezza di lavoro con colpi di limatura circonferenziali su tutte le superfici del canale radicolare. Il file è stato sezionato sotto il manico e lasciato cadere in un tubo contenente 500 IL di acqua peptonata. Tre punti di carta sterilizzati di dimensione 15 sono stati inseriti nel canale radicolare per 1 minuto ciascuno e sono stati conservati nello stesso tubo del file.
I canali radicolari sono stati riempiti con TSB e incubati a 37°C per 7 giorni. Un terzo campionamento è stato effettuato nello stesso modo di S2 per determinare il conteggio batterico a 7 giorni dopo l'istrumentazione (S3).
Analisi statistica
Ogni conteggio batterico è stato trasformato in log per l'analisi statistica. Il test t accoppiato è stato utilizzato per l'analisi intragruppo, e l'analisi della varianza (ANOVA) è stata utilizzata per l'analisi intergruppo. Il livello di significatività per tutte le analisi era P < 0.05.
Risultati
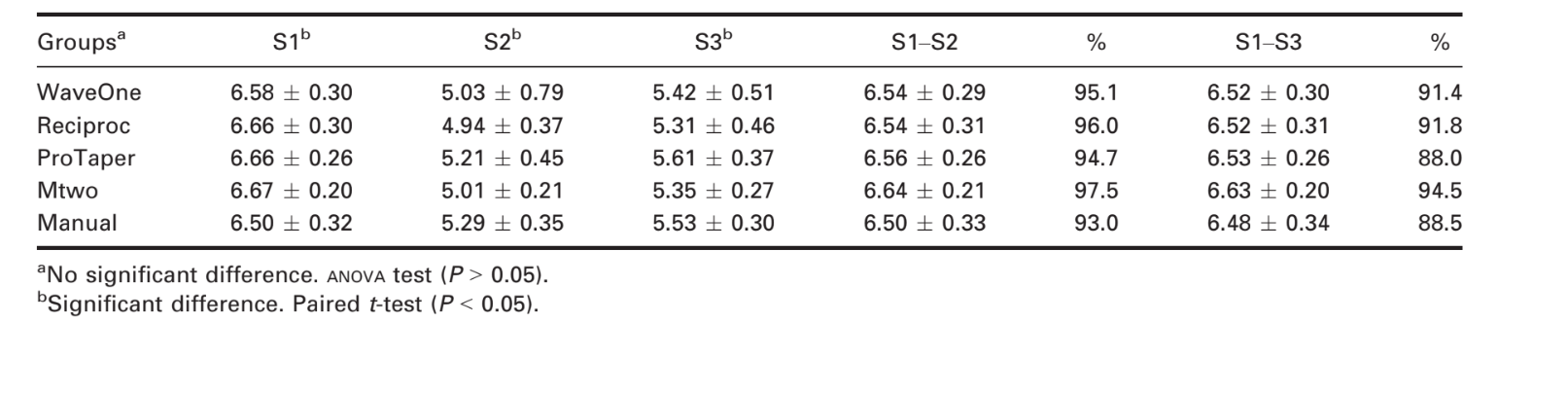
La Tabella 1 mostra i risultati per la riduzione batterica. I conteggi batterici in S2 e S3 sono stati ridotti rispetto a S1 per tutti i gruppi (P < 0.0001 tramite t-test). Questo risultato ha dimostrato che tutte le tecniche di preparazione sono state efficaci nel ridurre il conteggio batterico. Tuttavia, un confronto dei conteggi batterici in S2 e S3 ha rivelato una crescita batterica nei 7 giorni dopo l'istrumentazione (P < 0.01 tramite t-test). Il controllo negativo non ha mostrato alcuna crescita batterica, il che ha indicato che le condizioni asettiche sono state mantenute durante l'esperimento. Le tecniche reciprocanti, rotative e manuali hanno avuto risultati simili immediatamente e 7 giorni dopo l'istrumentazione (P = 0.78 e P = 0.76, rispettivamente, tramite ANOVA).
Discussione
L'eliminazione microbiologica è di fondamentale importanza nella terapia endodontica, poiché la presenza di batteri è la principale causa di fallimento endodontico (Kakehashi et al. 1965, Sakamoto et al. 2007). Sono state utilizzate molte metodologie per studiare questo concetto. Nel presente studio, sono state esaminate le radici dei molari. Il WaveOne Primary, il Reciproc R25 e il ProTaper F2 hanno la stessa dimensione della punta e conicità, il che rappresenta una limitazione in termini di disinfezione dei canali di grande diametro. È stata eseguita un'istruzione manuale fino a una dimensione 35, K-file con conicità 0.02. Tuttavia, da un punto di vista microbiologico, è stato riportato che l'uso di diverse dimensioni di punta e conicità porta a conteggi batterici simili (Machado et al. 2010).
Simile a molti studi precedenti (Siqueira et al. 1999, Aydin et al. 2007, Machado et al. 2010, Singla et al. 2010, Siqueira et al. 2010, Alves et al. 2011, Gorduysus et al. 2011, Alves et al. 2012, Matos Neto et al. 2012, Paranjpe et al. 2012), è stato utilizzato il metodo della coltura su piastra. Alves et al. (2011) hanno osservato risultati simili con la tecnica della reazione a catena della polimerasi come hanno fatto con il metodo della coltura su piastra. Sebbene altri autori abbiano confrontato la crescita batterica prima e dopo l'istruzione del canale radicolare senza limatura (Siqueira et al. 1999, Machado et al. 2010, Singla et al. 2010, Gorduysus et al. 2011, Matos Neto et al. 2012), la limatura è necessaria a causa della presenza di uno strato di fango, residui di biofilm e aree non strumentate che potrebbero influenzare i confronti tra i gruppi (Aydin et al. 2007, Siqueira et al. 2010, Alves et al. 2011, 2012, Paranjpe et al. 2012).
Il terzo campionamento a 7 giorni (S3) è stato utilizzato per verificare la crescita batterica nel canale radicolare tra le sedute (Siqueira et al. 2007). I conteggi batterici hanno mostrato una significativa riduzione batterica in tutte le tecniche di strumentazione sia a S2 che a S3 rispetto ai controlli. Tuttavia, il confronto tra S2 e S3 ha rivelato una significativa crescita batterica nel canale principale. Questo risultato contraddice i risultati trovati da Siqueira et al. (2007), che hanno utilizzato medicazioni intracanalari tra le sedute. I batteri rimanenti all'interno dei tubuli dentinali nel nostro studio potrebbero essersi moltiplicati ed essere entrati nel canale principale. L'uso di un brodo di coltura ricco di nutrienti nel canale radicolare per 7 giorni ha ovviamente favorito la crescita batterica.
Non sono state osservate differenze statisticamente significative tra tecniche e sistemi, in linea con i risultati di saggi che confrontano tecniche manuali con sistemi rotanti (Dalton et al. 1998, Siqueira et al. 1999, Chuste-Guillot et al. 2006, Matos Neto et al. 2012). Studi precedenti hanno osservato riduzioni batteriche medie dell'81,94% per ProTaper e dell'84,29% per Mtwo (P > 0,05) (Machado et al. 2010). Sebbene anche il presente studio non abbia trovato differenze tra questi sistemi, le riduzioni medie sono state del 94,71% per ProTaper e del 97,43% per Mtwo.
Nel presente rapporto, nessuno dei campioni era completamente privo di batteri. Al contrario, Coldero et al. (2002) ha osservato che l'81% dei campioni preparati con la tecnica manuale era privo di batteri. Questa differenza dovrebbe essere considerata alla luce del fatto che una crescita batterica molto piccola non può essere rilevata dai metodi di coltura tradizionali (Siqueira & Rôcas 2005).
Nel presente studio, sono state ottenute riduzioni del conteggio batterico del 95,1% immediatamente dopo e del 91,4% a 7 giorni dopo l'istrumentazione con i sistemi a reciprocità senza l'uso di agenti chimici. Questi risultati erano comparabili a quelli ottenuti con tecniche convenzionali (cioè 94,7% e 88%, rispettivamente, per i sistemi rotanti e 93% e 88,5%, rispettivamente, per i sistemi manuali). Pertanto, i sistemi a file singola a reciprocità hanno portato a riduzioni batteriche simili rispetto a quelle ottenute con i sistemi rotanti o con la tecnica manuale.
Conclusione
Si può concludere che tutti i sistemi testati hanno ridotto i conteggi batterici a un livello simile.
M. E. L. Machado, C. K. Nabeshima, M. F. P. Leonardo, F. A. S. Reis, M. L. B. Britto & S. Cai
Riferimenti:
- Aguiar CM, Mendes DA, Câmara AC, Figueiredo JAP (2009) Valutazione della capacità di centratura del sistema rotante ProTaper Universal in radici curve in confronto ai file Nitiflex. Australian Endodontic Journal 35, 174–9.
- Alves FRF, Almeida BM, Neves MAS, Rôças IN, Siqueira JFJr (2011) Effetti antibatterici dipendenti dal tempo del file auto-regolante utilizzato con due concentrazioni di ipoclorito di sodio. Journal of Endodontics 37, 1451–5.
- Alves FRF, Rôças IN, Almeida BM, Neves MAS, Zoffoli J,Siqueira JF Jr (2012) Analisi molecolari quantitative e culturali dell'eliminazione batterica nei canali radicolari ovali mediante una tecnica di strumentazione a file singolo. International Endodontic Journal 45, 871–7.
- Aydin C, Tunca YM, Senses Z, Baysallar M, Kayaoglu G, Ørstavik D (2007) Riduzione batterica mediante strumentazione del canale radicolare estensiva rispetto a quella conservativa in vitro. Acta Odontologica Scandinavica 65, 167–70.
- Berutti E, Chiandussi G, Paolino DS et al. (2012) Modellamento del canale con file reciprocanti WaveOne Primary e sistema ProTaper: uno studio comparativo. Journal of Endodontics 38, 505–9.
- Bürklein S, Hinschitza K, Dammaschke T, Schäfer E (2012) Capacità di modellamento ed efficacia di pulizia di due sistemi a file singolo in canali radicolari severamente curvi di denti estratti: Reciproc e WaveOne rispetto a Mtwo e ProTaper. International Endodontic Journal 45, 449–61.
- Chuste-Guillot M-P, Badet C, Peli J-F, Perez F (2006) Effetto di tre tecniche di file rotanti in nichel-titanio sulla riduzione della dentina radicolare infetta. Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology, and Endodontology 102, 254–8.
- Coldero LG, McHugh S, Mackenzie D, Saunders WP (2002) Riduzione dei batteri intracanalari durante la preparazione del canale radicolare con e senza ingrandimento apicale. International Endodontic Journal 35, 437–46.
- Dalton BC, Ørstavik D, Pettiette M, Trope M (1998) Riduzione batterica con strumentazione rotante in nichel-titanio. Journal of Endodontics 24, 763–7.
- Gorduysus M, Nagas E, Torun OY, Gorduysus O (2011) Un confronto tra tre sistemi rotanti e la tecnica di strumentazione manuale per l'eliminazione di Enterococcus faecalis dal canale radicolare. Australian Endodontic Journal 37, 128–33.
- Guelzow A, Stamm O, Martus P, Kielbassa AM (2005) Studio comparativo di sei sistemi rotanti in nichel-titanio e strumentazione manuale per la preparazione del canale radicolare. International Endodontic Journal 38, 743–52.
- Kakehashi S, Stanley HR, Fitzgerald RJ (1965) Gli effetti delle esposizioni chirurgiche delle pulpe dentali in ratti da laboratorio germ-free e convenzionali. Oral Surgery, Oral Medicine, Oral Pathology 20, 340–9.
- Machado MEL, Sapia LAB, Cai S, Martins GHR, Nabeshima CK (2010) Confronto tra due sistemi rotanti nella preparazione del canale radicolare riguardo alla disinfezione. Journal of Endodontics 36, 1238–40.
- Madhusudhana K, Mathew VB, Reddy NM (2010) Estrusione apicale di detriti e irriganti utilizzando sistemi di strumentazione manuale e tre rotanti – uno studio in vitro. Contemporary Clinical Dentistry 1, 234–6.
- Matos Neto M, Santos SSF, Leão MVP, Habitante SM, Rodrigues JRDD, Jorge AOC (2012) Efficacia di tre sistemi di strumentazione per rimuovere Enterococcus faecalis da canali radicolari. International Endodontic Journal 45, 435–8.
- Pappen FG, Shen Y, Qian W, Leonardo MR, Giardino L, Haapasalo M (2010) Azione antibatterica in vitro di Tetraclean, MTAD e cinque soluzioni di irrigazione sperimentali. International Endodontic Journal 43, 528–35.
- Paranjpe A, Gregorio C, Gonzalez AM et al. (2012) Efficacia del sistema di file auto-regolante sulla pulizia e modellamento di canali ovali: una valutazione microbiologica e microscopica. Journal of Endodontics 38, 226–31.
- Sakamoto M, Siqueira JF Jr, Rôças IN, Benno Y (2007) Riduzione batterica e persistenza dopo procedure di trattamento endodontico. Oral Microbiology and Immunology 22, 19–23.
- Sedgley CM, Lennan SL, Appelbe OK (2005) Sopravvivenza di Enterococcus faecalis in canali radicolari ex vivo. International Endodontic Journal 38, 735–42.
- Shen Y, Stojicic S, Haapasalo M (2011) Efficacia antimicrobica della clorexidina contro i batteri nei biofilm in diverse fasi di sviluppo. Journal of Endodontics 37, 657–61.
- Singla M, Aggarwal V, Logani A, Shah N (2010) Valutazione comparativa del ProTaper rotante, Profile e della tecnica convenzionale stepback sulla riduzione delle unità formanti colonie di Enterococcus faecalis e sulla resistenza alla frattura verticale delle radici dei canali. Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology, and Endodontology 109, e105–10.
- Siqueira JF Jr, Rôças IN (2005) Sfruttare metodi molecolari per esplorare le infezioni endodontiche: parte 1: tecnologie molecolari attuali per la diagnosi microbiologica. Journal of Endodontics 31, 411–23.
- Siqueira JF Jr, Lima KC, Magalhães FAC, Lopes HP, Uzeda M (1999) Riduzione meccanica della popolazione batterica nel canale radicolare mediante tre tecniche di strumentazione. Journal of Endodontics 25, 332–5.
- Siqueira JF Jr, Paiva SSM, Rôças IN (2007) Riduzione della popolazione batterica coltivabile nei canali radicolari infetti mediante un protocollo antimicrobico a base di clorexidina. Journal of Endodontics 33, 541–7.
- Siqueira JF Jr, Alves FRF, Almeida BM, Oliveira JCM, Rôças IN (2010) Capacità di preparazione chemomeccanica con strumenti rotanti o file auto-regolanti di disinfettare canali radicolari ovali. Journal of Endodontics 36, 1860–5.
- Taşdemir T, Aydemir H, Inan U, Ünal O (2005) Preparazione del canale con strumenti rotanti in Ni-Ti Hero 642 rispetto a file K manuali in acciaio inossidabile valutata mediante tomografia computerizzata. International Endodontic Journal 38, 402–8.
- Yang G, Yuan G, Yun X, Zhou X, Liu B, Wu H (2011) Effetti di due sistemi di strumenti in nichel-titanio, Mtwo rispetto a ProTaper universal, sulla geometria del canale radicolare valutata mediante micro-tomografia computerizzata. Journal of Endodontics 37, 1412–6.
- Yin X, Cheung GS, Zhang C, Masuda YM, Kimura Y, Matsumoto K (2010) Confronto micro-tomografico degli strumenti rotanti in nichel-titanio rispetto agli strumenti tradizionali nel sistema del canale radicolare a forma di C. Journal of Endodontics 36, 708–12.

/social-network-service/media/default/102339/cc73e2fd.png)