Morphologie des Aedeagus als diskriminierendes Merkmal bei zwei eng verwandten cactophilen Arten von Drosophila (Diptera; Drosophilidae) in Südamerika
Tradução automática
O artigo original está escrito em EN language (link para lê-lo).
Zusammenfassung
Drosophila serido und D. antonietae sind Schwesterarten, die zur Drosophila buzzatii-Gruppe gehören. Morphologisch können sie nur durch quantitative Merkmale unterschieden werden. In dieser Arbeit analysieren wir die Länge und die gleichmäßige durchschnittliche Krümmung von vier Regionen des Aedeagus von D. antonietae und D. serido. Exemplare von D. serido und D. antonietae wurden in 96,74 % der Fälle korrekt klassifiziert. Basierend nur auf dem Merkmal, das am meisten zur Unterscheidung der Gruppen beigetragen hat (gleichmäßige durchschnittliche Krümmung des Bogens IV des Aedeagus), beobachteten wir eine signifikante intra-spezifische morphologische Divergenz in D. serido im Vergleich zu D. antonietae, was mit anderen Markern übereinstimmt. Die hohe morphologische Divergenz in der gleichmäßigen durchschnittlichen Krümmung des Bogens IV des Aedeagus zeigt, dass sich diese Region schneller entwickelt hat als andere, seit der Divergenz der beiden Arten. Die Bedeutung der vorliegenden Studie für das Verständnis der genetischen Grundlagen, die die Bildung des Aedeagus bei den Arten der Drosophila buzzatii-Gruppe steuern, wird diskutiert.
Einführung
Morphologische Merkmale wurden historisch in evolutionären und taxonomischen Studien verwendet. Dennoch erschwert das Fehlen qualitativer morphologischer Unterschiede zwischen Schwesterarten die Festlegung der diagnostischen morphologischen Merkmale zwischen ihnen. In vielen Fällen sind quantitative Variationen morphometrischer Merkmale ausreichend, um Schwesterarten zu unterscheiden (Moreteau et al. 2003, Moraes et al. 2004).
Die Morphologie des Aedeagus (äußere männliche Geschlechtsorgane) ist von extremer Bedeutung für die taxonomische Charakterisierung von Drosophila Arten (Vilela 1983, Silva und Sene 1991, Liu et al. 1996, Moreteau et al. 2003, Kullikov et al. 2004), ebenso wie bei anderen Diptera. Quantitative Variationen in den morphologischen Eigenschaften des Aedeagus wurden ebenfalls zur Unterscheidung der Schwesterarten von Drosophila verwendet (Silva und Sene 1991, Kullikov et al. 2004). In der Drosophila repleta Gruppe, die mehr als 90 neotropische Arten umfasst, werden die meisten als Schwesterarten betrachtet. Es gibt jedoch einen ausgeprägten Unterschied in der Form der Aedeagi (Form + Größe) zwischen ihnen, der als das Hauptdiagnosemerkmal in der Gruppe angesehen wird (Vilela 1983).
Der Drosophila buzzatii-Cluster (repleta-Gruppe, mulleri-Untergruppe, buzzatii-Komplex) ist eine monophyletische Gruppe, die aus sieben verwandten cactophilen Arten besteht: D. buzzatii, D. borborema, D. koepferae, D. antonietae, D. gouveai, D. serido und D. seriema. In diesem Cluster wurden quantitative Unterschiede der morphologischen Merkmale des Flügels (Moraes et al. 2004) und der männlichen Genitalien (Silva und Sene 1991, Tidon-Sklorz und Sene 1995, Prado et al. 2004) erfolgreich zur Unterscheidung von Arten und Populationen verwendet. Unter den sieben Arten dieses Clusters weisen D. buzzatii und D. borborema Aedeagi auf, die sich in Form und Größe von den anderen Arten unterscheiden (Tidon-Sklorz und Sene 1995). Die Aedeagus-Morphologie der anderen Arten des Clusters ähnelt jedoch dem sogenannten D. serido-Aedeagus-Typ (Abbildung 1a) und basierend auf dieser Beobachtung wurden diese Arten zunächst als zur gleichen Art gehörend klassifiziert (Vilela und Sene 1977). Um das Aedeagus dieser Arten zu untersuchen, unterteilten Silva und Sene (1991) es in vier Hauptregionen, die durch Landmarken begrenzt sind (Abbildung 1b). Jede Region, die durch zwei benachbarte Landmarken begrenzt ist, wurde als Bogen bezeichnet. Basierend auf der Länge der Bögen identifizierten die Forscher fünf verschiedene Typen von Aedeagus, die von A bis E benannt wurden und spezifisch für jede Art sind.
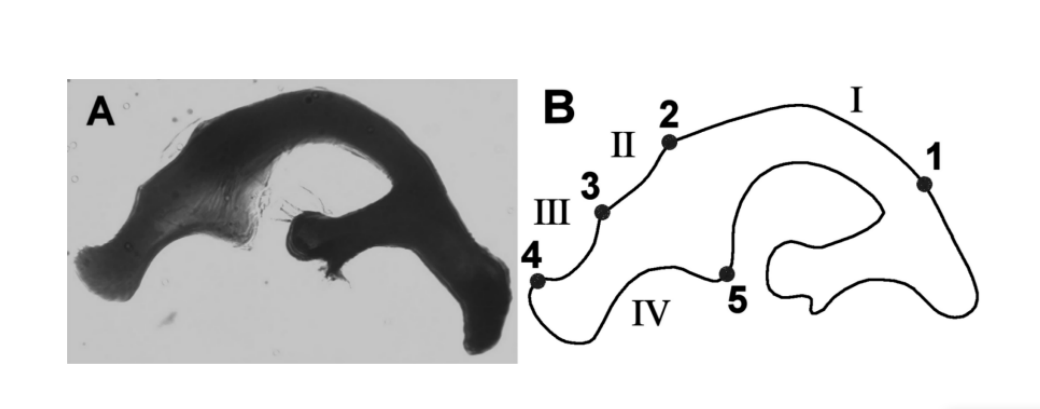
Drosophila serido und D. antonietae sind zwei Schwesterarten, die zur Drosophila buzzatii-Gruppe gehören, die in dieser Studie analysiert wurde. D. antonietae kommt in mesophilen Wäldern in den Regionen des Paraná-Paraguay-Beckens in Südamerika vor, assoziiert mit dem Kaktus Cereus hildemannianus (Tidon-Sklorz und Sene 2001). D. serido ist in der nordöstlichen Caatinga und an der Atlantikküste Brasiliens verbreitet, von Nordosten bis zur südlichen Region Brasiliens, assoziiert mit einer Reihe von Kaktusgattungen (Pereira et al. 1983). An der südlichen Grenze der Verbreitung von D. serido gibt es ein Kontaktgebiet mit D. antonietae (A.C. Morales et al., unveröffentlichte Daten). Obwohl D. serido und D. antonietae unterschiedliche metaphasische Platten aufweisen (Baimai et al. 1983), alloenzymatische Muster (A.C. Morales et al., unveröffentlichte Daten, Mateus und Sene 2003), mitochondrialen Haplotyp (Manfrin et al. 2001) und Satelliten-DNA (Kuhn und Sene 2005), teilen sie sich die gleiche feste chromosomale Inversion 2x7 (Ruiz et al. 2000), was auf eine enge phylogenetische Beziehung hindeuten könnte. In morphologischen Begriffen können nur quantitative Variationen diese beiden Arten unterscheiden (Silva und Sene 1991, Moraes et al. 2004).
In diesem Papier wurden die morphometrischen Merkmale des Aedeagus von D. antonietae-Exemplaren aus mehreren verschiedenen Populationen analysiert, die das gesamte bekannte Verbreitungsgebiet der Art abdecken, sowie von D. serido-Exemplaren aus zwei verschiedenen Populationen. Wir haben diese Arten ausgewählt, weil sie durch genetische Marker differenziert werden können und durch das Vorhandensein eines sekundären Kontaktgebiets, mit einer Population in Sympatrie, möglicherweise Hybriden in der südlichen Region Brasiliens gebildet werden können. Neben den Längenmessungen des Bogens des Aedeagus, die bereits in Silva und Sene (1991) verwendet wurden, wurden auch Krümmungsmaße dieser Bögen verwendet (Prado et al. 2004). Unsere Hauptziele waren es, die Verwendung der Krümmungsmaße in den Arten des Drosophila buzzatii-Clusters einzuführen und zu testen sowie die Regionen des Aedeagus zu bestimmen, die am meisten zur Unterscheidung der Arten D. serido und D. antonietae beigetragen haben. Die hier diskutierten Daten heben die Bedeutung dieser Regionen des Aedeagus für zukünftige Forschungen hervor, um die genetische Basis des Aedeagus der Arten des Drosophila buzzatii-Clusters zu verstehen, sowie für Studien über das Kontaktgebiet zwischen den beiden Arten.
Material und Methoden
Proben
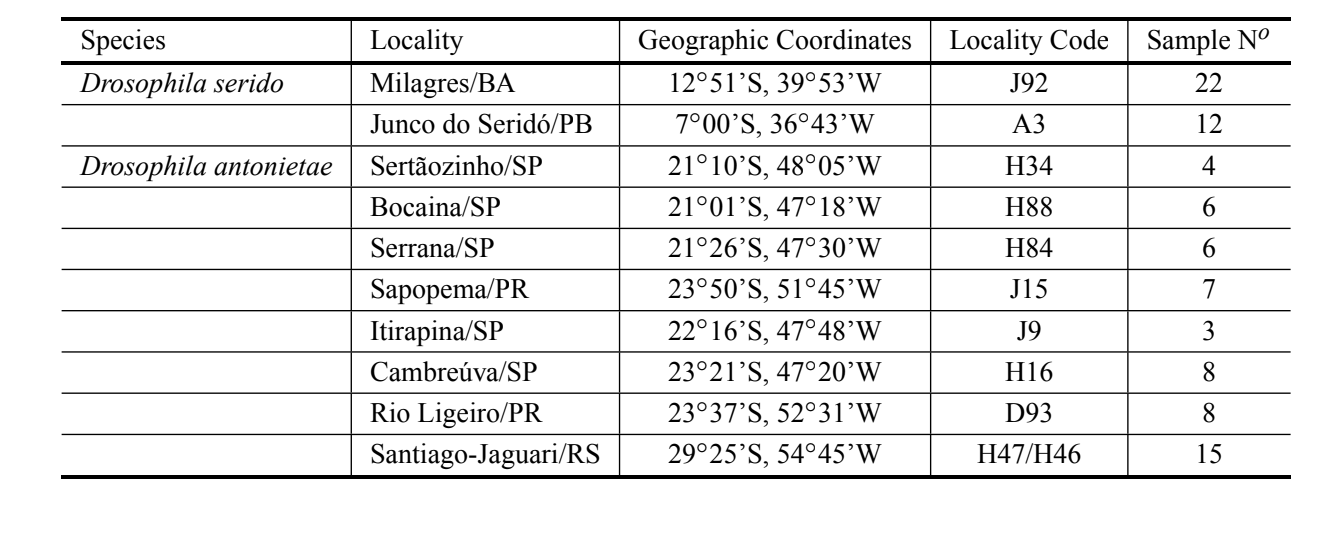
Achtundfünfzig Aedeagi wurden von der Art D. antonietae aus mehreren verschiedenen Populationen analysiert, die die gesamte Verbreitung repräsentieren, sowie 34 Aedeagi von D. serido, die zu Populationen in Junco do Seridó/PB und Milagres/BA (Typlokalisation) gehören (Tabelle I). Alle analysierten Individuen wurden in natürlichen Umgebungen (wild gefangene Fliegen) gesammelt. Die Aedeagi wurden in Scheiben für die optische Mikroskopie gemäß Kaneshiro (1969) vorbereitet. Alle in diesem Papier verwendeten Aedeagi wurden im Evolutionsgenetik-Labor der USP – Ribeirão Preto deponiert. Die Bilder der Aedeagi wurden 200-fach vergrößert und digitalisiert von einem Mikroskop (Axioplan2 Zeiss), das mit dem Axiovision Zeiss digitalen Bildaufnahme-System ausgestattet war und auf einem Computer gespeichert wurde.
Messung und Statistische Analyse
Fünf Punkte wurden manuell als Landmarken definiert, gemäß Silva und Sene (1991). Die Landmarken wurden verwendet, um die inneren Konturen der untersuchten Region festzulegen; die Regionen zwischen zwei benachbarten Landmarken sind die Bögen (Abbildung 1b).
Wie in Silva und Sene (1991) wurde die Länge der Bögen I, II, III und IV des Aedeagus gemessen (Tabelle II). Dies misst die akkumulierte Distanz zwischen den aufeinanderfolgenden Landmarken. Darüber hinaus führten wir auch gleichmäßige Messungen der Krümmung der Bögen durch. Kurz gesagt, die kontinuierliche Krümmung ist ein geometrisches Maß, das die Änderungsrate des Winkels zwischen der Tangente der Kurve und der Achse x ausdrückt (Costa et al. 2004). Die Werte der gleichmäßigen Krümmung werden durch Standardisierung mittels einer Sigmoidfunktion der kontinuierlichen Krümmung erzeugt, um die Punkte mit niedriger Krümmung der interessierenden Region zu verstärken (Costa und Cesar 2000). Diese Phase ermöglicht die Maximierung der Informationen über die Krümmung der analysierten Struktur. Um die Analysen durchzuführen, verwendeten wir die Mittelwerte der gleichmäßigen Krümmungen der Bögen I, II, III und IV des Aedeagus (Tabelle II). Die Messungen wurden gemäß der von Prado et al. (2004) beschriebenen Methodik durchgeführt.
Wir führten drei verschiedene Diskriminanzanalysen durch, wobei wir ausschließlich die Maße der Länge des Bogens (Diskriminanz I) und die gleichmäßige durchschnittliche Krümmung (Diskriminanz II) sowie eine Diskriminanzanalyse unter Verwendung aller Maße zusammen (Diskriminanz III) verwendeten. Diese Analysen wurden durchgeführt, um korrekte Klassifikationsprozentsätze von Individuen zu erhalten, um zu überprüfen, welche Variablen mehr zur Diskriminierung der Gruppen beitrugen, und um die Verwendung der Krümmungsmaße mit den zuvor von Silva und Sene (1991) durchgeführten Längenmaßen des Bogens zu vergleichen. Die niedrigeren Werte von Wilks Lambda (die von 0 bis 1 variieren) zeigen eine bessere Analyse an. Darüber hinaus wurde mit den Daten der Diskriminanzanalyse III eine Analyse der kanonischen Variablen durchgeführt. Die Analyse der diskriminierenden und kanonischen Variablen wurde mit der Software Splus (Version 1.8) durchgeführt.
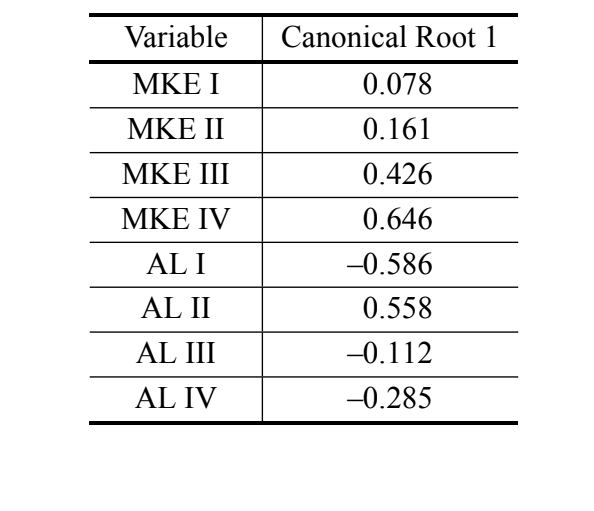
Der Betrag der kanonischen standardisierten Koeffizienten, die durch die Analyse der kanonischen Variablen erzeugt werden, stellt das Gewicht jeder Variablen bei der Bildung der kanonischen Wurzel dar, wobei höhere Werte mit der größten Differenzierung zwischen den Gruppen korrelieren. Diese Koeffizienten werden präsentiert, um den relativen Beitrag jeder Variablen zur Bildung der erhaltenen kanonischen Wurzel zu zeigen und um zu bestimmen, welche Variable am wichtigsten für die Diskriminierung der Gruppen ist.
Neben der multivariaten Analyse wurde das wichtigste Maß zur Diskriminierung der Arten einzeln verwendet, um den korrekten Prozentsatz der Klassifizierung der Individuen durch die bayesianische Klassifizierungsmethode (Duda et al. 2000) zu erhalten. Dazu wurden Normalverteilungen aus dem Durchschnitt und der Standardabweichung jeder Gruppe in Bezug auf die Variable festgelegt, die die Dichtefunktion und die Wahrscheinlichkeit definiert, die in der bayesianischen Analyse verwendet werden.
Ergebnisse
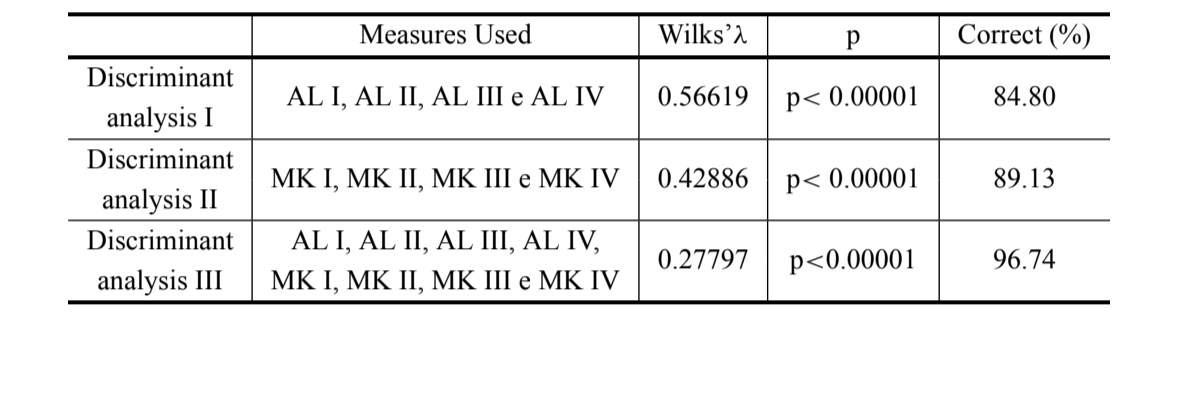
Die Ergebnisse der drei durchgeführten Diskriminanzanalysen sind in Tabelle III dargestellt. Die Diskriminierung zwischen D. antonietae und D. serido ist höher, wenn die Längen der Aedeagusbögen zusammen mit den Krümmungsmaßen verwendet werden (Diskriminante III) (Wilks’ λ = 0.27797; p<0.00001), wobei 96.74% der Individuen korrekt klassifiziert werden (Tabelle III), die korrekte Klassifizierung von D. antonietae beträgt 98.30% und von D. serido beträgt 94.10%.
In der Analyse der kanonischen Variablen unter Verwendung der Maße der Diskriminanzanalyse III wurde nur eine kanonische Achse erhalten. Die kanonischen standardisierten Koeffizienten (das Gewicht jeder Variablen) sind in Tabelle IV dargestellt. Die absoluten Werte dieser Koeffizienten zeigen, dass die wichtigste Variable für die Bildung der kanonischen Wurzel MKE IV war, während die am wenigsten wichtige die Variable MKE I war. Die Normalverteilungen, die durch den Durchschnitt und die Standardabweichung der beiden Gruppen in Bezug auf die kanonischen Werte erhalten wurden, sind in Abbildung 2 dargestellt, in der wir die Diskriminierung zwischen D. antonietae (höhere kanonische Werte) und D. serido (niedrigere kanonische Werte) beobachten können.
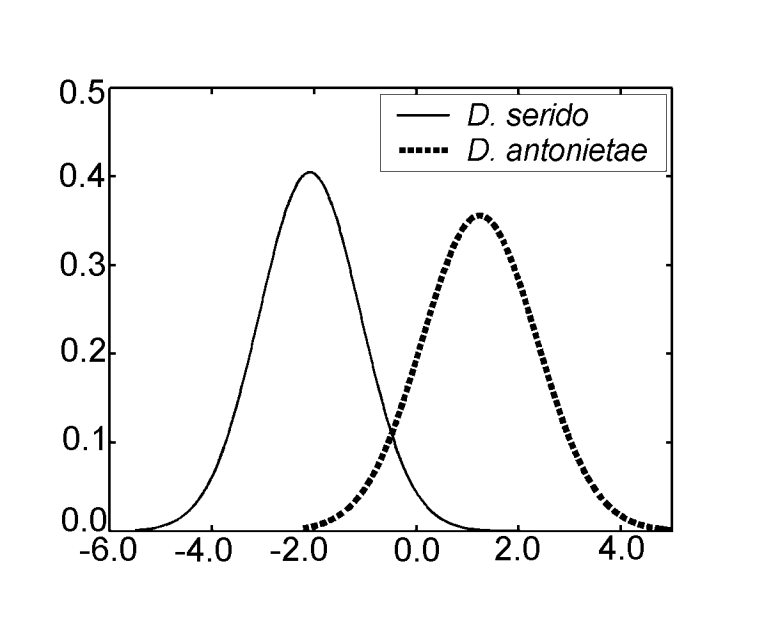
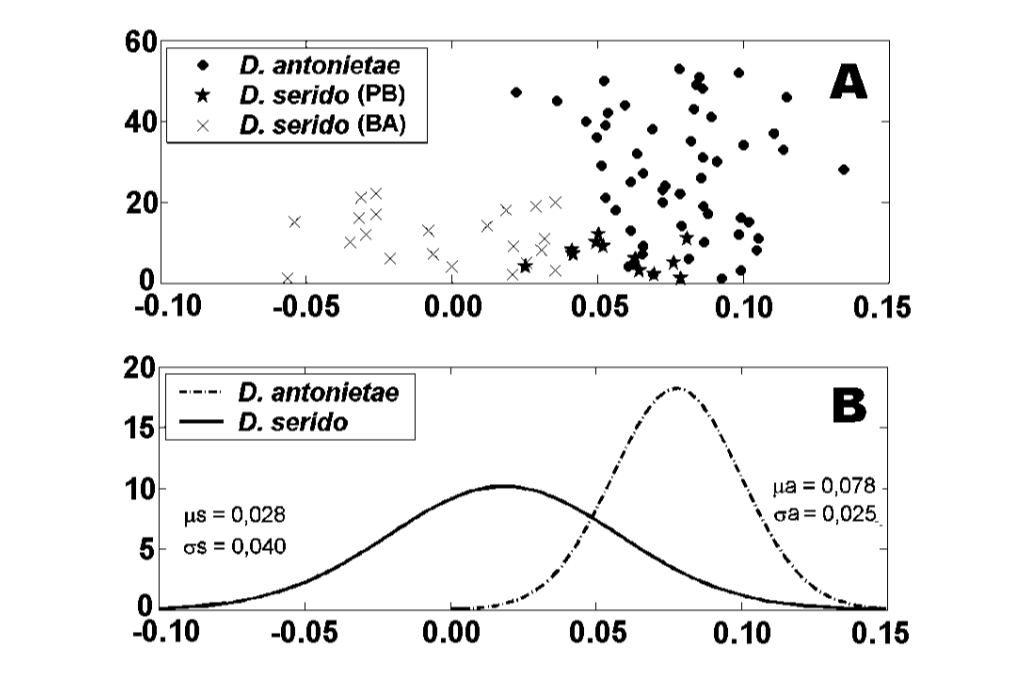
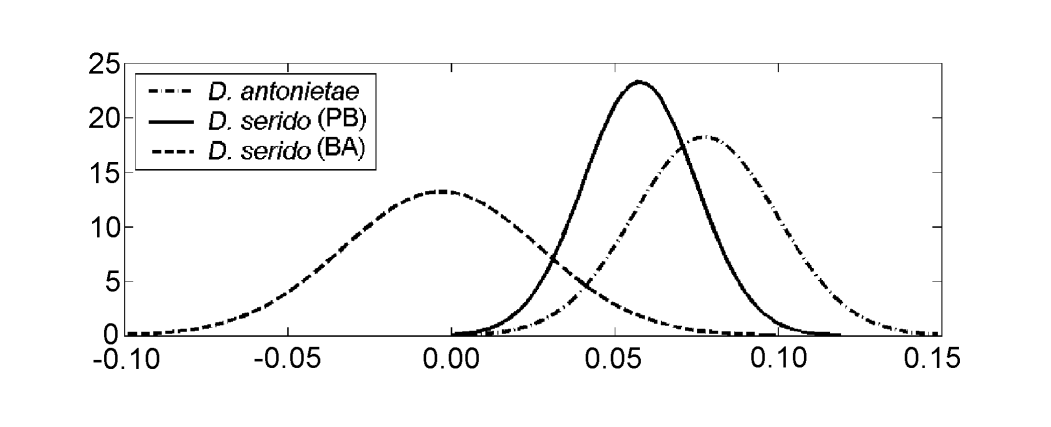
Die Werte für jedes Individuum, die aus der Analyse von MKE IV gewonnen wurden, sind in Abbildung 3a dargestellt. In Bezug auf dieses Maß hat D. serido eine höhere Variation um den Durchschnitt (Standardabweichung = 0,04) als D. antonietae (Standardabweichung = 0,025) (Abbildung 3b), hauptsächlich weil es signifikante Unterschiede in Bezug auf dieses Maß zwischen beiden Populationen gibt, die die Stichprobe von D. serido bilden (Abbildung 3a; Abbildung 4).
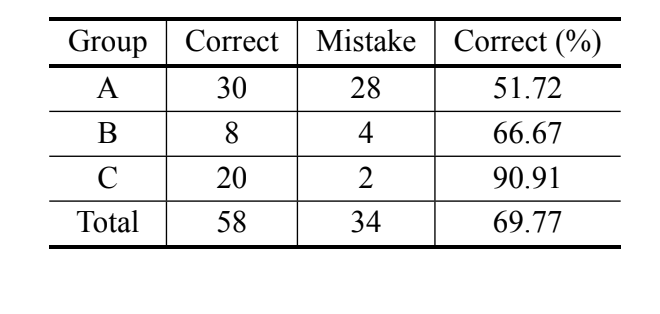
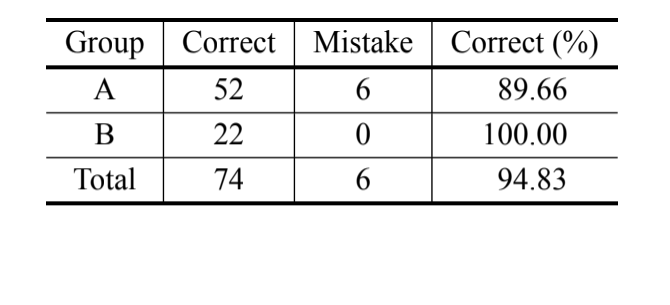
Gemäß der bayesianischen Analyse, die sich nur auf das MKE IV-Maß stützt, wurden 69,8 % der Individuen korrekt klassifiziert und über 90 % der Individuen von D. serido aus Milagres/BA wurden korrekt klassifiziert. Dennoch wurde ein hoher Prozentsatz an Fehlern bei den Individuen von D. serido aus Junco do Seridó/PB und
D. antonietae (Tabelle V) beobachtet. Die gleiche Analyse wurde ohne die Individuen von D. serido aus Junco do Seridó/PB durchgeführt und der Prozentsatz der korrekten Klassifikationen betrug 94,83 % (Tabelle VI), was eine extreme Divergenz zwischen den Individuen der Population von D. serido aus Milagres/BA und D. antonietae basierend auf MKE IV zeigt.
Diskussion
Unsere Daten bestätigen die Existenz quantitativer Unterschiede in den morphologischen Merkmalen des Aedeagus der analysierten Individuen, was die Unterscheidung von D. serido von D. antonietae ermöglicht. Darüber hinaus war die gleichmäßige durchschnittliche Krümmung des Bogens IV (MKE IV) die Variable, die am meisten zur Unterscheidung der Gruppen beigetragen hat (Tabelle IV).
Die Länge der ersten vier Bögen des Aedeagus wurde bereits erfolgreich zur Unterscheidung von Arten des Drosophila buzzatii-Clusters verwendet, darunter D. serido und D. antonietae (Aedeagus Typ A und D, jeweils in Silva und Sene 1991). In dieser Arbeit fanden wir einen erheblichen Anstieg in der Unterscheidung der Gruppen, indem wir Maße der gleichmäßigen durchschnittlichen Krümmung in die morphometrische Analyse einbezogen, bei der 96,74 % der Individuen korrekt klassifiziert werden (Tabelle III). Somit sind die Maße der gleichmäßigen durchschnittlichen Krümmung wichtig für die Unterscheidung von D. antonietae und D. serido und könnten nützlich sein für das Studium einer Zone der Sympatrie zwischen diesen Arten in der südlichen Region Brasiliens. Da Krümmungsmaße die Größe der Struktur nicht berücksichtigen, ist es möglich zu schließen, dass kleine quantitative Veränderungen in der Form des Aedeagus, insbesondere im Bereich des Bogens IV, seit dem Ereignis der Kladegenese der Arten D. serido und D. antonietae aufgetreten sein könnten.
Es gibt eine signifikante morphologische Divergenz in Bezug auf MKE IV zwischen D. antonietae und D. serido, da D. antonietae relativ weniger Variation um den Durchschnitt zeigt als D. serido (Abbildung 3b). Individuen aus verschiedenen Populationen, die das gesamte Verbreitungsgebiet der D. antonietae Populationen repräsentieren (Tabelle I), wurden analysiert; in dieser Probe deuten die Daten darauf hin, dass es Homogenität unter den D. antonietae Populationen gibt. Monteiro und Sene (1995) analysierten die Morphologie des Aedeagus von Individuen aus mehreren Populationen von
D. antonietae durch die morphometrische Methode des Truss-Netzwerks und beobachteten ebenfalls keine morphologischen Unterschiede zwischen ihnen. Alloenzymatische (Mateus und Sene 2003) und Mikrosatellitenmuster (L.P.B. Machado et al., unveröffentlichte Daten) zeigten ebenfalls Homogenität unter den verschiedenen Populationen von D. antonietae. Diese Ergebnisse deuten auf einen Genfluss zwischen den Populationen von D. antonietae hin, begünstigt durch die Assoziation dieser Art mit ihrem Wirt-Kaktus, Cereus hildmaniannus , der in mesophilen Galeriewäldern entlang der Flüsse des Paraná-Paraguay-Beckens vorkommt, die Migrationskorridore für Individuen der Art D. antonietae bilden (Monteiro und Sene 1995).
Drosophila serido hat im Vergleich zu MKE IV eine höhere interspezifische Variation in Bezug auf D. antonietae (Abbildung 3b), wie die Unterschiede zwischen den Individuen der Populationen von Junco do Seridó/PB und Milagres/BA zeigen. Die Individuen von D. serido aus der Population von Junco do Seridó/PB weisen intermediäre Werte für MKE IV auf, die zwischen denen der Populationen von D. serido in Milagres/BA und den analysierten Populationen von D. antonietae liegen (Abbildung 4). Diese Daten deuten auf eine morphologische Differenzierung zwischen beiden Populationen von D. serido hin, wahrscheinlich aufgrund der Einschränkung des Genflusses zwischen ihnen. Zwischen den brasilianischen Bundesstaaten Bahia und Pernambuco gibt es einen großen Fluss, den São Francisco, der als geografische Barriere wirken könnte und den Genfluss zwischen den in diesem Papier analysierten Populationen von D. serido verhindert. Morphologische Divergenzen zwischen den Populationen von D. serido stimmen mit anderen Arbeiten überein, da diese Art in Bezug auf andere Marker polytypisch ist. Die nordöstlichen Populationen von D. serido haben Typ I metaphasische Platten, während einige Küstenpopulationen Typ III (Arraial do Cabo/RJ) und Typ IV (Peruíbe/SP) metaphasische Platten aufweisen (Baimai et al. 1983). Was die chromosomalen Inversionen betrifft, so teilen alle Populationen von D. serido die feste Inversion 2x7, vier polymorphe Inversionen sind jedoch auf nordöstliche Populationen beschränkt (2a8, 2b8, 2c8 und 2d8) und zwei feste Inversionen (2x8 und 2w8) kommen in Küstenpopulationen vor (Tosi und Sene 1989, Ruiz et al. 2000). Darüber hinaus sind die D. serido Populationen aus dem nordöstlichen Brasilien reproduktiv teilweise von der Population von Arraial do Cabo/RJ entlang der brasilianischen Küste isoliert (N.M.V. Bizzo, unveröffentlichte Daten). Neuere Studien deuten auch auf eine Diskriminierung zwischen den Populationen von D. serido im Nordosten und Küsten-Brasilien basierend auf der Differenzierung mitochondrialer Haplotypen hin (A.C. Morales et al., unveröffentlichte Daten).
Die Differenzierung zwischen Populationen derselben Art ist eine wichtige Voraussetzung im Prozess der Artbildung. Daher sind Studien, die eine Vielzahl von Populationen einer polytypischen Art wie D. serido einbeziehen, wichtig, um die morphologische Divergenz in Bezug auf die genetische Divergenz in natürlichen Populationen zu quantifizieren.
Nicht alle Bögen des Aedeagus sind gleichermaßen informativ für die Unterscheidung der Arten. Laut Silva und Sene (1991) sind die Bögen II und III (Abbildung 1) die informativsten für die Unterscheidung der Arten im Drosophila buzzatii-Cluster. Im Vergleich paarweise, unter Verwendung der Truss-Netzwerk-Methode, waren die Maße, die sich auf Bogen III beziehen, die signifikantesten bei der Unterscheidung zwischen
D. antonietae und D. gouveai (Monteiro und Sene 1995). Durch die Analyse der geometrischen Morphometrie unter Verwendung der Krümmungsmaße beobachteten Prado et al. (2004), dass die Krümmung und die normierte Länge von Bogen III wichtige Maße bei der Unterscheidung zwischen den Arten D. gouveai und D. antonietae sind. Unsere Daten zeigen, dass MKE IV das wichtigste Maß bei der Unterscheidung der Arten D. serido und D. antonietae ist; und allein basierend auf diesem Maß ist es möglich, mehr als 94 % der Individuen von D. serido aus der Population von Milagres/BA (Typlokalisation) von denen von D. antonietae zu unterscheiden (Tabelle VI). Diese Ergebnisse zeigen, dass der distale Teil des Aedeagus (Bogen III + Bogen IV) die höchsten interspezifischen Unterschiede aufweist, unabhängig von anderen Teilen dieses Organs, was darauf hindeutet, dass diese Region als „heißer evolutionärer Punkt“ (Kullikov et al. 2004) für den Aedeagus während der Ereignisse der Kladegenese im Drosophila buzzatii-Cluster betrachtet werden kann, aber diese Frage bleibt weiterhin zur Diskussion offen.
Die morphometrischen Variationen zwischen und innerhalb der Gruppen von Organismen spiegeln den Ausdruck eines Phänotyps wider, der aus einer integrierten polygenen Kontrolle resultiert, die während der Kladegenese und der Evolution von Gruppen verändert wird (Falconer 1989). Darüber hinaus können mehrere epigenetische und umweltbedingte Faktoren die Bildung einer Struktur beeinflussen (Atchley et al. 1992), was es schwierig macht, die Ursachen der morphologischen Divergenz zwischen Populationen und Arten zu identifizieren. Dennoch sind vergleichende morphometrische Studien der homologen Regionen beider Arten, wie die Bögen des Aedeagus, wichtige Voraussetzungen für das Verständnis der genetischen Basis, die die Bildung dieser Region steuert. Obwohl die genetische Basis des Aedeagus für andere Gruppen von Drosophila entdeckt wird (Liu et al. 1996), sind die Gene, die die Bildung des Aedeagus in den Arten des Drosophila buzzatii-Clusters steuern, noch nicht etabliert. Der hohe Prozentsatz an Korrektheit der in diesem Artikel analysierten Individuen, der ausschließlich auf dem MKE IV basiert, deutet darauf hin, dass die Region des Bogen vier nützlich für zukünftige Studien zum Verständnis der genetischen Basis des Aedeagus in diesen Arten sein könnte, da die Etablierung informativer morphologischer Merkmale zwischen verschiedenen taxonomischen Gruppen ein erster Schritt in der Studie von QTL (Quantitative Trait Loci) ist, einer Methodologie zur Erkennung, Kartierung und Schätzung der Effekte einiger Loci in den metrischen Eigenschaften.
Autoren: Fernando F. Franco, Pedro R.R. Prado, Fábio M. Sene, Luciano F. Costa und Maura H. Manfrin
Referenzen
- Atchley WR, Cowley DE, Vogi C und Mc-Lellan T. 1992. Evolutionäre Divergenz, Formveränderung und genetische Korrelationsstruktur im Kiefer von Nagetieren. Syst Biol 41: 196–221.
- Baimai V, Sene FM und Pereira MAQR. 1983. Heterochromatin und karyotypische Differenzierung einiger neotropischer Kaktusbrutarten der Drosophila repleta-Gruppe. Genetica 67: 81–92.
- Costa LF und Cesar RMJ. 2000. Formanalyse und Klassifikation: Theorie und Praxis. CRC Press Buchreihe zur Bildverarbeitung. Cambridge Univ Press, New York, 659 S.
- Costa LF, dos Reis SF, Arantes RAT, Alves ACR und Multinari G. 2004. Biologische Formanalyse durch digitale Krümmung. Pattern Recognit 37: 515–524.
- Duda RO, Hart PE und Stork DG. 2000. Musterklassifikation. J Wiley & Sons, New York, USA, 680 S.
- Falconer DS. 1989. Einführung in die quantitative Genetik. 2. Aufl., London: Longman.
- Kaneshiro KY. 1969. Eine Studie über die Beziehungen von hawaiianischen Drosophila-Arten basierend auf externen männlichen Geschlechtsorganen. Univ Texas Publ 6918: 55–70.
- Kuhn GCS und Sene FM. 2005. Evolutionärer Wandel von zwei pBuM-Satelliten-DNA-Unterfamilien im Drosophila buzzatii-Artencluster (repleta-Gruppe): von alpha zu alpha/beta-Anordnungen. Gene 349: 77–85.
- Kullikov AM, Melnikov AI, Gornostaev NG, Lazebny OE und Mitrofanov VG. 2004. Morphologische Analyse des männlichen Fortpflanzungsorgans in der Drosophila virilis-Artengruppe: ein multivariater Ansatz. J Zool. Syst Evol Res 42: 135–144.
- Liu J, Mercer JM, Stam LF, Gibson GC, Zeng Zhao-Bang und Laurie CC. 1996. Genetische Analyse eines morphologischen Formunterschieds in den männlichen Geschlechtsorganen von Drosophila simulans und D. mauritiana. Genetics 142: 1129–1145.
- Manfrin MH, Brito ROA und Sene FM. 2001. Systematik und Evolution des Drosophila buzzatii (Diptera; Drosophilidae) Clusters unter Verwendung von mtDNA. Ann Entomol Soc Am 94: 333–346.
- Mateus RP und Sene FM. 2003. Temporale und räumliche Allozyme-Variation in der südamerikanischen kaktusliebenden Drosophila antonietae (Diptera; Drosophilidae). Biochem Genet 41: 219–233.
- Monteiro SG und Sene FM. 1995. Morphometrische Studie von Populationen von Drosophila serido aus den zentralen und südlichen Regionen Brasiliens. Rev Bras Genet 18 (Suppl.): 283.
- Moraes EM, Spressola VL, Prado PRR, Costa LF und Sene FM. 2004. Divergenz in der Flügelmorphologie unter Geschwisterarten des buzzatii-Clusters. J Zool Syst Evol Res 42: 154–158.
- Moreteau B, Gibert P, Pétavy G, Moereteau JC, Huey RB und David JR. 2003. Morphometrische Evolution in einem Drosophila-Clade: die Drosophila obscure-Gruppe. J Zool Syst Evol Res 41: 64–71.
- Pereira MAQR, Vilela CR und Sene FM. 1983. Notizen über Brut- und Futterplätze einiger Arten der repleta-Gruppe der Gattung Drosophila (Diptera; Drosophilidae). Cienc Cult 35: 1313–1319.
- Prado PRP, Franco FF, Manfrin MH, Costa LF und Sene FM. 2004. Ein einfacher und schneller Weg zur Analyse morphometrischer Merkmale. Proc Third Braz Symp Mathem Comp Biol 1: 329–340.
- Ruiz A, Cassian AM, Kuhn GCS, Alves Maqr und Sene FM. 2000. Das Drosophila serido-Spezierungspuzzle: neue Teile zusammenfügen. Genetica 108: 217–227.
- Silva AFG und Sene FM. 1991. Morphologische geografische Variabilität in Drosophila serido (Diptera; Drosophilidae). Rev Bras Entomol 35: 455–468.
- Tidon-Sklorz R und Sene FM. 1995. Evolution des buzzatii-Clusters (Drosophila repleta-Artengruppe) in Mittel-Südamerika. Evolución Biologica 9: 71–85.
- Tidon-Sklorz R und Sene FM. 2001. Zwei neue Arten des Drosophila serido-Geschwistersets (Diptera; Drosophilidae). Iheringia 90: 141–146.
- Tosi D und Sene FM. 1989. Weitere Studien zur chromosomalen Variabilität im komplexen Taxon Drosophila serido (Diptera; Drosophilidae). Rev Bras Genet 12: 729–745.
- Vilela CR. 1983. Eine Revision der Drosophila repleta-Artengruppe (Diptera; Drosophilidae). Rev Bras Entomol 27: 1–114.
- Vilela CR und Sene FM. 1977. Zwei neue neotropische Arten der repleta-Gruppe der Gattung Drosophila (Diptera; Drosophilidae). Papéis Avulsos de Zoologia 30: 295–299.

