Um Estudo Controlado Randomizado de Regeneração Óssea Guiada para Defeitos de Deiscência Peri-Implantar com Dois Materiais de Osso Bovino Anorgânico Cobertos por Malhas de Titânio
Tradução automática
O artigo original está escrito em EN language (link para lê-lo) .
Resumo
O objetivo deste estudo é comparar dois materiais de osso bovino anorgânico sinterizados a baixa temperatura (ABBMs), Bio-Oss (Geistlich, Wolhusen, Suíça) e A-Oss (Osstem, Seul, Coreia), para GBR em defeitos de deiscência. Um único implante foi colocado simultaneamente com GBR no defeito ósseo bucal ou buco-proximal por meio de uma dupla camada de aloinjerto interno e ABBM externo, coberto por uma malha de titânio ultrafina pré-formada e uma membrana de colágeno absorvível. As mudanças no volume do enxerto foram avaliadas por tomografia computadorizada de feixe cônico, realizadas pré-operatoriamente (T0), imediatamente após a cirurgia do implante (T1), após a cirurgia de reentrada (T2) e após a entrega da restauração final (T3). A densidade do osso regenerado foi avaliada medindo a profundidade de sondagem no centro bucal da malha após a remoção da malha em T2. As sequelas pós-operatórias também foram registradas. A retração do volume do enxerto de 46,0% (0,78 ± 0,37 cc) e 40,8% (0,79 ± 0,33 cc) no grupo Bio-Oss (8 pacientes) e no grupo A-Oss (8 pacientes), respectivamente, foi observada em T3 (p < 0,001). Não houve diferenças significativas nas mudanças de volume do enxerto de acordo com os períodos de tempo ou densidade óssea entre os dois grupos. Apesar da exposição da malha pós-operatória (3 pacientes), a remoção prematura dessas malhas expostas e enxertos adicionais não foram necessários, e todos os implantes foram funcionais durante o período de acompanhamento de 1 ano. Ambos os ABBMs com malhas de titânio não mostraram diferença significativa na quantidade e densidade do osso regenerado após GBR para defeitos peri-implantares.
Introdução
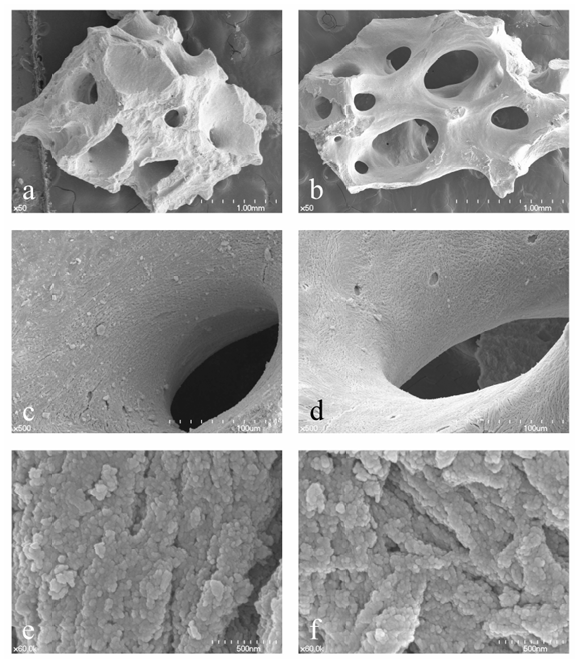
Dispositivos e tecnologias inovadoras para reduzir a morbidade, os tempos biológicos e cirúrgicos são um tópico de intensa pesquisa na odontologia de implantes, e a regeneração óssea guiada (GBR) é um procedimento cirúrgico de aumento ósseo para implantes dentários, utilizando vários materiais de enxerto ósseo com membranas de barreira simultâneas. Materiais de osso bovino anorgânico (ABBMs) têm sido amplamente utilizados como material osteocondutivo para cirurgias de elevação de seio, preservação de rebordo, cirurgia de implante imediatamente após a extração dentária e GBR. A vantagem única do ABBM é sua própria propriedade de manutenção de volume com lenta substituição pelo novo osso em comparação com materiais de enxerto ósseo autógeno e alogênico. Existem muitos outros tipos de ABBMs que são sinterizados a alta temperatura ou são baseados em suínos e equinos; no entanto, os ABBMs à base de bovinos e sinterizados a baixa temperatura parecem dominar o mercado dental. Historicamente, o Bio-Oss (Geistlich, Wolhusen, Suíça) tem sido considerado o padrão ouro devido a fortes evidências científicas; no entanto, o A-Oss (Osstem, Seul, Coreia) é um ABBM produzido por tratamento químico com solvente aromático e forte álcali e, finalmente, por um processo de recozimento a baixa temperatura abaixo de 400°C com uma taxa de aquecimento extremamente baixa (<0,3°C por minuto). A caracterização físico-química do A-Oss, que poderia ser substancialmente equivalente à do Bio-Oss em vista de maior porosidade e menor cristalinidade, está intimamente associada a menos degradação e atividade de remodelação em comparação com outros xenógenos (Figura 1).
No campo da cirurgia oral e maxilofacial, a malha de titânio tem sido amplamente adotada para casos que requerem uma grande quantidade de reconstrução óssea devido à sua biocompatibilidade inerente e rigidez como um metal leve. Particularmente, a recente introdução de uma malha de titânio ultrafina pré-formada, que é diretamente conectada e fixada ao implante, aumentou sua popularidade em GBR para defeitos ósseos peri-implantares. Resistente ao colapso durante todo o período de cicatrização do GBR, essa malha de titânio ultrafina possui múltiplos poros de tamanhos variados para resultados ótimos de GBR.
O objetivo deste ensaio clínico controlado randomizado foi comparar dois ABBMs sinterizados a baixa temperatura, Bio-Oss e A-Oss, que são utilizados em GBR para a reconstrução de defeitos de deiscência peri-implante, em combinação com a malha de titânio ultrafina. Até onde sabemos, este é o primeiro estudo a medir e comparar as mudanças volumétricas tridimensionais dos ABBMs para fins de GBR. A hipótese nula era que não havia diferença nas mudanças no volume enxertado (quantidade de osso), densidade (qualidade do osso) do osso regenerado e sequelas pós-operatórias entre os grupos.
Materiais e Métodos
Este estudo foi projetado como um ensaio clínico controlado randomizado de desenho de grupo paralelo e foi conduzido na Divisão de Cirurgia Oral e Maxilofacial, Departamento de Odontologia, Hospital da Universidade Hanyang, entre junho de 2018 e julho de 2019. O estudo foi aprovado pelo Comitê de Ética em Pesquisa do Hospital da Universidade Hanyang (IRB No. 2018-03-006) e registrado na plataforma de registro internacional de ensaios clínicos da OMS (KCT0004906). Foi conduzido de acordo com as Declarações de Helsinque e diretrizes internacionalmente aceitas para ECRs, incluindo a declaração CONSORT (acessada em 2 de março de 2018). Todos os procedimentos cirúrgicos e protéticos foram realizados por um especialista em implantes (C.-J.P.).
Seleção de Pacientes
Após exames clínicos e radiológicos pré-operatórios, incluindo tomografia computadorizada de feixe cônico (CBCT), qualquer paciente saudável com 18 anos ou mais, que necessitasse de colocação de um único implante na crista alveolar cicatrizada com GBR para o defeito de deiscência peri-implantar quando o implante foi simulado em uma posição guiada prosteticamente (OneGuide, Osstem, Seul, Coreia), foi incluído neste estudo após fornecer consentimento informado. Particularmente, os defeitos ósseos deveriam ser limitados apenas ao aspecto bucal e/ou proximal e não envolver a superfície do dente adjacente ou o aspecto lingual. Os critérios de exclusão incluíam a necessidade de mais de dois implantes consecutivos e a presença de contraindicações sistêmicas ou locais para a colocação de implantes, incluindo histórico de distúrbios metabólicos não controlados, tabagismo, bruxismo ou doença periodontal não controlada. Os pacientes inscritos foram informados sobre os procedimentos cirúrgicos, materiais a serem utilizados, benefícios e os potenciais riscos e complicações deste estudo clínico, e o consentimento informado por escrito foi obtido.
Procedimento Cirúrgico
Todos os procedimentos foram realizados sob anestesia local e sedação intravenosa moderada. Um retalho de espessura total foi levantado, e todo o tecido de granulação foi completamente removido. A perfuração inicial com marcação do osso cortical foi realizada por uma broca guia. Brocas cônicas sequenciais foram utilizadas para preparar o local do implante (kit OneGuide ou kit 122 Taper, Osstem), e uma ênfase especial foi dada à obtenção de uma posição tridimensional correta do implante. Um implante dentário (TS III SOI, Osstem, ou T01 SA, Toplan, Seul, Coreia) foi instalado 1 mm subcrestalmente em relação ao bordo alveolar lingual ou palatino, e um defeito de deiscência ocorreu ao redor do topo do implante, expondo as roscas bucais e/ou proximais do implante.
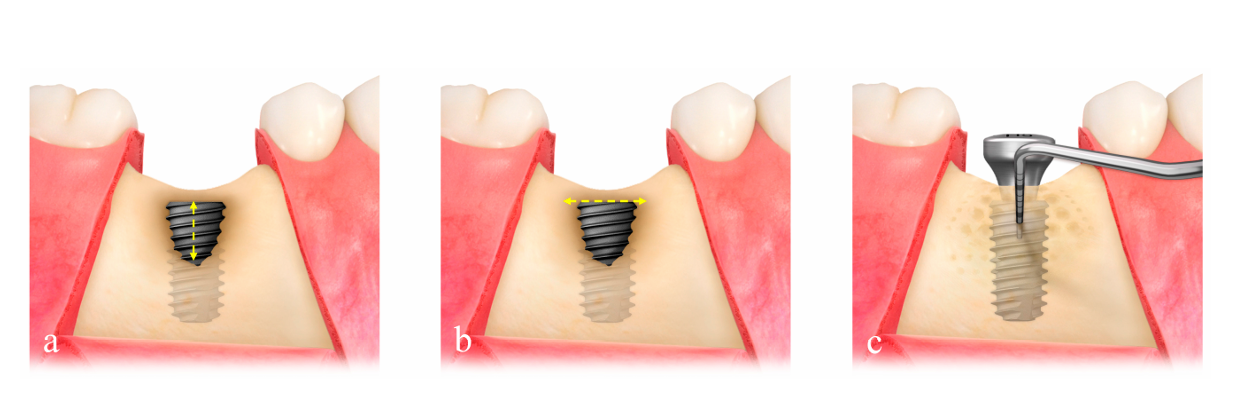
O tamanho do defeito (mm) consistiu na altura do defeito, que foi medida do topo do implante até o primeiro contato osso-implante, e a largura do defeito, que foi medida do bordo ósseo mesial ao distal no nível do topo do implante (Figura 2a,b). A malha de titânio ultrafina pré-formada (OssBuilder, Osstem), que era a mais apropriada para o tamanho do defeito medido, foi selecionada entre várias opções do tipo I para defeito de deiscência bucal e tipo II para defeito de deiscência buco-proximal combinado (Figura 3). Pequenos cortes e contornos da malha de titânio foram realizados para melhor contenção do material de enxerto, se necessário. Múltplas aberturas de medula óssea foram realizadas para induzir as células osteogênicas para uma regeneração óssea mais rápida e melhor.
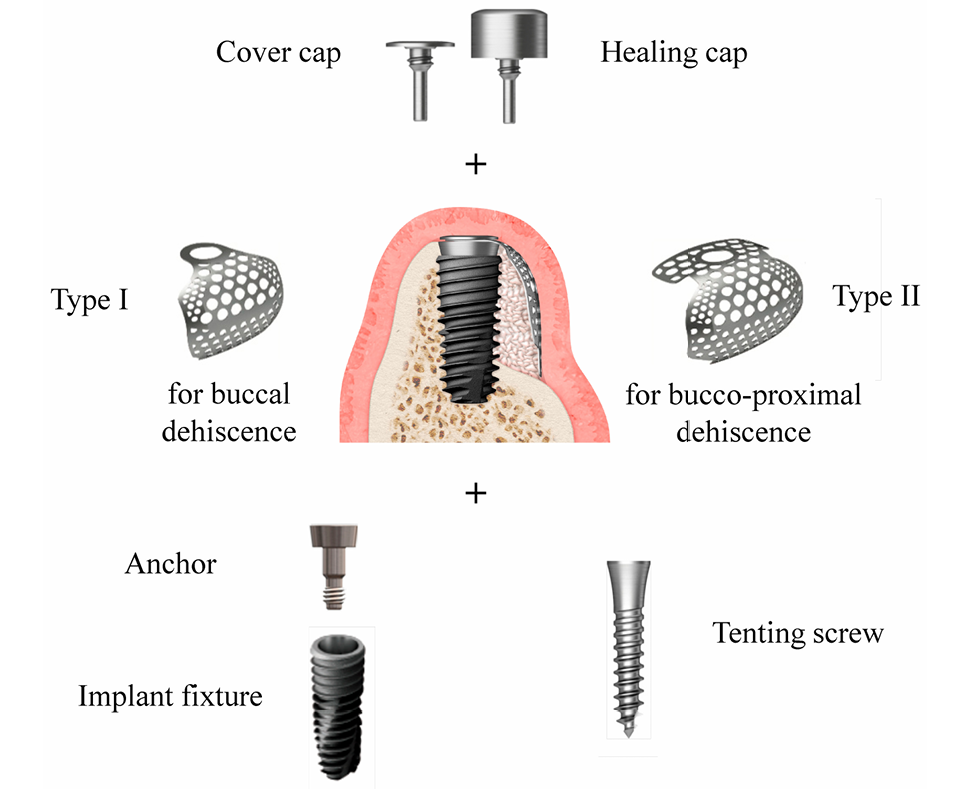
De acordo com o envelope de randomização, os pacientes foram designados a dois grupos: grupo Bio-Oss e grupo A-Oss. As roscas do implante expostas foram cobertas por um aloenxerto ósseo liofilizado (FDBA; SureOss, HansBiomed, Seul, Coreia) e sobrepostas por um ABBM, Bio-Oss ou A-Oss, em uma proporção de volume de 1:1 para manutenção do contorno. A parte de ancoragem, que conecta o implante e a malha de titânio ultrafina pré-formada, foi apertada manualmente no implante, e a malha de titânio ultrafina selecionada foi aplicada sobre essa âncora para conter todo o material de enxerto (Figura 3). Se o implante foi inserido com um torque de assentamento
≤30 Ncm ou um valor de quociente de estabilidade do implante ≤70, a tampa de cobertura foi conectada à malha de titânio de acordo com uma abordagem submersa. Caso contrário, a tampa de cicatrização foi imediatamente conectada de acordo com uma abordagem não submersa. Uma membrana de colágeno absorvível (OssGuide, SK Bioland, Cheonan, Coreia) ou OssMem hard (Osstem) foi adaptada sobre a malha de titânio para minimizar o risco de afinamento da gengiva sobrejacente, resultando na exposição precoce da malha de titânio. O periosteu do retalho de espessura total foi liberado para um fechamento primário da ferida sem tensão. Os pacientes receberam analgésicos e antibióticos por 10 dias para controlar a dor pós-cirúrgica e a infecção. Enxaguantes bucais de clorexidina também foram prescritos duas vezes ao dia. Os pontos foram removidos 10 dias após a cirurgia.
Após 8 meses de pós-operatório, uma cirurgia de reentrada foi realizada usando um design de retalho semelhante sob anestesia local. Após a remoção da malha de titânio, a densidade óssea foi avaliada pela profundidade de sondagem, que foi medida no osso regenerado sob o centro médio da malha de titânio, usando força controlada, 0,25 N (Figura 2c). A tampa de cobertura ou a tampa de cicatrização foi substituída por um pilar de cicatrização, e os retalhos foram ajustados e suturados. Os pontos foram removidos 10 dias após a cirurgia. Após a cirurgia de reentrada, o tecido mole ao redor do pilar de cicatrização foi permitido cicatrizar antes da tomada de impressão. Uma única restauração temporária foi incorporada com o pilar personalizado de titânio para carga progressiva, e a restauração final foi entregue 12 meses após o pós-operatório. Quaisquer sequelas pós-operatórias em procedimentos GBR foram registradas de acordo com a classificação anterior das complicações do GBR e tratadas pelo mesmo cirurgião (C.-J.P.).
Avaliação do Volume Enxertado
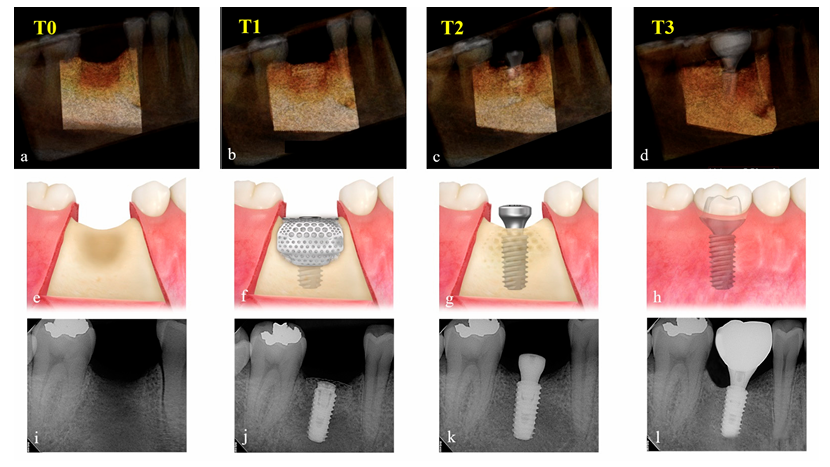
As mudanças no volume aumentado do material de enxerto foram avaliadas comparando os dados de CBCT obtidos pré-operatoriamente (T0), imediatamente após a cirurgia de implante e GBR (T1), após a cirurgia de reentrada (T2) e após a entrega da restauração final (T3). Os parâmetros de exposição para a varredura de CBCT (campo de visão 35 × 50 mm; tamanho do voxel 0,2 mm; tempo 10,8 s; kV 75; mA 10; produto da dose área 240 mGy·cm2) foram definidos o mais baixo possível (ALARA). Usando o software Aquarium iNtuition (TeraRecon, Durham, NC, EUA), o local do implante foi reconstruído em uma imagem tridimensional e segmentado como uma região de interesse (ROI) usando estruturas anatômicas próximas, como dentes adjacentes, piso do seio e canal alveolar inferior. Compartimentos, que são radiologicamente uniformes em densidade e tamanho, como corpo do implante e pilar de cicatrização, foram subtraídos, e o volume (cc) na ROI foi calculado de acordo com os períodos de tempo (Figura 4) por um examinador independente e cego (K.-G.H.). Como este software é amplamente utilizado na área médica para detectar precisamente a porção ocluída de vasos principais e medir com precisão o volume do órgão para transplante, ele foi aplicado para este estudo para medir o volume da ROI para complementar a tecnologia de TC.
Análise Estatística
O tamanho da amostra foi determinado para satisfazer 90% de poder do teste, no mínimo, a α = 0,05, de acordo com a suposição de variância igual com base nas médias dentro do sujeito e entre os sujeitos do estudo controlado randomizado anterior comparando Bio-Oss e o ABBM revestido de fosfato de cálcio na augmentação de seio. Com base nesses resultados, o tamanho mínimo da amostra foi estimado em 9 sujeitos em cada grupo, considerando uma possível taxa de desistência de 10% durante o período do estudo.
O modelo de efeitos mistos foi utilizado para examinar as diferenças nas mudanças de volume do enxerto entre os grupos Bio-Oss e A-Oss, com ajuste para covariáveis, onde as mudanças de volume do enxerto foram medidas em três períodos de tempo consecutivos, bem como na linha de base (T0). A significância dos efeitos das covariáveis e as mudanças de volume do enxerto previstas
foram testadas a α = 0,05. Além disso, estatísticas descritivas sobre as informações gerais dos pacientes na linha de base foram resumidas com o número de casos e porcentagem para variáveis categóricas e com a média ± desvio padrão para variáveis contínuas.
Todas as análises estatísticas foram realizadas usando o SAS, versão 9.4 (SAS Inc., Cary, NC, EUA). A significância estatística foi definida como p < 0,05.
Resultados
No total, 18 pacientes foram inscritos consecutivamente, e dois pacientes desistiram (um em cada grupo) devido à perda de acompanhamento. Finalmente, dados de 16 pacientes (7 homens e 9 mulheres) com uma idade média de 54,3 ± 11,7 anos (variando de 28 a 72 anos) foram coletados e avaliados neste ensaio (Tabela 1). A comparação demográfica entre os dois grupos é mostrada na Tabela 2. Houve uma diferença significativa entre os grupos Bio-Oss e A-Oss apenas em termos de comprimento do implante (p < 0,01).
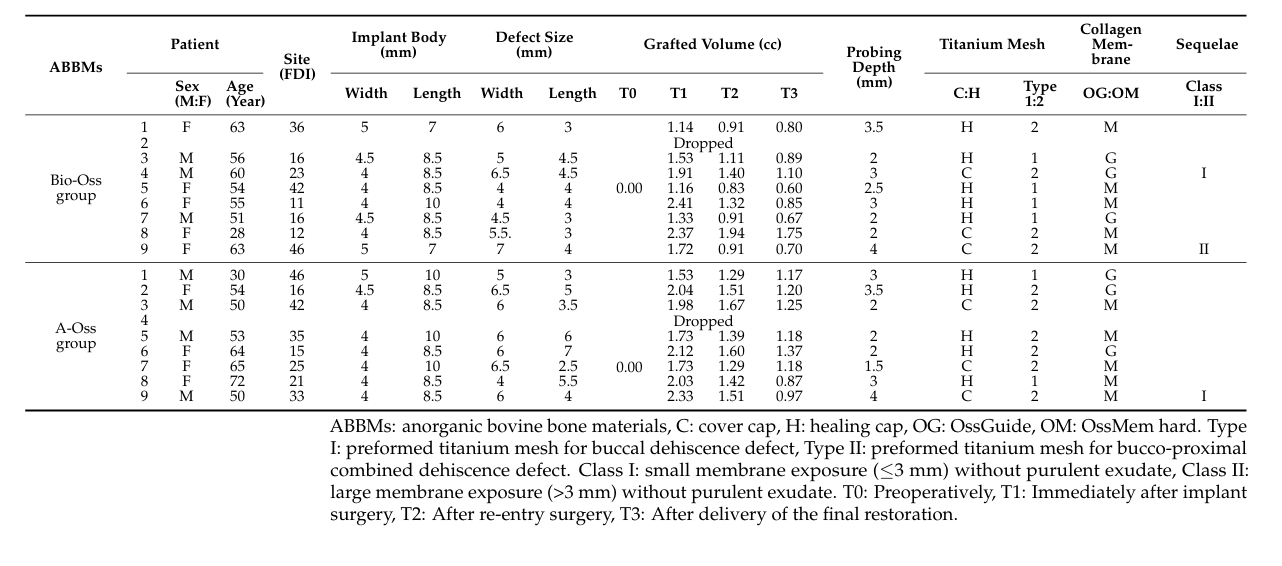
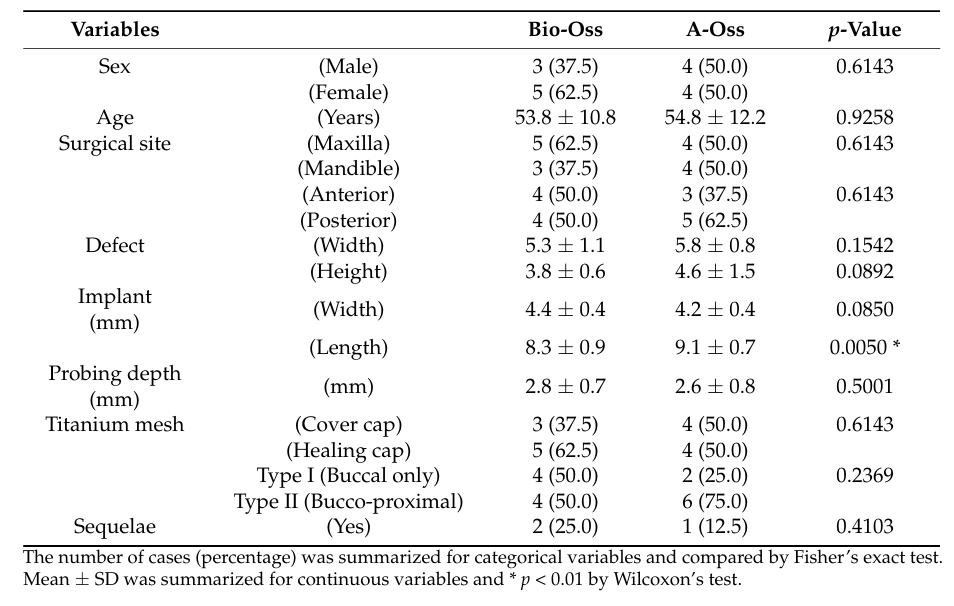
Em ambos os grupos, o volume enxertado, que atingiu o pico de 1,70 ± 0,50 cc no grupo Bio-Oss e 1,94 ± 0,26 cc no grupo A-Oss no T1, continuou a diminuir até o T3. Os volumes enxertados reduziram para 1,17 ± 0,38 cc no grupo Bio-Oss e 1,46 ± 0,14 cc no grupo A-Oss no T2 e 0,92 ± 0,37 cc no grupo Bio-Oss e 1,15 ± 0,16 cc no grupo A-Oss no T3; houve uma diferença significativa nos volumes enxertados entre os períodos de tempo (p < 0,001, Tabela 3). No entanto, não houve diferença significativa entre os dois grupos em todos os períodos de tempo (p > 0,05, Figura 5). Além disso, não houve diferença significativa nas densidades do osso regenerado no T3 entre os grupos (p > 0,05).

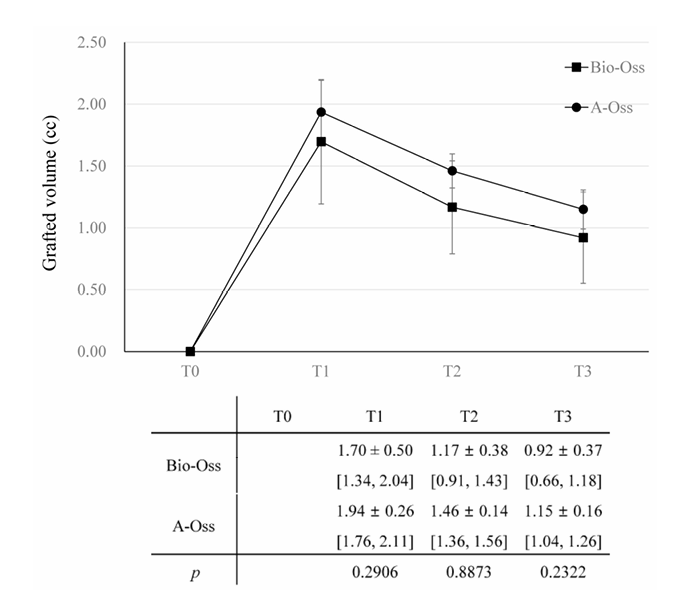
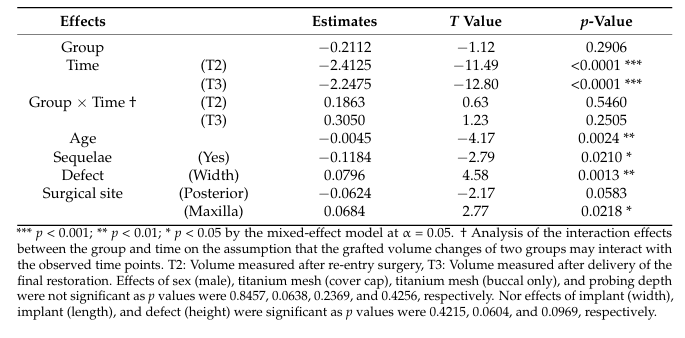
Na análise do modelo de efeitos mistos, T2 e T3 como períodos de tempo (p < 0.001), idade mais avançada (p < 0.01) e a existência de sequelas (p < 0.05) indicaram diminuições significativas no volume enxertado; por outro lado, defeito mais amplo (p < 0.01) e maxila como o local cirúrgico (p < 0.05) resultaram em menores diminuições no volume enxertado (Tabela 4). Sequelas pós-operatórias foram observadas em três pacientes, com dois pacientes (Classe I e II em locais de sutura crestal) no grupo Bio-Oss e um (Classe I na borda buco-mesial da malha) no grupo A-Oss. Todas as sequelas pós-operatórias ocorreram em casos submersos com capas de cobertura, e não houve diferença significativa entre os dois grupos. Os pacientes foram instruídos a escovar a malha com cuidado e suavemente com uma escova de dentes macia embebida em gel de clorexidina a 1% duas vezes ao dia. Apesar da ausência de reepitelização cobrindo a área exposta da malha, a remoção prematura dessas malhas expostas não foi necessária, e a reexposição das roscas do implante e perda severa do material de enxerto com supuração não foram observadas durante todo o período de cicatrização; nenhum enxerto adicional foi necessário em T2.
Discussão
Este ensaio clínico controlado randomizado foi projetado para avaliar o potencial do A-Oss em manter a quantidade e qualidade óssea do osso regenerado por GBR como um ABBM sinterizado a baixa temperatura em comparação ao Bio-Oss, e a hipótese nula de que não há diferença foi aceita. Apesar do uso de ABBMs estáveis em volume, um total de 46,0% (0,78 ± 0,37 cc) e 40,8% (0,79 ± 0,33 cc) dos volumes enxertados foram perdidos durante o processo de substituição por novo osso nos grupos Bio-Oss e A-Oss, respectivamente. Uma possível explicação para a maior reabsorção além do esperado é que o volume enxertado medido em T1 foi claramente delineado por uma fina malha de titânio radiopaca nas tomografias CBCT, enquanto a periferia radiológica indistinta entre os materiais de enxerto e o tecido mole resultou em uma subestimação do volume enxertado após a remoção da malha de titânio em T2 e T3. Comparado a 17,3~23,9% de perda de volume enxertado até 6 meses pós-operatórios após a cirurgia de elevação do seio, a contração do volume enxertado após GBR foi considerada maior porque a pressão geral do tecido mole sobrejacente pode ser maior do que a pressão pneumática intra-sinus. Apenas medições lineares foram realizadas para avaliar a espessura da região aumentada por GBR em tomografias CBCT limitadas, e nossos resultados não são surpreendentes, considerando que a redução linear variou de 20,2% a 42,8% na shoulder do implante após o enxerto de Bio-Oss. No entanto, devemos admitir que havia um risco constante de erros de medição resultantes de artefatos metálicos, pois vários componentes metálicos, como um corpo de implante e uma malha de titânio, existiam simultaneamente na CBCT.
Focando na mudança de volume do enxerto, os efeitos da existência de sequelas e do local cirúrgico mostraram diferenças estatisticamente significativas (p < 0,05). Em outras palavras, se o GBR teve complicações pós-operatórias ou o local cirúrgico era posterior (vs. anterior, p = 0,0583) e não a maxila (vs. mandíbula), era mais provável que ocorresse mais reabsorção do volume enxertado. A área posterior mandibular é geralmente composta por osso duro com um córtex mais espesso, e o resultado da augmentação óssea é menos previsível mesmo quando combinado com aberturas extensas na medula óssea. Além disso, os efeitos da idade e da largura do defeito também mostraram diferenças significativas (p < 0,01), o que significa que pacientes mais velhos e defeitos de deiscência mais estreitos tendem a mostrar mais reabsorção do volume enxertado. Pacientes mais velhos tendem a apresentar um risco maior de falha do implante com menores potenciais de regeneração óssea após o GBR, e houve menos reabsorção no local do GBR à medida que mais materiais de enxerto ósseo eram compactados em defeitos mais amplos e protegidos de forma segura por uma malha de titânio, maximizando a propriedade de estabilidade de volume dos ABBMs. A malha de titânio ultrafina pré-formada era adequada para o contorno ósseo ideal, particularmente ao nível do topo do implante, prevenindo o colapso do enxerto. Supondo que o defeito peri-implante esteja localizado dentro da cavidade óssea original, defeitos do tipo fenestração mostraram mais preenchimento ósseo e menos complicações do que defeitos do tipo deiscência. Assim, não conseguimos encontrar a influência significativa da altura do defeito na mudança de volume enxertado.
Em contraste com o ABBM para preservação de volume, os materiais de enxerto ósseo alogênico mostraram formação óssea robusta com ilhas de novo osso que podem ser interpretadas como evidência de indução óssea e pareciam estar em um estado mais ativo de turnover e substituição. Uma técnica de camadas usando diferentes materiais de enxerto é comumente aplicada para aumentar o osso alveolar deiscente ou deficiente ao redor de implantes dentários. Geralmente, o osso autógeno foi usado como uma camada interna em contato próximo com o implante; no entanto, o osso alogênico também foi utilizado quando o volume de colheita de osso autógeno não era adequado. Neste estudo, uma camada externa de ABBM foi colocada sobre o alograft para preservar e manter o osso aumentado, e uma terceira camada de membrana de colágeno absorvível foi colocada para evitar a invasão de tecido mole e células não osteogênicas no local do enxerto. Em vista da necessidade de uma membrana de barreira, uma malha de titânio foi usada pela sua capacidade de criar espaço e estabilizar coágulos sanguíneos, e a membrana de colágeno absorvível sobrejacente foi usada para a oclusão celular para prevenir o afinamento prematuro da gengiva sobrejacente, separando completamente os compartimentos para regeneração óssea e epitelial. Como uma membrana de barreira não absorvível, a remoção da malha de titânio é inevitável; no entanto, a cirurgia de reentrada para removê-la é uma oportunidade perfeita para avaliar a quantidade e qualidade do osso regenerado para determinar o sucesso do GBR. Comumente, enquanto a quantidade de osso pode ser avaliada radiologicamente por reconstrução tridimensional de exames de CBCT no local do GBR, a qualidade do osso foi avaliada histologicamente ou histomorfometricamente obtendo e analisando a biópsia do núcleo ósseo da crista regenerada. No entanto, em nosso estudo, a qualidade do osso foi avaliada de forma grosseira avaliando a corticalização do local do GBR usando a profundidade de sondagem durante a reentrada, pois era tecnicamente difícil ou frequentemente impossível obter a amostra de osso do local peri-implante reconstruído. Após a remoção da malha de titânio, uma inspeção mais próxima do local cicatrizado revelou tecido duro regenerado superficialmente coberto por uma fina camada de tecido mole que tinha 1–2 mm de espessura. Esta camada foi descrita como “pseudo-periósteo” e a significância clínica desta camada de tecido conectivo e de granulação histologicamente é desconhecida; no entanto, esta fina camada parece estável em dimensão, e sua remoção não foi indicada durante a reentrada. Em nosso estudo, profundidades de sondagem de 2.8 ± 0.7 mm e 2.6 ± 0.8 mm nos grupos Bio-Oss e A-Oss, respectivamente, poderiam ser a espessura de osso imaturo, incluindo o “pseudo-periósteo”, durante o processo de corticalização sob a malha de titânio. Esta abordagem para avaliar a qualidade do osso regenerado é considerada a principal limitação do nosso estudo e mais investigações histológicas e histomorfométricas serão necessárias para analisar o osso regenerado em detalhe.
Embora não tenha ocorrido re-epitelização em exposições pequenas (2 pacientes) e grandes (1 paciente) de malha de titânio sem exsudato purulento durante o período de cicatrização, não foi observada a fuga de material de enxerto, e não houve remoção prematura da malha de titânio exposta nem indicação de enxerto suplementar. No entanto, a profundidade da sondagem aumentou até 3~4 mm devido à presença compensatória de um “pseudo-periósteo” mais espesso, que estava envolvido em manter o material de enxerto contido de forma segura nos casos de malha de titânio exposta. Um estudo anterior também confirmou que a exposição à malha de titânio não teve influência negativa no resultado clínico do procedimento de aumento e no sucesso do procedimento de enxerto ósseo. Especialmente, todas as sequelas pós-operatórias ocorreram em casos onde a malha de titânio foi fixada e estabilizada com capas de cobertura, embora não tenha sido estatisticamente significativo. Como as capas de cobertura estavam conectadas ao implante com baixa estabilidade primária em nosso estudo, mais tensão resultante de menos tecido mole redundante pode ser atribuída a uma maior incidência de deiscência de ferida pós-operatória na abordagem submersa em comparação com a abordagem não submersa. Não houve diferença significativa nas sequelas pós-operatórias entre os grupos Bio-Oss e A-Oss.
Conclusões
Dentro das limitações deste estudo, pode-se concluir que
- Um defeito de deiscência peri-implantar foi reconstruído com sucesso por GBR com camadas duplas de alógeno e ABBM, que foram cobertos por uma malha de titânio ultrafina pré-formada e uma membrana de colágeno absorvível;
- Apesar do efeito de manutenção de volume das ABBMs, aproximadamente 27,8% de reabsorção do volume do enxerto foi observada em T2, e não houve diferença significativa entre os grupos Bio-Oss e A-Oss, mesmo na qualidade do osso regenerado;
- A perda de volume do enxerto (aproximadamente 43,2%) continuou até T3 e não diferiu entre os grupos Bio-Oss e A-Oss.
JaeHyung Lim, SangHo Jun, Marco Tallarico, Jun-Beom Park, Dae-Ho Park, Kyung-Gyun Hwang e Chang-Joo Park
Referências
- Pjetursson, B.E.; Thoma, D.; Jung, R.; Zwahlen, M.; Zembic, A. Uma revisão sistemática das taxas de sobrevivência e complicações de próteses dentárias fixas suportadas por implantes (FDPs) após um período médio de observação de pelo menos 5 anos. Clin. Oral Implant. Res. 2012, 23, 22–38. [CrossRef] [PubMed]
- Urban, I.; Caplanis, N.; Lozada, J.L. Regeneração óssea guiada vertical simultânea e regeneração tecidual guiada na maxila posterior usando fator de crescimento derivado de plaquetas humanas recombinante: Um relato de caso. J. Oral Implantol. 2009, 35, 251–256. [CrossRef]
- Adeyemo, W.; Reuther, T.; Bloch, W.; Korkmaz, Y.; Fischer, J.H.; Zöller, J.E.; Kuebler, A.C. Cicatrização de enxertos ósseos mandibulares onlay cobertos com membrana de colágeno ou substitutos ósseos bovinos: Um estudo microscópico e imuno-histoquímico em ovelhas. Int. J. Oral Maxillofac. Surg. 2008, 37, 651–659. [CrossRef] [PubMed]
- Block, M.S.; Kaleem, A. Uso de xenógeno sinterizado sobre alógeno para aumento de crista: Nota técnica. J. Oral Maxillofac. Surg. 2014, 72, 496–502. [CrossRef] [PubMed]
- Buser, D.; Chappuis, V.; Kuchler, U.; Bornstein, M.; Wittneben, J.; Buser, R.; Cavusoglu, Y.; Belser, U.C. Estabilidade a longo prazo da colocação precoce de implantes com aumento de contorno. J. Dent. Res. 2013, 92, 176S–182S. [CrossRef] [PubMed]
- Jensen, S.S.; Bosshardt, D.D.; Gruber, R.; Buser, D. Estabilidade a longo prazo do aumento de contorno na zona estética: Avaliação histológica e histomorfométrica de 12 biópsias humanas 14 a 80 meses após o aumento. J. Periodontol. 2014, 85, 1549–1556. [CrossRef] [PubMed]
- Cho, Y.S.; Hwang, K.G.; Jun, S.H.; Tallarico, M.; Kwon, A.M.; Park, C.J. Análise comparativa radiológica entre preenchimento com solução salina e fibrina rica em plaquetas após elevação hidráulica do seio sem enxerto ósseo adjunto: Um ensaio clínico randomizado controlado. Clin. Oral Implant. Res. 2020, 31, 1087–1093. [CrossRef]
- Nevins, M.; Nevins, M.L.; Kim, S.-W.; Schupbach, P.; Kim, D.M. O uso de matriz de colágeno mucograft para aumentar a zona de tecido queratinizado ao redor dos dentes: Um estudo piloto. Int. J. Periodontics Restor. Dent. 2011, 31, 367–373.
- Lee, J.S.; Shin, H.K.; Yun, J.H.; Cho, K.S. Ensaio clínico randomizado de enxerto de seio maxilar usando mineral ósseo porcino e bovino desproteinizado. Clin. Implant. Dent. Relat. Res. 2017, 19, 140–150. [CrossRef] [PubMed]
- Susin, C.; Lee, J.; Fiorini, T.; Koo, K.T.; Schüpbach, P.; Angst, P.D.; Finger Stadler, A.; Wikesjö, U.M. Triagem de biomateriais candidatos para aumento alveolar usando um modelo de defeito crítico de calvária em ratos. J. Clin. Periodontol. 2018, 45, 884–893. [CrossRef]
- Amara, H.B.; Lee, J.-W.; Kim, J.-J.; Kang, Y.-M.; Kang, E.-J.; Koo, K.-T. Influência do rhBMP-2 na Regeneração Óssea Guiada para Colocação e Carga Funcional de Implantes Dentários: Um Estudo Radiográfico e Histológico em Cães. Int. J. Oral Maxillofac. Implant. 2017, 32, e265–e276. [CrossRef] [PubMed]
- Cho, J.S.; Kim, H.S.; Um, S.H.; Rhee, S.H. Preparação de um novo xenógeno de osso bovino anorgânico com bioatividade e osteocondução aprimoradas. J. Biomed. Mater. Res. Part B Appl. Biomater. 2013, 101, 855–869. [CrossRef] [PubMed]
- Her, S.; Kang, T.; Fien, M.J. Malha de titânio como uma alternativa a uma membrana para aumento de crista. J. Oral Maxillofac. Surg. 2012, 70, 803–810. [CrossRef]
- Louis, P.J.; Gutta, R.; Said-Al-Naief, N.; Bartolucci, A.A. Reconstrução da maxila e mandíbula com enxerto ósseo particulado e malha de titânio para colocação de implante. J. Oral Maxillofac. Surg. 2008, 66, 235–245. [CrossRef] [PubMed]
- Rakhmatia, Y.D.; Ayukawa, Y.; Furuhashi, A.; Koyano, K. Membranas de barreira atuais: Malha de titânio e outras membranas para regeneração óssea guiada em aplicações dentais. J. Prosthodont. Res. 2013, 57, 3–14. [CrossRef]
- Jung, G.-U.; Jeon, J.-Y.; Hwang, K.-G.; Park, C.-J. Avaliação preliminar de uma malha de titânio tridimensional, personalizada e pré-formada na regeneração óssea alveolar peri-implantar. J. Korean Assoc. Oral Maxillofac. Surg. 2014, 40, 181. [CrossRef]
- Lee, S.-H.; Moon, J.-H.; Jeong, C.-M.; Bae, E.-B.; Park, C.-E.; Jeon, G.-R.; Lee, J.-J.; Jeon, Y.-C.; Huh, J.-B. As propriedades mecânicas e o efeito biométrico da membrana de titânio pré-formada 3D para regeneração óssea guiada em defeito ósseo alveolar. BioMed Res. Int. 2017, 2017, 7102123. [CrossRef]
- Tallarico, M.; Ceruso, F.M.; Muzzi, L.; Meloni, S.M.; Kim, Y.-J.; Gargari, M.; Martinolli, M. Efeito da colocação imediata de implante simultânea e reconstrução óssea guiada com membranas de malha de titânio ultrafina nos parâmetros radiográficos e clínicos após 18 meses de carga. Materials 2019, 12, 1710. [CrossRef] [PubMed]
- Fontana, F.; Maschera, E.; Rocchietta, I.; Simion, M. Classificação clínica de complicações em procedimentos de regeneração óssea guiada por meio de uma membrana não reabsorvível. Int. J. Periodontics Restor. Dent. 2011, 31, 265.
- Liyanage, L.; Lee, N.J.; Cook, T.; Herrmann, H.C.; Jagasia, D.; Litt, H.; Han, Y. O impacto do gênero na calcificação do sistema cardiovascular em pacientes muito idosos com estenose aórtica severa. Int. J. Cardiovasc. Imaging 2016, 32, 173–179. [CrossRef]
- Lodewick, T.M.; Arnoldussen, C.W.; Lahaye, M.J.; van Mierlo, K.M.; Neumann, U.P.; Beets-Tan, R.G.; Dejong, C.H.; van Dam, R.M. Volumetria hepática rápida e precisa antes da hepatectomia. HPB 2016, 18, 764–772. [CrossRef] [PubMed]
- Pang, K.-M.; Lee, J.-K.; Choi, S.-H.; Kim, Y.-K.; Kim, B.-J.; Lee, J.-H. Aumento do seio maxilar com osso bovino anorgânico revestido com fosfato de cálcio: Ensaio clínico randomizado multicêntrico comparativo com avaliação histológica e radiográfica. Implant. Dent. 2019, 28, 39–45. [CrossRef] [PubMed]
- Mir-Mari, J.; Wui, H.; Jung, R.E.; Hämmerle, C.H.; Benic, G.I. Influência do fechamento de feridas cegas na estabilidade de volume de diferentes materiais GBR: Um exame tomográfico em cone-beam in vitro. Clin. Oral Implant. Res. 2016, 27, 258–265. [CrossRef] [PubMed]
- Ohe, J.Y.; Kim, G.T.; Lee, J.W.; Al Nawas, B.; Jung, J.; Kwon, Y.D. Estabilidade de volume de material de enxerto ósseo bifásico de hidroxiapatita e β-fosfato de cálcio na elevação do assoalho do seio maxilar: Um estudo radiográfico usando tomografia computadorizada em 3D. Clin. Oral Implant. Res. 2016, 27, 348–353. [CrossRef] [PubMed]
- Mir-Mari, J.; Benic, G.I.; Valmaseda-Castellón, E.; Hämmerle, C.H.; Jung, R.E. Influência do fechamento de feridas na estabilidade de volume de materiais GBR particulados e não particulados: Um exame tomográfico em cone-beam in vitro. Parte II. Clin. Oral Implant. Res. 2017, 28, 631–639. [CrossRef] [PubMed]
- Esposito, M.; Maghaireh, H.; Grusovin, M.G.; Ziounas, I.; Worthington, H.V. Manejo de tecidos moles para implantes dentários: Quais são as técnicas mais eficazes? Uma revisão sistemática Cochrane. Eur. J. Oral. Implant. 2012, 5, 221–238.
- Jemt, T. Falhas de implantes e idade no momento da cirurgia: Um estudo retrospectivo sobre o tratamento com implantes em 2915 mandíbulas parcialmente edêntulas. Clin. Implant. Dent. Relat. Res. 2019, 21, 686–692. [CrossRef] [PubMed]
- Jensen, S.S.; Terheyden, H. Procedimentos de aumento ósseo em defeitos localizados na crista alveolar: Resultados clínicos com diferentes enxertos ósseos e materiais substitutos ósseos. Int. J. Oral Maxillofac. Implant. 2009, 24, 218–236.
- Scheyer, E.T.; Heard, R.; Janakievski, J.; Mandelaris, G.; Nevins, M.L.; Pickering, S.R.; Richardson, C.R.; Pope, B.; Toback, G.; Velásquez, D.; et al. Um ensaio clínico randomizado controlado multicêntrico de preservação da crista alveolar pós-extração. J. Clin. Periodontol. 2016, 43, 1188–1199. [CrossRef]
- Wang, H.-L.; Misch, C.; Neiva, R.F. Técnica de aumento ósseo “sandwich”: Racional e relato de casos piloto. Int. J. Periodontics Restor. Dent. 2004, 24, 232–245.
- Sarnachiaro, G.O.; Chu, S.J.; Sarnachiaro, E.; Gotta, S.L.; Tarnow, D.P. Colocação imediata de implantes em alvéolos de extração com defeitos de deiscência da placa labial: Uma série de casos clínicos. Clin. Implant. Dent. Relat. Res. 2016, 18, 821–829. [CrossRef]
- Meloni, S.M.; Jovanovic, S.A.; Urban, I.; Baldoni, E.; Pisano, M.; Tallarico, M. Aumento horizontal de crista usando GBR com uma membrana de colágeno nativo e uma proporção de 1:1 de xenógeno particulado e osso autólogo: Um estudo clínico prospectivo 3 anos após a carga final. Clin. Implant. Dent. Relat. Res. 2019, 21, 669–677. [CrossRef] [PubMed]
- Cucchi, A.; Sartori, M.; Parrilli, A.; Aldini, N.N.; Vignudelli, E.; Corinaldesi, G. Análise histológica e histomorfométrica do tecido ósseo após regeneração óssea guiada com membranas não reabsorvíveis vs membranas reabsorvíveis e malha de titânio. Clin. Implant. Dent. Relat. Res. 2019, 21, 693–701. [CrossRef]
- Proussaefs, P.; Lozada, J. Uso de malha de titânio para aumento alveolar localizado em estágios: Avaliação clínica e histológica-histomorfométrica. J. Oral Implantol. 2006, 32, 237–247. [CrossRef]
- Sagheb, K.; Schiegnitz, E.; Moergel, M.; Walter, C.; Al-Nawas, B.; Wagner, W. Resultado clínico do aumento da crista alveolar com malha de titânio produzida sob medida por CAD-CAM. Int. J. Implant. Dent. 2017, 3, 1–7. [CrossRef] [PubMed]
