Revestimento de uma Superfície de Implante Jateada com Areia e Ácido com um Agente de Amortecimento de pH após Fotofuncionalização por Vácuo-UV
Tradução automática
O artigo original está escrito em EN language (link para lê-lo) .
Resumo
A fotofuncionalização ultravioleta (UV) pode redefinir o envelhecimento biológico do titânio após a preparação e armazenamento de implantes dentários, transformando superfícies de titânio hidrofóbicas em superfícies superhidrofílicas. A formação de coágulos sanguíneos ao redor do implante pode iniciar e promover o processo de cicatrização na interface osso-implante. O objetivo deste estudo é avaliar e comparar as capacidades de molhabilidade da superfície e coagulação do sangue de implantes com uma superfície convencional jateada com areia e atacada por ácido (SA), uma superfície jateada com areia e atacada por ácido com tratamento de UV a vácuo (SA + VUV), e uma superfície jateada com areia e atacada por ácido revestida com um agente tamponante de pH após o tratamento de UV a vácuo (SA + VUV + BS). Testes estáticos e dinâmicos para molhabilidade da superfície e coagulação do sangue foram realizados in vitro para SA + VUV e SA + VUV + BS (n = 5), enquanto a hemostasia resultante da coagulação do sangue foi avaliada in vivo para SA, SA + VUV e SA + VUV + BS (n = 4). Um teste de Kruskal-Wallis mostrou diferenças estatisticamente significativas (p < 0,05) em todos os testes, com exceção do teste in vitro de coagulação do sangue estática. O tratamento VUV é, portanto, eficaz em tornar uma superfície SA superhidrofílica como uma alternativa à radiação UV-C rotineira. A adição de um agente tamponante de pH ao SA + VUV também melhorou a molhabilidade da superfície e a coagulação do sangue, que são cruciais para uma osseointegração bem-sucedida.
Introdução
O titânio tem sido amplamente utilizado para restauração e reconstrução dentária e ortopédica devido à sua biocompatibilidade, resistência à corrosão e propriedades mecânicas. O titânio oxida facilmente, formando uma camada fina (1–5 nm), estável e passiva que é auto-limitante e protege a superfície do metal de uma oxidação adicional. Esta camada de óxido de titânio (TiO2) é considerada responsável por seu desempenho biológico eficaz devido à transferência de íons de cálcio e fósforo da matriz óssea dentro da camada de TiO2. No entanto, reduções significativas na osseointegração e outras capacidades biológicas do titânio ocorrem ao longo do tempo à medida que o carbono na superfície aumenta devido a uma deposição inevitável de carbono da atmosfera na camada de TiO2 na forma de hidrocarboneto. Este fenômeno é definido como o envelhecimento biológico do titânio, e a capacidade das superfícies de titânio de atrair proteínas e células osteogênicas diminui de maneira dependente do tempo. Outra mudança notável nas superfícies de titânio com o tempo é o desaparecimento da hidrofobicidade. Imediatamente após o processamento, as superfícies de titânio exibem um ângulo de contato da água de 0 ou menos de 5 graus, e tais superfícies são chamadas de superhidrofílicas. Esta característica gradualmente atenua e se torna hidrofóbica em 2 e 4 semanas, com um ângulo de contato superior a 40 e 60 graus, respectivamente.
O tratamento de superfície é utilizado para modificar a topografia e a energia da superfície do implante dental, resultando em melhor molhabilidade, aumento da proliferação e crescimento celular, e aceleração da osseointegração. O tratamento de superfície pode ser alcançado por uma técnica aditiva ou subtrativa. A técnica subtrativa remove ou torna rugosa uma camada de material base, como exemplificado por uma superfície jateada com areia e atacada por ácido (SA). Na técnica aditiva, outros materiais ou agentes químicos são adicionados superficialmente à superfície do titânio através de revestimentos, como pulverização de plasma de titânio, revestimento de hidroxiapatita, revestimento de fosfato de cálcio e outros revestimentos biomiméticos. A perfuração antes da colocação do implante causa trauma ao tecido ósseo semelhante a uma fratura. O local torna-se relativamente hipóxico, e o pH extracelular torna-se ácido. Nessas condições, as células estromais da medula óssea apresentam atividade reduzida de fosfatase alcalina (ALP) e síntese de colágeno, ambos importantes na formação óssea e osseointegração. A glicólise e a síntese de DNA dos osteoblastos também são afetadas por condições ácidas. A agregação plaquetária, que é um passo crítico na formação de coágulos sanguíneos ou trombose, também é reduzida pela acidose extracelular, mediada pela via de entrada de íons de cálcio. A formação de um coágulo sanguíneo suficiente oferece uma ligação direta e estável na interface osso-implante e desempenha um papel importante nas respostas trombogênicas e na osseointegração. Além disso, foi encontrada uma relação entre várias superfícies de implante e a extensão do coágulo de fibrina.
Em nosso estudo anterior, uma nova superfície de SA revestida com um agente tamponante de pH após tratamento com UV a vácuo (VUV) foi introduzida. Esta superfície estava intimamente associada a uma maior afinidade por proteínas, células e plaquetas, o que promoveu a coagulação sanguínea rápida e estável, trombogênese e osseointegração. O objetivo do presente estudo foi avaliar e comparar a molhabilidade da superfície e as habilidades de coagulação sanguínea de várias superfícies de implante, incluindo uma superfície de SA convencional (SA), uma superfície de SA com tratamento VUV (SA + VUV) e uma superfície de SA revestida com um agente tamponante de pH após tratamento VUV (SA + VUV + BS), por meio de análises in vitro e in vivo.
Materiais e Métodos
2.1. Preparação de Fixações de Implante
Fixações de implante de titânio comercialmente puro (grau IV) foram preparadas como SA, SA + VUV (TS III SA, Osstem, Seul, Coreia), e SA + VUV + BS (TS III SOI, Osstem) para uso neste estudo. Como mostrado na Figura 1a,b, a rugosidade da superfície das fixações de implante foi medida em 2,5 ± 0,5 µm de valor Ra, e o tratamento VUV para fotofuncionalização foi alcançado expondo uma fixação de implante a lâmpadas de arco de mercúrio de baixa pressão que emitem UV-C e VUV em um limpador de ozônio UV por 1 h. O revestimento da superfície do implante com um agente tamponante de pH, que compreende grupos iônicos carregados positivamente e negativamente, com valor de pKa de 7,31 a 37°C, foi suplementado para melhor superhidrofobicidade (Figura 1c).
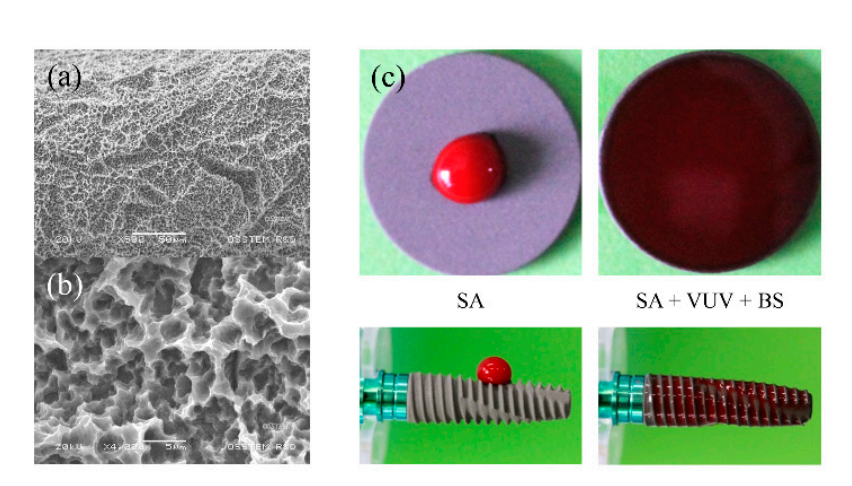
2.2. Testes In Vitro
2.2.1. Molhabilidade de Superfície Estática
Sangue de ovelha heparinizado foi colocado em um prato de 3,5 cm de diâmetro a uma profundidade de 2 a 3 cm. Os implantes de SA + VUV e SA + VUV + BS (n = 5, respectivamente) foram imersos no sangue até a descontinuidade mais alta das roscas apicais, e o tempo para alcançar o topo do implante foi registrado para calcular a velocidade de molhabilidade. O tempo não foi contado a partir do ápice do implante, porque a presença da descontinuidade das roscas apicais fez com que a absorção do sangue parasse abruptamente.
2.2.2. Molhabilidade de Superfície Dinâmica
Para simular as situações clínicas da instalação do implante, foram feitos furos em uma placa de acrílico transparente para garantir visibilidade, de acordo com o protocolo de perfuração do fabricante para densidade óssea dura usando um Kit 122 Taper (Osstem). Uma amostra de 130 µM de sangue de ovelha defibrinado foi colocada em cada furo da placa de acrílico, e os implantes de SA + VUV e SA + VUV + BS (n = 5, respectivamente) foram mergulhados no furo por um medidor de empurrar e puxar (MX-500N, Imada Co., Tóquio, Japão) a uma velocidade de 50 mm/min, e os tempos em que o sangue alcançou os pontos de 2 mm e 4 mm do eixo central do implante acima da placa horizontal, respectivamente, foram registrados (Figura 2).

2.2.3. Coagulação Sanguínea Estática
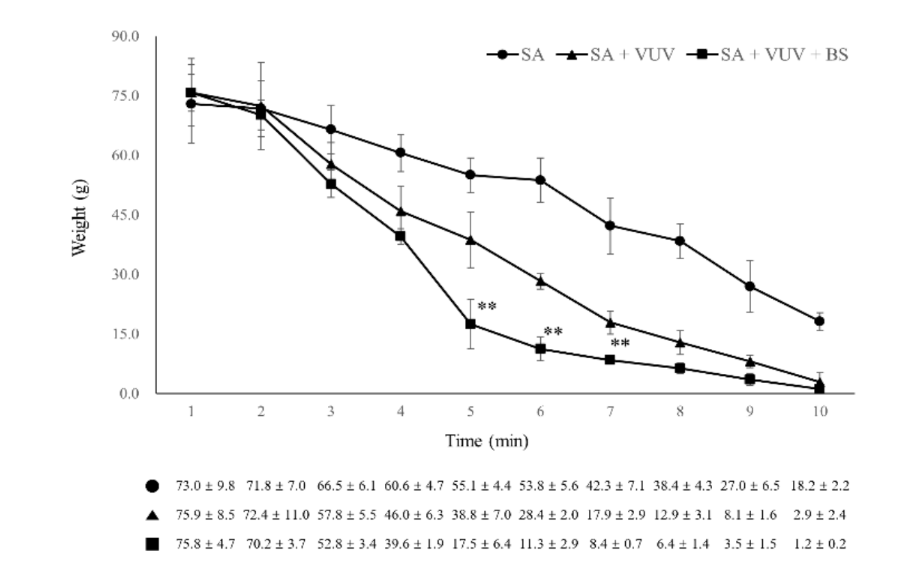
Os dispositivos de implante de SA + VUV e SA + VUV + BS, com 11,5 mm de comprimento e 4,5 mm de diâmetro (n = 5, respectivamente), foram mergulhados até suas extremidades em um prato de 3,5 cm de diâmetro preenchido com 3 mL de sangue de ovelha não heparinizado. O peso (g) do coágulo sanguíneo ao redor do dispositivo de implante foi medido em 5 min, 7,5 min, 10 min e 12,5 min, respectivamente.
2.2.4. Coagulação Sanguínea Dinâmica
Este modelo para coagulação sanguínea ativa foi projetado para simular o fornecimento contínuo de sangue pelos capilares. Os implantes SA + VUV e SA + VUV + BS, que tinham 10 mm de comprimento e 4,0 mm de diâmetro (n = 5), foram inseridos com um torque de inserção pré-definido de 5 N cm em um tubo Eppendorf modificado, que estava conectado a uma bomba de seringa infundindo sangue de ovelha, misturado com 1 IU/mL de heparina, na parte inferior a 37°C. Após 30 minutos de fornecimento de sangue a uma taxa de infusão de 0,05 mL/min, o tempo (min) até que o sangue parasse de gotejar devido à formação de coágulos ao redor do implante e o volume (mL) de sangue, que foi coletado no tubo de 15 mL abaixo do tubo Eppendorf, foram medidos.
2.3. Teste In Vivo
Um modelo de mandíbula de cachorro beagle foi utilizado. Todos os procedimentos foram realizados com a aprovação do Comitê de Ética em Experimentação Animal do Comitê Institucional de Cuidado e Uso de Animais (CRONEX-IACUC 20191002; Cronex, Hwasung, Coreia) de acordo com as diretrizes de Pesquisa Animal: Relato de Experimentos In Vivo (ARRIVE).
Quatro beagles fêmeas de 18 meses de idade foram submetidas à extração bilateral de seus pré-molares mandibulares e do primeiro molar sob anestesia geral. O protocolo anestésico para todos os procedimentos cirúrgicos incluiu uma injeção intramuscular de 1 mL com uma dose de 15 mg/kg de tiletamina/zolazepam (Zoletil 50, Virbac, Seul, Coreia) e 5 mg/kg de xilazina (Rompun, Bayer Coreia, Seul, Coreia). Após a anestesia local, um retalho mucoperióstico de espessura total foi levantado adjacente aos pré-molares e molares mandibulares (Figura 3). Os dentes foram hemissecionados sob irrigação abundante com uma pequena broca de fissura. As extrações foram realizadas com elevadores e fórceps. Os retalhos foram fechados com suturas interrompidas simples. O protocolo de cuidados pós-operatórios incluiu antibióticos e controle da dor. Durante esse intervalo, todos os cães foram mantidos em uma dieta macia e água à vontade.
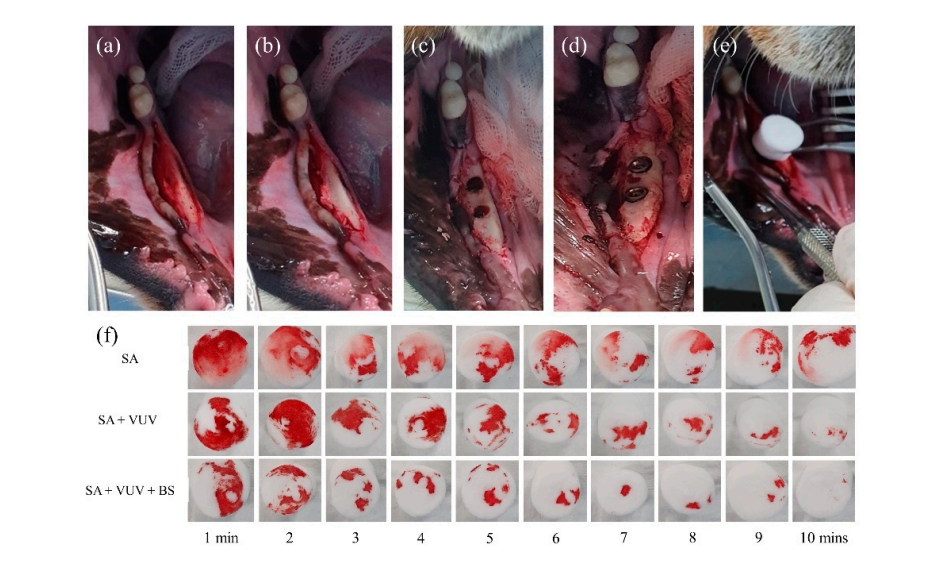
Três meses após as extrações, a colocação cirúrgica de implantes dentários foi realizada nos locais de extração cicatrizados sob condições estéreis. Após anestesia local, um retalho de espessura total foi elevado para expor a crista alveolar, e a crista alveolar irregular foi nivelada. Perfurações sequenciais foram realizadas para os locais de implante consecutivos, que eram maiores do que o corpo do implante, usando uma broca guia, broca de 2,2 mm, broca de 3,0 mm, broca de 4,0 mm e broca ultra-cônica de 6,0 mm. Um total de 12 corpos de implante de SA, SA + VUV e SA + VUV + BS, com 8,5 mm de comprimento e 3,5 mm de diâmetro, foram colocados bilateralmente com um torque de inserção pré-definido de 35 N cm. Todo o sangramento do espaço entre o buraco e o corpo do implante foi absorvido em um pellet de algodão até 10 minutos após a colocação do implante, e o peso (g) do pellet de algodão foi medido a cada minuto para avaliar o potencial de coagulação do sangue dos corpos de implante. Todos os animais experimentais foram sacrificados após a cirurgia por uma overdose intravenosa de cloreto de potássio.
2.4. Análise Estatística
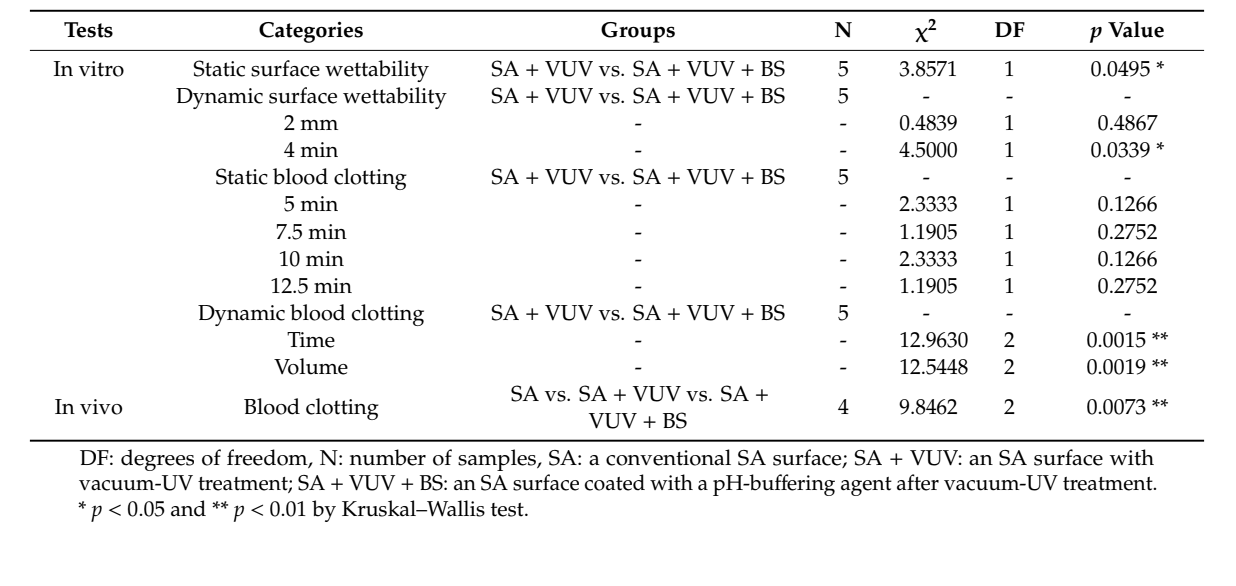
Devido ao pequeno tamanho da amostra, realizamos um teste de Kruskal–Wallis, que é uma comparação não paramétrica da diferença das médias sem uma suposição de normalidade, para examinar as diferenças entre SA + VUV e S + VUV + BS in vitro e entre SA, SA + VUV e SA + VUV + BS in vivo, com uma significância estatística de p < 0.05 em α = 0.05. Todas as análises estatísticas foram realizadas usando SAS, versão 9.4 (SAS Inc., Cary, NC, EUA).
Resultados
3.1. Testes In Vitro
3.1.1. Molhabilidade da Superfície Estática
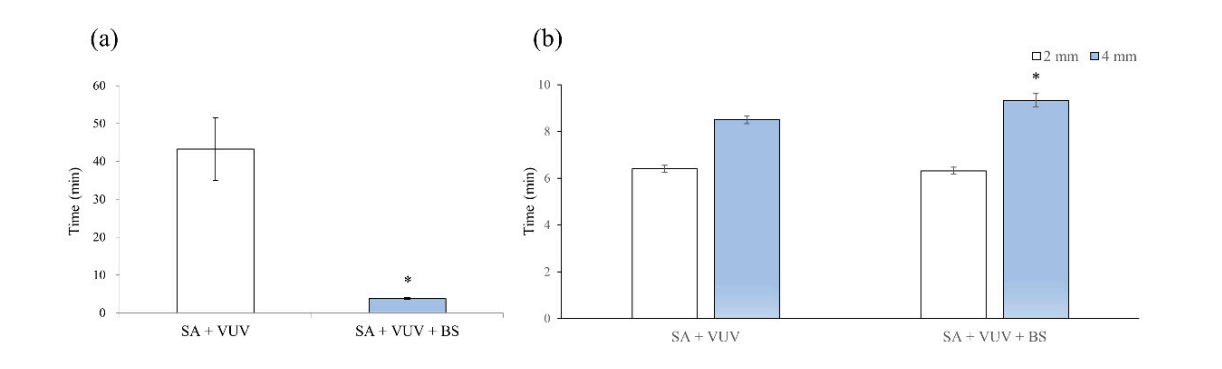
Os tempos antes que o sangue chegasse ao topo do implante foram de 43.3 ± 8.3 min e 3.8 ± 0.3 min em SA + VUV e SA + VUV + BS, respectivamente, e uma diferença estatisticamente significativa (p < 0.05) entre os dois foi evidente (Figura 4a).
3.1.2. Molhabilidade da Superfície Dinâmica
Os tempos antes que o sangue chegasse a 2 mm acima da placa horizontal foram de 6.4 ± 0.1 min e 6.3 ± 0.2 min, e para 4 mm acima da placa horizontal, foram de 8.5 ± 0.2 min e 9.3 ± 0.3 min em SA + VUV e SA + VUV + BS, respectivamente. Uma diferença estatisticamente significativa (p < 0.05) entre SA + VUV e SA + VUV + BS foi encontrada apenas para o tempo antes que o sangue chegasse a 4 mm acima da placa horizontal (Figura 4b).
3.1.3. Coagulação Sanguínea Estática
No SA + VUV, os pesos do coágulo sanguíneo formado ao redor do implante, que foram medidos em 5 min, 7,5 min, 10 min e 12,5 min após a imersão do implante no sangue, foram 0,04 ± 0,01 g, 0,09 ± 0,03 g, 0,23 ± 0,06 g e 0,39 ± 0,16 g, respectivamente. No SA + VUV + BS, os pesos foram 0,07 ± 0,03 g, 0,12 ± 0,02 g, 0,39 ± 0,20 g e 0,61 ± 0,18 g, respectivamente, e nenhuma diferença estatisticamente significativa foi medida entre SA + VUV e SA + VUV + BS em qualquer momento (p > 0,05).
3.1.4. Coagulação Sanguínea Dinâmica
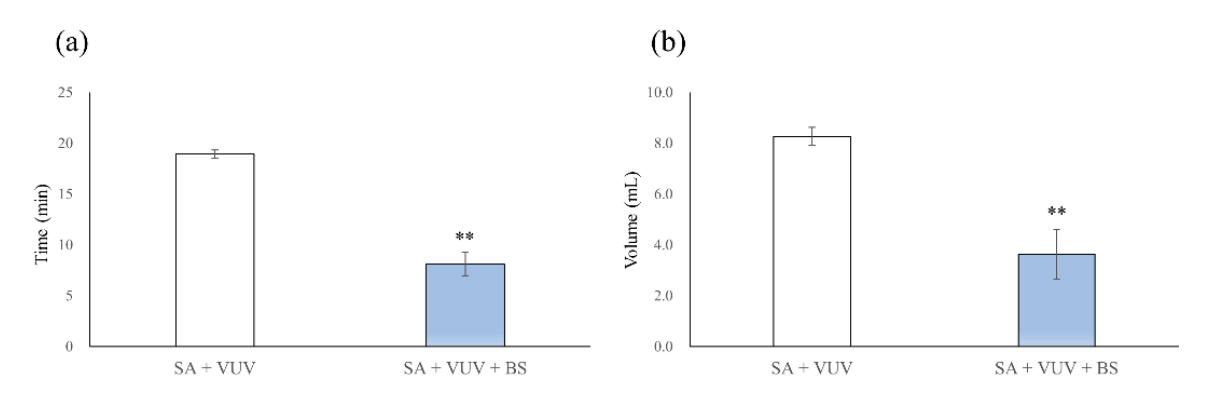
Os tempos para hemostasia completa foram 19,0 ± 0,4 min e 8,1 ± 1,2 min no SA + VUV e SA + VUV + BS, respectivamente, e houve uma diferença estatisticamente significativa entre SA + VUV e SA + VUV + BS (p < 0,01, Figura 5a). Além disso, os volumes de sangue coletados no tubo subjacente foram 8,27 ± 0,36 mL e 3,64 ± 0,99 mL no SA + VUV e SA + VUV + BS, respectivamente, com uma diferença estatisticamente significativa (p < 0,01, Figura 5b) evidente entre SA + VUV e SA + VUV + BS.
3.2. Teste In Vivo
Entre SA, SA + VUV e SA + VUV + BS, houve diferenças estatisticamente significativas nos pesos do sangue total absorvido no pellet de algodão medidos em 5 min, 6 min e 7 min (p < 0.01, Figura 6). As estatísticas resumidas deste estudo estão mostradas na Tabela 1.
Discussão
A fotofuncionalização UV, um método de modificação das superfícies de titânio após o tratamento UV que inclui a alteração das propriedades físico-químicas e o aumento das biocompatibilidades, foi proposta para redefinir o envelhecimento biológico do titânio. Após o tratamento com radiação UV, a camada de TiO2 de uma superfície de titânio incorporada com hidrocarbonetos tornou-se notavelmente hidrofílica ou superhidrofílica. A quantidade de carbono na superfície é conhecida por variar dependendo da idade da superfície e, segundo relatos, pode aumentar para aproximadamente 60% a 70% dos componentes atômicos da superfície. O tratamento UV limpa essas superfícies de titânio contaminadas por carbono, reduzindo a porcentagem de carbono para menos de 20% e, ao mesmo tempo, aumentando o nível de osseointegração. No espectro UV, tanto o UV-A quanto o UV-C convertem superfícies de titânio biologicamente envelhecidas de hidrofóbicas para superhidrofílicas, mas apenas o UV-C (200–280 nm) é conhecido por reduzir efetivamente o carbono na superfície para um nível equivalente a uma superfície nova e aumentar a bioatividade. O UV-C é capaz de remover hidrocarbonetos de uma camada de TiO2 de titânio por fotodecomposição direta, que é mais eficaz do que a fotocatálise pelo UV-A. Em nosso estudo, todos os implantes foram fotofuncionalizados por UV-C e VUV (100–200 nm), e a remoção radical de hidrocarbonetos da camada de TiO2 de titânio poderia proporcionar mais superhidrofobicidade. O VUV é rapidamente absorvido pela água na atmosfera e, portanto, é capaz de gerar várias espécies reativas de oxigênio ao quebrar ligações de hidrogênio nas moléculas de água via hidrólise. A hidrólise iniciada por VUV é um método eficiente de obtenção de grupos hidroxila ou hidroxila em uma camada de TiO2 que proporciona superhidrofobicidade persistente. Como o tratamento VUV tende a gerar mais ozônio na atmosfera e radicais hidroxila na água, deve ser estritamente limitado apenas a ambientes laboratoriais ou industriais, e não clínicos.
Para acelerar a cicatrização óssea e melhorar a ancoragem óssea a um implante, a interface osso/implante pode ser aprimorada topograficamente e bioquimicamente incorporando fases inorgânicas, como fosfato de cálcio, e moléculas orgânicas, como proteínas, enzimas ou peptídeos, na ou na camada de TiO2. Superfícies de implante nanoestruturadas, que possuem uma área de superfície extensa, alta energia livre de superfície e molhabilidade, parecem ser capazes de modificar a resposta do tecido hospedeiro. Superfícies de implante SA demonstraram resultados clínicos previsíveis e são consideradas como superfície padrão de implante. A superhidrofobicidade de SA + VUV + BS, que foi previamente encontrada na superfície plana de discos, foi confirmada em nosso teste de molhabilidade de superfície estática. Como a capacidade de atrair sangue próximo ao topo do fixador do implante (aproximadamente 4 mm acima da placa horizontal em nosso estudo) é o que a maioria dos clínicos prefere verificar em um ambiente clínico, adicionamos um novo teste dinâmico de molhabilidade de superfície para comparar as velocidades de molhabilidade de SA + VUV e SA + VUV + BS em mais detalhes. Como SA é uma superfície seca que não entrou em contato com nenhum líquido, a molhabilidade da superfície de SA + VUV + BS pode ser significativamente superior à de SA apenas pelo efeito do agente tampão de pH de SA + VUV + BS. No entanto, dado que os fixadores de implante são colocados com superfícies secas ou sem qualquer hidratação adicional em situações clínicas reais, escolhemos um SA ingênuo, em vez de um SA hidratado em solução, como controle. Uma superfície mais hidrofílica foi anteriormente encontrada como estando intimamente relacionada à osseointegração superior e mais rápida. Além disso, sabe-se que a molhabilidade da superfície altera as respostas biológicas das superfícies de implante em relação à adesão de proteínas e outras moléculas, bem como interações celulares.
Como a formação de coágulos sanguíneos sinaliza o início do processo de cicatrização, a interação entre um implante e o sangue é considerada importante para a bem-sucedida osseointegração de implantes de titânio após a implantação. A formação de coágulos sanguíneos em superfícies de titânio rugosas pode induzir o recrutamento de células e estimular a cicatrização de feridas, e foi revelado que tanto pré-osteoblastos quanto osteoblastos podem se aderir a uma superfície de implante coberta por plaquetas e fibrina, onde se diferenciam sob a estimulação de fatores osteogênicos e citocinas liberadas do coágulo sanguíneo peri-implante. A formação de coágulos sanguíneos no implante com várias superfícies de implante é considerada um fator crucial na retenção eficaz de fibrina e pode afetar criticamente a cicatrização óssea e a osseointegração ao influenciar o transporte de macromoléculas, o comportamento celular e a osteogênese de contato/distância. Em um teste de coagulação sanguínea estática, o SA + VUV + BS mostrou uma absorção de sangue superior ao redor dos fixadores do implante em comparação com SA + VUV, mas não a um grau estatisticamente significativo. Isso indica que uma superfície SA fotofuncionalizada com VUV tem pelo menos uma capacidade igual na coagulação sanguínea. Projetamos novos experimentos para confirmar a coagulação sanguínea por hemostasia de sangramentos capilares contínuos para simular situações clínicas reais o mais precisamente possível. Em um teste de coagulação sanguínea dinâmica in vitro, os coágulos se formaram significativamente mais rápido, e o volume total de sangue coletado através da lacuna entre os buracos e o fixador do implante até a hemostasia foi significativamente menor em SA + VUV + BS do que em SA + VUV. Um teste in vivo também mostrou uma diferença significativa no peso total do sangramento entre o buraco excessivamente preparado e um fixador de implante entre SA, SA + VUV e SA + VUV + BS. Isso sugere que SA + VUV + BS pode induzir uma formação de coágulos sanguíneos mais rápida ao redor da superfície do implante, levando a uma interação mais eficaz da interface osso-implante para a osseointegração. Em um aspecto clínico, essas características de SA + VUV + BS são importantes na visualização do local cirúrgico e na regeneração óssea guiada simultânea, que é frequentemente indicada para a quantidade e qualidade adequadas dos tecidos peri-implante para resultados mais estéticos e funcionais, pois a coagulação sanguínea rápida está intimamente associada à estabilização do material de enxerto e da membrana de barreira. Finalmente, SA + VUV poderia ser uma alternativa a SA + VUV + BS em relação ao potencial para formação de coágulos sanguíneos em superfícies de implante.
Durante a perfuração do implante no osso, que produz uma condição levemente ácida, um tampão de pH pode ajudar a manter o pH constante. Como material de revestimento, o agente de tamponamento de pH parece controlar a liberação dos mediadores inflamatórios e melhorar as condições para a atividade dos osteoblastos, mantendo o pH constante ou pelo menos prevenindo mudanças significativas. A atividade das plaquetas na coagulação do sangue e tanto a atividade dos osteoblastos quanto o nível de ALP para a formação óssea também são inibidos pela acidose extracelular. SA + VUV + BS poderia maximizar a atividade das plaquetas, a trombogênese, a atividade dos osteoblastos e o nível de ALP em uma interface osso-implante através de um efeito de tamponamento de pH. Estudos adicionais serão necessários para investigar SA + VUV + BS em relação à sua segurança e eficácia em ambientes clínicos. Ensaios controlados randomizados também devem ser realizados para confirmar sua viabilidade em várias condições clínicas, como a colocação de implantes imediatamente após a extração dentária ou com aumento ósseo simultâneo.
Chang-Joo Park, Jae Hyung Lim, Marco Tallarico, Kyung-Gyun Hwang, Hyook Choi, Gyu-Jang Cho, Chang Kim, Il-Seok Jang, Ju-Dong Song, Amy M. Kwon, Sang Ho Jeon e Hyun-Kyung Park
Referências
- Özcan, M.; Hämmerle, C. Titânio como material de reconstrução e implante em odontologia: Vantagens e armadilhas. Materiais 2012, 5, 1528–1545. [CrossRef]
- Ehrenfest, D.M.D.; Coelho, P.G.; Kang, B.S.; Sul, Y.T.; Albrektsson, T. Classificação das superfícies de implantes osseointegrados: Materiais, química e topografia. Tendências Biotecnol. 2010, 28, 198–206. [CrossRef]
- Milošev, I.; Metikoš-Hukovic´, M.; Strehblow, H.H. Filme passivo em liga de TiAlV ortopédica formada em solução fisiológica investigada por espectroscopia de fotoelétrons de raios X. Biomateriais 2000, 21, 2103–2113. [CrossRef]
- Lee, J.H.; Ogawa, T. O envelhecimento biológico de implantes de titânio. Dent. Implante. 2012, 21, 415–421. [CrossRef]
- Hori, N.; Att, W.; Ueno, T.; Sato, N.; Yamada, M.; Saruwatari, L.; Suzuki, T.; Ogawa, T. Degradação dependente da idade da capacidade de adsorção de proteínas do titânio. J. Dent. Res. 2009, 88, 663–667. [CrossRef]
- Hori, N.; Ueno, T.; Suzuki, T.; Iwasa, F.; Yamada, M.; Att, W.; Okada, S.; Ohno, A.; Aita, H.; Kimoto, K. Tratamento com luz ultravioleta para a restauração da degradação relacionada à idade da bioatividade do titânio. Int. J. Oral Maxillofac. Implant. 2010, 25, 49–62.
- Ogawa, T. Fotofuncionalização ultravioleta de implantes de titânio. Int. J. Oral Maxillofac. Implant. 2014, 29, e95–e102. [CrossRef] [PubMed]
- Rosales-Leal, J.; Rodríguez-Valverde, M.; Mazzaglia, G.; Ramón-Torregrosa, P.; Díaz-Rodríguez, L.; García-Martínez, O.; Vallecillo-Capilla, M.; Ruiz, C.; Cabrerizo-Vílchez, M. Efeito da rugosidade, molhabilidade e morfologia das superfícies de titânio projetadas na adesão de células semelhantes a osteoblastos. Colóides Surf. Físicoquím. Eng. Aspectos 2010, 365, 222–229. [CrossRef]
- Cicciù, M.; Fiorillo, L.; Herford, A.S.; Crimi, S.; Bianchi, A.; D’Amico, C.; Laino, L.; Cervino, G. Superfícies de titânio bioativas: Interações de células eucarióticas e procarióticas de dispositivos nano aplicados à prática odontológica. Biomedicinas 2019, 7, 12. [CrossRef]
- Li, D.; Ferguson, S.J.; Beutler, T.; Cochran, D.L.; Sittig, C.; Hirt, H.P.; Buser, D. Comparação biomecânica da superfície de titânio jateada com areia e ácido-etchada e a superfície de titânio usinada e ácido-etchada para implantes dentários. J. Biomed. Mater. Res. 2002, 60, 325–332. [CrossRef]
- Kaysinger, K.K.; Ramp, W.K. O pH extracelular modula a atividade de osteoblastos humanos cultivados. J. Cell. Biochem. 1998, 68, 83–89. [CrossRef]
- Marumo, M.; Suehiro, A.; Kakishita, E.; Groschner, K.; Wakabayashi, I. O pH extracelular afeta a agregação plaquetária associada à modulação da entrada de Ca2+ operada por armazenamento. Thromb. Res. 2001, 104, 353–360. [CrossRef]
- Hong, J.; Kurt, S.; Thor, A. Uma superfície de implante dentário hidrofílica exibe propriedades trombogênicas in vitro. Clin. Implant Dent. Relat. Res. 2013, 15, 105–112. [CrossRef]
- Di Iorio, D.; Traini, T.; Degidi, M.; Caputi, S.; Neugebauer, J.; Piattelli, A. Avaliação quantitativa da extensão do coágulo de fibrina em diferentes superfícies de implantes: Um estudo in vitro. J. Biomed. Mater. Res. 2005, 74, 636–642. [CrossRef]
- Pae, H.C.; Kim, S.K.; Park, J.Y.; Song, Y.W.; Cha, J.K.; Paik, J.W.; Choi, S.H. Características bioativas de uma superfície de implante revestida com um agente tampão de pH: Um estudo in vitro. J. Periodontal Implant. Sci. 2019, 49, 366–381. [CrossRef]
- Cho, Y.S.; Hwang, K.G.; Jun, S.H.; Tallarico, M.; Kwon, A.M.; Park, C.J. Análise comparativa radiológica entre preenchimento com solução salina e fibrina rica em plaquetas após levantamento sinusal transcrestal hidráulico sem enxerto ósseo adjunto: Um ensaio clínico controlado randomizado. Clin. Oral Implant. Res. 2020. [CrossRef] [PubMed]
- Att, W.; Hori, N.; Iwasa, F.; Yamada, M.; Ueno, T.; Ogawa, T. O efeito da fotofuncionalização UV na bioatividade do titânio e ligas de cromo-cobalto relacionadas ao tempo. Biomateriais 2009, 30, 4268–4276. [CrossRef]
- Shie, J.L.; Lee, C.H.; Chiou, C.S.; Chang, C.T.; Chang, C.C.; Chang, C.Y. Cinética de fotodegradação de formaldeído usando fontes de luz UVA, UVC e UVLED na presença de um fotocatalisador composto de óxido de titânio prata. J. Hazard. Mater. 2008, 155, 164–172. [CrossRef]
- McGivney, E.; Carlsson, M.; Gustafsson, J.P.; Gorokhova, E. Efeitos de processos de oxidação avançada UV-C e Vácuo-UV TiO2 na mortalidade aguda de microalgas. Fotochem. Fotobiol. 2015, 91, 1142–1149. [CrossRef]
- Westall, J.; Hohl, H. Uma comparação de modelos eletrostáticos para a interface de solução de óxido. Adv. Colloid Interface Sci. 1980, 12, 265–294. [CrossRef]
- Tang, L.; Thevenot, P.; Hu, W. A química da superfície influencia a biocompatibilidade do implante. Curr. Top. Med. Chem. 2008, 8, 270–280. [CrossRef]
- Coelho, P.G.; Granjeiro, J.M.; Romanos, G.E.; Suzuki, M.; Silva, N.R.; Cardaropoli, G.; Thompson, V.P.; Lemons, J.E. Métodos de pesquisa básica e tendências atuais das superfícies de implantes dentários. J. Biomed. Mater. Res. 2009, 88, 579–596. [CrossRef]
- Puleo, D.; Nanci, A. Compreendendo e controlando a interface osso-implante. Biomateriais 1999, 20, 2311–2321. [CrossRef]
- Morra, M.; Cassinelli, C.; Cascardo, G.; Mazzucco, L.; Borzini, P.; Fini, M.; Giavaresi, G.; Giardino, R. Superfícies de titânio revestidas com colágeno I: Adesão de células mesenquimatosas e avaliação in vivo em implantes de osso trabecular. J. Biomed. Mater. Res. 2006, 78, 449–458. [CrossRef] [PubMed]
- Morra, M. Modificação bioquímica de superfícies de titânio: Peptídeos e proteínas da MEC. Eur. Cell. Mater. 2006, 12, 15. [CrossRef]
- Makowiecki, A.; Hadzik, J.; Błaszczyszyn, A.; Gedrange, T.; Dominiak, M. Uma avaliação de superfícies superhidrofílicas de implantes dentários - uma revisão sistemática e meta-análise. BMC Saúde Oral 2019, 19, 79. [CrossRef]
- Khandelwal, N.; Oates, T.W.; Vargas, A.; Alexander, P.P.; Schoolfield, J.D.; Alex McMahan, C. Implantes SLA convencionais e SLA quimicamente modificados em pacientes com diabetes mellitus tipo 2 mal controlada - Um ensaio clínico controlado randomizado. Clin. Oral Implant. Res. 2013, 24, 13–19. [CrossRef]
- Kokovic, V.; Jung, R.; Feloutzis, A.; Todorovic, V.S.; Jurisic, M.; Hämmerle, C.H. Carga imediata vs. carga precoce de implantes SLA na mandíbula posterior: Resultados de 5 anos de ensaio clínico controlado randomizado. Clin. Oral Implant. Res. 2014, 25, e114–e119. [CrossRef]
- Cesaretti, G.; Botticelli, D.; Renzi, A.; Rossi, M.; Rossi, R.; Lang, N.P. Avaliação radiográfica de implantes carregados imediatamente suportando 2–3 unidades de pontes fixas na maxila posterior: Um estudo clínico multicêntrico controlado randomizado de acompanhamento de 3 anos. Clin. Oral Implant. Res. 2016, 27, 399–405. [CrossRef]
- Buser, D.; Broggini, N.; Wieland, M.; Schenk, R.; Denzer, A.; Cochran, D.; Hoffmann, B.; Lussi, A.; Steinemann, S. Aumento da aposição óssea a uma superfície de titânio SLA quimicamente modificada. J. Dent. Res. 2004, 83, 529–533. [CrossRef]
- Lang, N.P.; Salvi, G.E.; Huynh-Ba, G.; Ivanovski, S.; Donos, N.; Bosshardt, D.D. Osseointegração precoce em superfícies de implantes hidrofílicas e hidrofóbicas em humanos. Clin. Oral Implant. Res. 2011, 22, 349–356. [CrossRef] [PubMed]
- Gittens, R.A.; Scheideler, L.; Rupp, F.; Hyzy, S.L.; Geis-Gerstorfer, J.; Schwartz, Z.; Boyan, B.D. Uma revisão sobre a molhabilidade das superfícies de implantes dentários II: Aspectos biológicos e clínicos. Acta Biomater. 2014, 10, 2907–2918. [CrossRef]
- Shiu, H.T.; Goss, B.; Lutton, C.; Crawford, R.; Xiao, Y. A formação de coágulo sanguíneo em implantes biomateriais influencia a cicatrização óssea. Tissue Eng. Parte B Rev. 2014, 20, 697–712. [CrossRef]
- Yang, J.; Zhou, Y.; Wei, F.; Xiao, Y. O coágulo sanguíneo formado na superfície rugosa de titânio induz recrutamento celular precoce. Clin. Oral Implant. Res. 2016, 27, 1031–1038. [CrossRef]
- Gassling, V.; Hedderich, J.; Açil, Y.; Purcz, N.; Wiltfang, J.; Douglas, T. Comparação de fibrina rica em plaquetas e colágeno como scaffolds semeados com osteoblastos para aplicações de engenharia de tecido ósseo. Clin. Oral Implant. Res. 2013, 24, 320–328. [CrossRef]
