Efeito da Colocação Imediata de Implantes Simultânea à Reconstrução Óssea Guiada com Membranas de Malha de Titânio Ultra-Fina em Parâmetros Radiográficos e Clínicos Após 18 Meses de Carga
Tradução automática
O artigo original está escrito em EN language (link para lê-lo) .
Resumo
Contexto: O objetivo do presente estudo de série de casos prospectivo foi avaliar as taxas de sobrevivência de implantes e próteses, complicações e perda óssea marginal utilizando uma membrana de malha de titânio ultra-fina com colocação simultânea de implantes, para fornecer a manutenção do espaço necessária para a reconstrução óssea guiada de defeitos ósseos alveolares.
Materiais e Métodos: pacientes foram recrutados e tratados em uma clínica privada em Roma, Itália, entre março de 2016 e outubro de 2017. Implantes cônicos autoperfurantes foram colocados através de uma abordagem assistida por template guiado por computador. Osso autógeno foi colocado sozinho sobre a superfície exposta do implante, depois misturado com material ósseo bovino inorgânico. Finalmente, a membrana foi conectada e moldada para fechar com segurança a área do enxerto, e o capô de cicatrização foi conectado e rosqueado no conector de altura. As medidas de resultado foram: falha do implante e da prótese, complicações biológicas e mecânicas, mudanças nos níveis ósseos marginais e volumétricos, avaliação estética realizada de acordo com a pontuação estética rosa (PES).
Resultados: no total, sete pacientes (cinco mulheres, dois homens) com uma idade média de 52,7 ± 20,3 anos (faixa: 27–71) receberam 10 implantes cônicos auto-perfurantes e regeneração óssea guiada simultânea com membranas de malha de titânio ultra-finas. Nenhum implante e nenhuma prótese falharam durante todo o período de acompanhamento. Uma leve exposição da membrana foi observada um mês após a colocação do implante em um paciente. A perda óssea marginal média (MBL) na carga do implante foi de 0,13 ± 0,09 mm (IC 95 % 0,08–0,19). Na avaliação de acompanhamento de 18 meses, a MBL média foi de 0,28 ± 0,33 mm (IC 95 % 0,07–0,50). A diferença não foi estatisticamente significativa (0,15 ± 0,31; IC 95 % 0,05–0,35; P = 0,1888). A largura média do rebordo alveolar horizontal foi de 3,72 ± 1,08 mm (IC 95 % 3,22–4,22 mm). Na cirurgia de II etapa, a largura média do osso foi de 8,79 ± 0,98 mm (IC 95 % 8,51–9,07 mm). O ganho ósseo médio foi de 5,06 ± 1,13 mm (IC 95 % 4,68–5,44 mm; P = 0,000). O volume médio do osso enxertado calculado usando a técnica de sobreposição foi de 0,99 ± 0,38 CC (IC 95 % 0,75–1,23 CC). A PES média na carga do implante foi de 8,2 ± 0,8 mm (IC 95 % 7,7–8,7). Na avaliação de acompanhamento de 18 meses, a PES média foi de 12,0 ± 0,7 mm (IC 95 % 11,5–12,5). A diferença foi estatisticamente significativa (3,8 ± 0,4; IC 95 % 3,5–4,1; P = 0,0000).
Conclusão: com a limitação do presente estudo prospectivo, a reconstrução óssea guiada utilizando uma membrana de malha de titânio ultra-fina com colocação simultânea de implante parece fornecer resultados bons e estáveis no sucesso do implante/prótese. Mais pesquisas com um acompanhamento mais longo e um tamanho de amostra maior são necessárias para confirmar os resultados deste relatório preliminar.
Introdução
A atrofia do osso alveolar é uma situação clínica crônica e progressiva caracterizada pela perda moderada a severa do volume ósseo devido à perda ou extração de dentes. Além disso, condições ou doenças locais, como extração traumática, doença periodontal e trauma, podem amplificar essa condição patológica, tornando a colocação de implantes dentários difícil ou desfavorável tanto do ponto de vista funcional quanto estético. Para superar essas possíveis desvantagens, técnicas de reconstrução óssea foram introduzidas. Entre elas, a regeneração óssea guiada (GBR) é um procedimento cirúrgico que utiliza um material de enxerto como um suporte isolado e protegido com uma membrana, das células não osteogênicas, derivadas do tecido conjuntivo adjacente. Assim, o efeito de barreira da membrana deve permitir apenas que as células osteogênicas, derivadas do osso e vasos circundantes, se movam para o defeito ósseo, permitindo a formação óssea através da presença de sinais estimulantes.
Tanto as membranas reabsorvíveis quanto as não reabsorvíveis têm sido usadas para isolar e manter um suporte biológico correto e planejado, necessário para a formação de novo tecido ósseo. Dada a natureza de sua função, a membrana não reabsorvível deve ser mais previsível e segura de usar. No entanto, a principal limitação é que uma cirurgia adjunta é necessária para remover a membrana. No entanto, a reconstrução óssea guiada é geralmente realizada em duas etapas ou com um protocolo de implante submerso quando realizada em uma única etapa. Assim, a membrana poderia ser removida na colocação do implante ou na segunda etapa se a GBR fosse feita ao mesmo tempo que o implante.
Na prática diária, as membranas não reabsorvíveis de politetrafluoretileno expandido (e-PTFE) podem ser consideradas a primeira escolha nas reconstruções de defeitos ósseos horizontais e verticais. No entanto, desde a década de 1990, vários pesquisadores investigaram o uso clínico de malhas de titânio ultra-finas (malhas de Ti) para a reconstrução da mandíbula e maxila atróficas. O titânio é mais resistente ao colapso do que as membranas de e-PTFE e reabsorvíveis. Assim, a rigidez do titânio pode funcionar como um suporte, mantendo o espaço necessário para a regeneração óssea, mesmo em casos de um grande defeito ósseo, como a reconstrução óssea vertical.
A porosidade das malhas de Ti pode ser modificada para alcançar uma melhor integração e formação de tecido. Variar a porosidade das malhas de Ti permite que fluidos e nutrientes passem pela membrana, evitando a infiltração de células.
Atualmente, diferentes formas de membrana de malha de Ti foram propostas para maximizar a formação de novo osso, estabilizar os materiais do enxerto sob a membrana e reduzir o risco de exposição da membrana, que pode causar colapso e/ou crescimento do tecido mole adjacente.
O objetivo do presente estudo de série de casos prospectivo foi avaliar as taxas de sobrevivência do implante e prostética, complicações, perda óssea marginal, utilizando membrana de malha de titânio ultra-fina e colocação simultânea de implantes, para fornecer a manutenção do espaço necessária para a augmentação óssea de defeitos ósseos alveolares. Este ensaio seguiu as disposições da declaração Strengthening the Reporting of Observational Studies in Epidemiology (STROBE).
Materiais e Métodos
Esta pesquisa foi projetada como um estudo de série de casos para avaliar os resultados clínicos e radiográficos da reconstrução óssea guiada simultânea e colocação de implantes com membrana de malha de titânio ultra-fina. Os pacientes foram recrutados e tratados em uma clínica privada em Roma, Itália, entre março de 2016 e outubro de 2017. Os procedimentos cirúrgicos foram realizados por um clínico especialista (MT) certificado em terapia baseada em implantes pela associação europeia de osseointegração em 2013. Todos os pacientes foram informados sobre a natureza do estudo e deram seu consentimento por escrito para os procedimentos cirúrgicos e prostéticos e para o uso de dados radiológicos e clínicos para publicação. Os princípios contidos na Declaração de Helsinque de 2013 foram seguidos rigorosamente. Além disso, o protocolo radiológico foi aprovado pelo Comitê Científico Técnico e Ético da Universidade de Sassari (2069/CE).
Qualquer paciente consecutivo com 18 anos ou mais que apresentasse edentulismo parcial da maxila ou mandíbula, capaz de entender e assinar um termo de consentimento informado, e que necessitasse de uma restauração suportada por implante, foi considerado elegível para inclusão neste estudo. Os pacientes foram finalmente incluídos se apresentassem uma atrofia de classe IV a VI de Cawood e Howell da crista alveolar residual na exame de tomografia computadorizada de feixe cônico. Os pacientes foram excluídos se apresentassem contraindicações gerais à cirurgia de implante (como irradiação da área da cabeça e pescoço nos cinco anos anteriores à implantação, ou diabetes não controlada); gravidez ou lactação; abuso de substâncias; terapia psiquiátrica ou expectativas irreais; tratamento anterior ou em andamento com bisfosfonatos intravenosos; periodontite não tratada ou má higiene bucal (sangramento à sondagem e/ou índice de placa ≥ 25%); fumantes pesados (≥11 cigarros/dia); locais pós-extrativos.
Antes da cirurgia de implante, uma tomografia CBCT (CBCT, CRANEX 3D; Soredex, Tuusula, Finlândia) e uma impressão digital intraoral (scanner intraoral CS 3600, Carestream Dental, Atlanta, GA, EUA) foram realizadas. A tomografia CBCT foi configurada com um campo de visão de 80 mm× 150 mm; tamanho do voxel de 0,3 µm; 90 KV; 6,3–10 mA por 4,5 s, resultando em um produto de dose-área de 579,7–920,2 (mGycm2). Os dados STL e DICOM (Imagens Digitais e Comunicações em Medicina) foram importados em um software dedicado para diagnóstico e planejamento de implantes (3Diagnosys versão 4.2, 3DIEMME srl, Cantù, Itália). Em seguida, os implantes orientados pela prótese foram planejados virtualmente.
Uma hora antes da cirurgia, uma dose única de antibióticos (2 g de amoxicilina e ácido clavulânico, ou 600 mg de clindamicina se alérgico à penicilina) foi administrada profilaticamente. Um enxágue bucal de digluconato de clorexidina a 0,2% foi administrado por dois minutos antes da cirurgia.
Todos os pacientes foram tratados sob sedação oral com diazepam 10 mg (Valium, Roche S.p.A., Monza, Itália). Anestesia local usando articaína com adrenalina 1:100.000 foi administrada. Uma incisão midcrestal foi feita no tecido queratinizado usando lâmina de bisturi cirúrgico nº 15C. Um retalho de espessura total foi elevado além da junção mucogengival. Em seguida, duas incisões verticais foram feitas a uma distância de um dente do defeito ósseo, ou pelo menos 5 mm de distância em caso de área edêntula. Então, o local receptor foi limpo removendo todos os restos de tecido mole. O implante TSIII autoperfurante e cônico (Osstem Implant, Seul, Coreia) foi colocado através de uma abordagem assistida por template guiado por computador, ao nível do osso ou 1 mm mais profundo, de acordo com o protocolo de perfuração sugerido pelo fabricante. Todos os templates cirúrgicos foram suportados por dentes e foram feitos sem mangas metálicas. A principal característica da membrana OssBuilder é que ela é fixada diretamente ao implante em uma abordagem de uma única etapa. Para garantir a membrana no implante, uma ferramenta especial chamada conector de altura (Osstem Implant) deve ser usada. Esta ferramenta está disponível em diferentes alturas para conectar a membrana ao implante em diferentes níveis, dependendo do osso residual e da profundidade do implante. Usando um driver hexagonal de 1,2, o conector de altura foi aparafusado ao fixture a 5 a 8 N·cm. Em seguida, osso autógeno foi coletado da área adjacente, usando um coletor de osso cortical minimamente invasivo (Micross, Meta, Itália). O osso foi coletado na área mesial ou distal próxima ao defeito. Após isso, o defeito ósseo foi medido para determinar a forma e o tamanho apropriados da membrana de malha de titânio (OssBuilder, Osstem Implant). Todas as membranas utilizadas eram de titânio puro grau 2 e projetadas com poros de 0,6 a 1 mm de diâmetro.
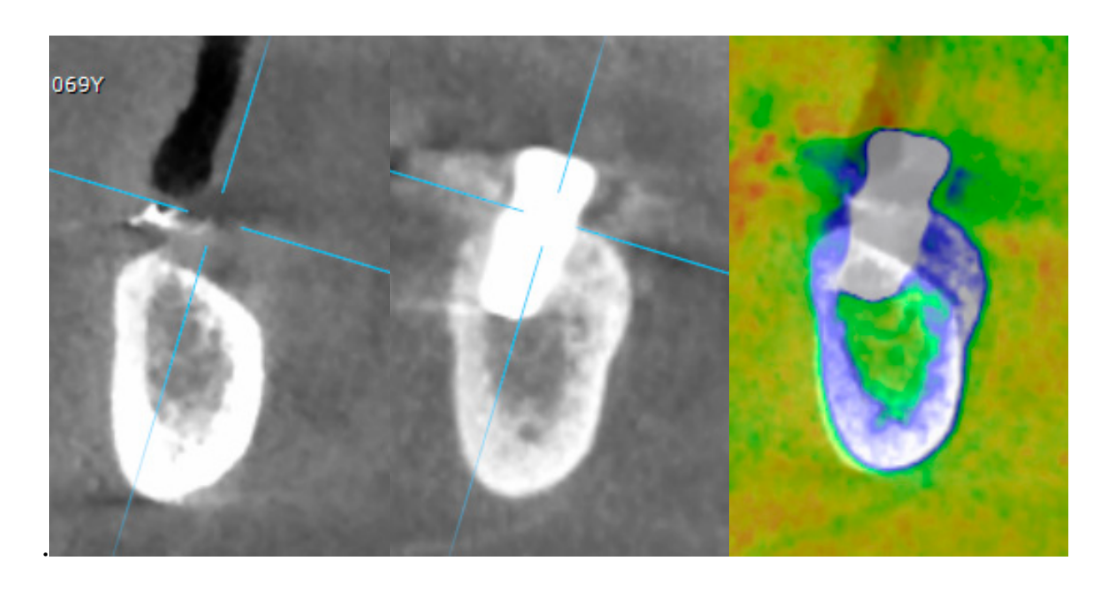
Osso autógeno foi colocado sozinho sobre a superfície exposta do implante. Em seguida, uma segunda camada composta por osso autógeno misturado com material ósseo bovino anorgânico (Bio-OSS, Geistlich Biomaterials Italia S.r.l.) em uma proporção de 1:1 foi utilizada para enxertar o defeito remanescente. O enxerto ósseo foi contornado em excesso para compensar a reabsorção final do enxerto. Finalmente, a membrana foi conectada ao conector de altura e moldada para envolver de forma segura a área do enxerto, e o capô de cicatrização foi conectado e aparafusado ao conector de altura usando o driver do capô de cobertura a 5 a 8 N·cm. Uma incisão periosteal foi feita para permitir uma adaptação passiva, sem tensão, e o fechamento do retalho. A ferida foi suturada em duas camadas com uma sutura de poliglactina 910 4-0 (Vicryl V271; Ethicon, West Somerville, NJ, EUA) (Figuras 1–3). A cobertura antibiótica foi administrada por sete dias (1 g de amoxicilina e ácido clavulânico ou 300 mg de clindamicina duas vezes ao dia) após a cirurgia. Um enxágue bucal de digluconato de clorexidina a 0,2% foi prescrito por um minuto, duas vezes ao dia, durante três semanas, e uma dieta leve foi recomendada por quatro semanas. Ibuprofeno 400 mg (ou paracetamol 1 g) deveria ser tomado em caso de dor.
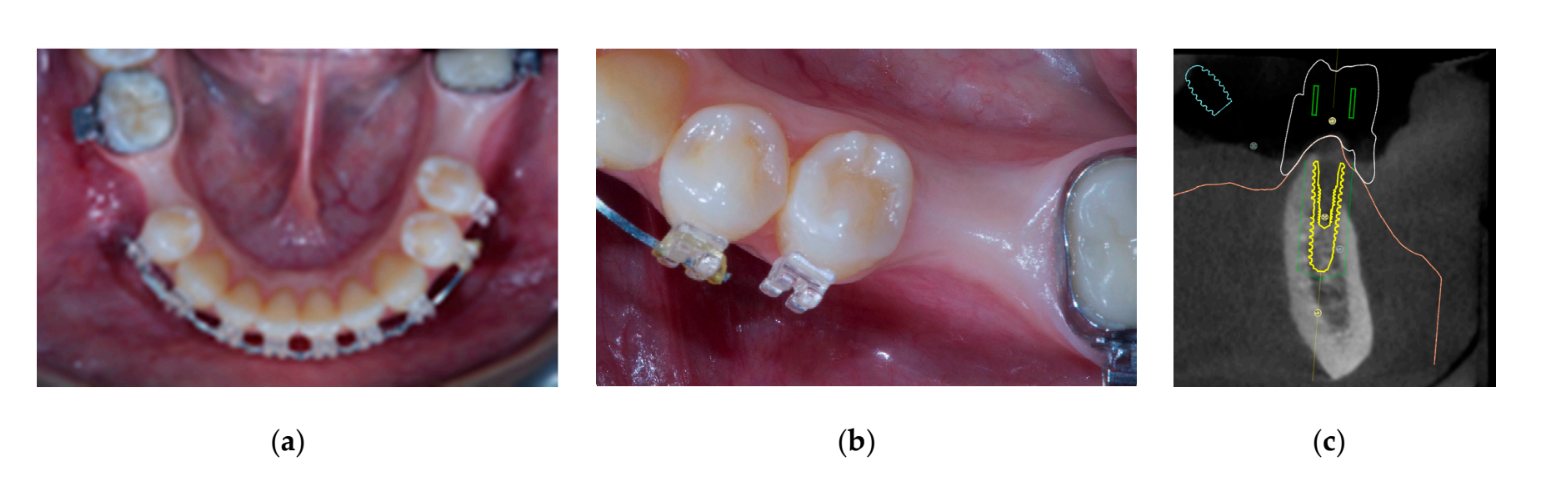
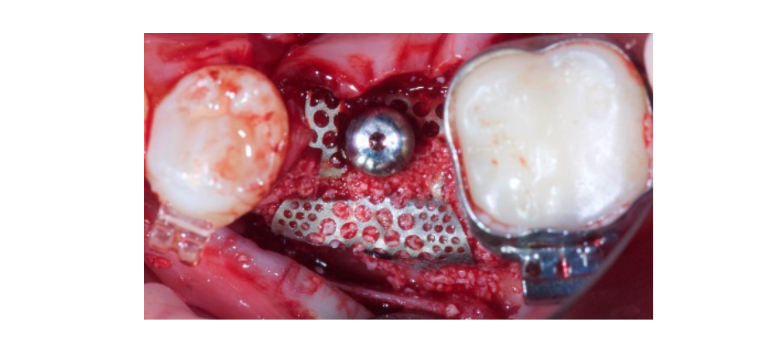
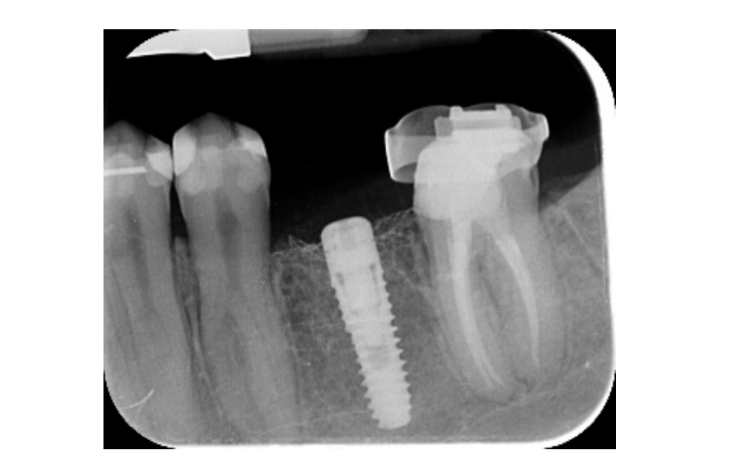
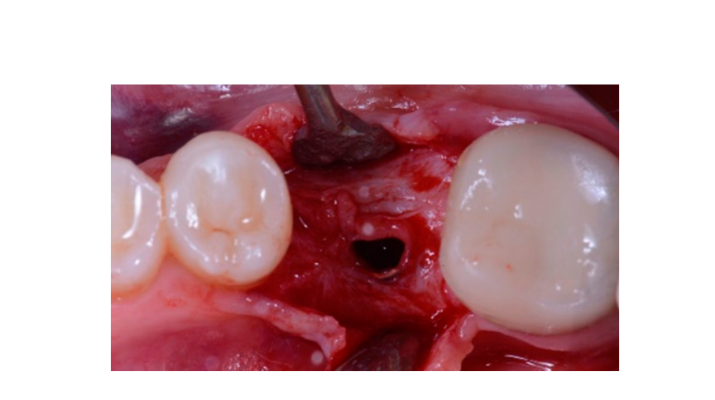
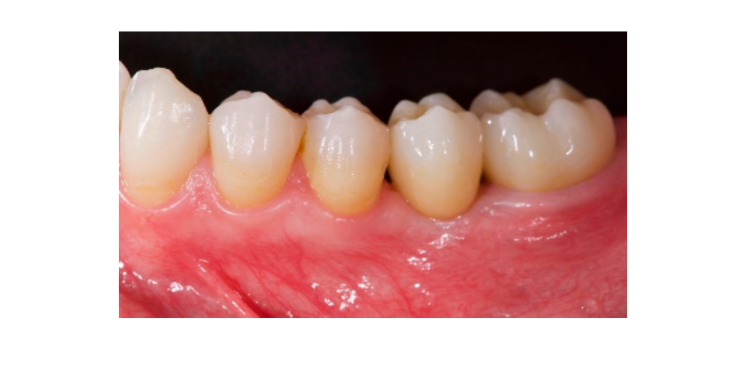
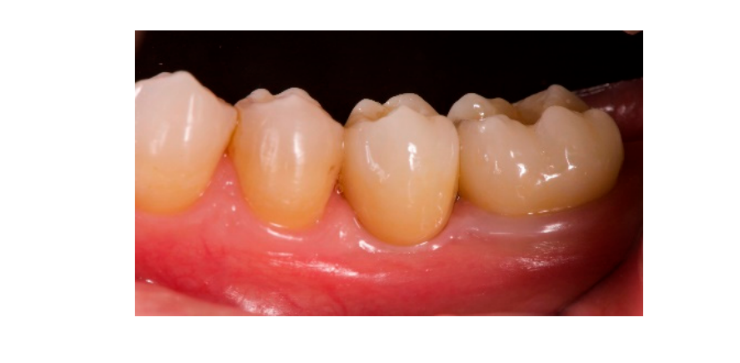
Sete a oito meses após a colocação do implante, o paciente passou por uma segunda tomografia computadorizada de feixe cônico (CBCT) para avaliar a reconstrução óssea. A tomografia CBCT foi configurada com um campo de visão de 60 mm × 80 mm; tamanho do voxel de 0,3 µm; 90 kV; 4–6,3 mA por 2,3 s, resultando em um produto de dose-área de 192,4–307,8 (mGycm2). Em seguida, um procedimento cirúrgico de segunda etapa foi realizado, garantindo a preservação do tecido queratinizado ao redor do implante dental. A malha de titânio ultra-fina foi cuidadosamente removida e um pilar de cicatrização foi parafusado no fixture (Figura 4). Uma membrana de fibrina rica em plaquetas (PRF) foi então adaptada sobre o osso reconstruído e o retalho foi puxado coronariamente e suturado. Duas semanas depois, uma restauração provisória foi fornecida. Três a quatro meses depois, uma restauração de zircônia retida por parafuso CAD/CAM foi entregue (Figuras 5 e 6). A oclusão foi ajustada para evitar contatos prematuros. Radiografias periapicais e fotografias clínicas foram tiradas. Consultas de acompanhamento foram agendadas a cada três meses após a colocação do implante (Figuras 7 e 8).
Medidas de Resultados Incluídas:
- Taxa de sobrevivência do implante: um implante foi considerado uma falha se apresentasse qualquer mobilidade, fratura do implante ou uma infecção que exigisse a remoção do implante.
- Uma restauração foi considerada falha se precisasse ser substituída por uma restauração alternativa.
- Presença de complicações biológicas (dor, inchaço, supuração, etc.) ou mecânicas (afrouxamento de parafuso ou fratura da estrutura e/ou do material de revestimento, etc.).
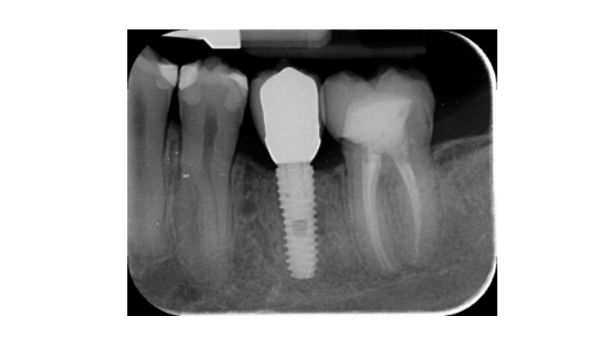
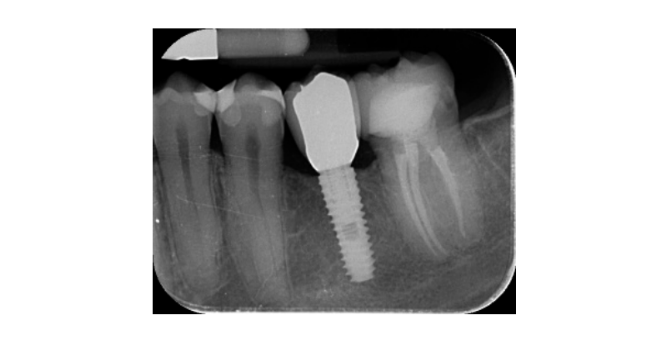
- As mudanças no nível ósseo marginal foram avaliadas por radiografias periapicais digitais (Digora Optime; Soredex, Tuusula, Finlândia) usando a técnica paralela e suportes de filme comercialmente disponíveis. Três pontos no tempo foram avaliados, na colocação do implante (linha de base), imediatamente após a inserção da restauração e um ano após a carga. As distâncias médias mesial e distal da margem mais coronária do implante e o primeiro contato osso-implante foram medidas até o mais próximo de 0,01 mm e consideradas como o nível ósseo marginal. A diferença nos níveis entre os pontos no tempo foi considerada como perda óssea marginal (MBL).
- Aumentação óssea horizontal foi avaliada nas tomografias CBCT, 1 mm abaixo da crista óssea original. Os dados volumétricos foram sobrepostos usando os dentes adjacentes como pontos de referência, e um novo conjunto gerado de dados DICOM foi armazenado como arquivos separados. Medidas foram tomadas antes e depois do tratamento, e a diferença entre essas duas medições foi considerada como aumentação óssea horizontal (Figura 9).
- As medições volumétricas do osso reconstruído foram realizadas automaticamente no conjunto mesclado de dados volumétricos CBCT, usando o módulo Fusion do software OnDemand 3D (Cybermed Inc., Seul, Coreia), de acordo com um protocolo previamente publicado [8].
- A avaliação estética foi realizada de acordo com a pontuação estética rosa (PES) nas fotos vestibulares e oclusais tiradas incluindo pelo menos um dente adjacente de cada lado. Os valores foram avaliados aos 6 e 12 meses após os exames de acompanhamento (acompanhamento de 18 meses). Sete variáveis (papila mesial, papila distal, nível de tecido mole, contorno de tecido mole, deficiência do processo alveolar, cor e textura do tecido mole) foram avaliadas com uma pontuação de 2-1-0 (2 sendo o melhor e 0 o pior) pelo mesmo dentista cego.
As taxas cirúrgicas de implante e prótese e as complicações foram avaliadas pelos mesmos clínicos que realizaram todos os casos (MT). A perda óssea marginal e a pontuação estética rosa foram avaliadas por qualquer avaliador independente que não havia participado anteriormente do estudo (MM). Uma análise descritiva foi realizada para média ± desvio padrão (DP), mediana e intervalo de confiança de 95% (IC) usando Numbers (Versão 5.2) para Mac OS High Sierra 10.X. Comparações entre os acompanhamentos foram feitas por um teste t de Student pareado usando SPSS (Versão 22.0; IBM Corporation, Armonk, NY, EUA) para Mac OS High Sierra 10.X. Todas as comparações estatísticas foram realizadas em um nível de significância de 0,05. A unidade estatística foi o implante.
Resultados
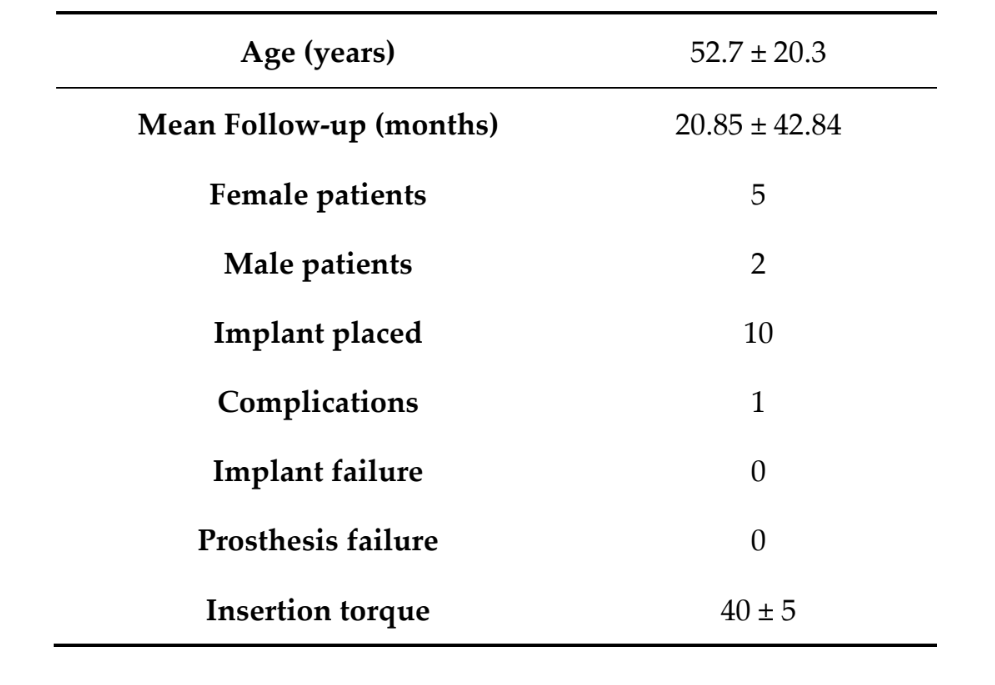
No total, sete pacientes (cinco mulheres, dois homens) com uma idade média de 52,7 ± 20,3 anos (faixa: 27–71) receberam 10 implantes TSIII auto-perfurantes e cônicos (Osstem Implant) e regeneração óssea guiada simultânea com membranas de malha de titânio ultra-finas (OssBuilder; Osstem Implant). 18 meses após a carga, nenhum paciente desistiu e nenhuma desvio do protocolo original ocorreu. O tempo médio de acompanhamento foi de 20,85 ± 42,84 meses após a colocação do implante (faixa: 18–24 meses). Todos os implantes foram inseridos com torques entre 35 e 45 N·cm usando uma abordagem guiada por template baseada em computador (Tabela 1).
Nenhum implante e nenhuma prótese falharam durante o período de acompanhamento. Uma leve exposição da membrana foi observada um mês após a colocação do implante em um paciente. Os pacientes foram instruídos a escovar cuidadosamente a membrana com uma escova de dentes macia e a aplicar spray de clorexidina duas vezes ao dia. A cicatrização completa dos tecidos moles foi observada quatro semanas depois.
Todos os implantes foram colocados ao nível do osso ou 1 mm mais profundo. A perda média de osso marginal na carga do implante foi de 0,13 ± 0,09 mm (IC 95% 0,08–0,19). Na avaliação de acompanhamento de 18 meses, a perda média de osso marginal foi de 0,28 ± 0,33 mm (IC 95% 0,07–0,50). A diferença não foi estatisticamente significativa (0,15 ± 0,31; IC 95% 0,05–0,35; P = 0,1888) (Tabela 2).

A largura média da crista alveolar horizontal foi de 3,72 ± 1,08 mm (IC 95% 3,22–4,22 mm). Na cirurgia de II estágio, a largura média do osso foi de 8,79 ± 0,98 mm (IC 95% 8,51–9,07 mm). O ganho médio de osso foi de 5,06 ± 1,13 mm (IC 95% 4,68–5,44 mm; P = 0,000). O volume médio do osso enxertado calculado usando a técnica de sobreposição foi de 0,99 ± 0,38 CC (IC 95% 0,75–1,23 CC).
A média do PES na carga do implante foi de 8,2 ± 0,8 mm (IC 95% 7,7–8,7). Na avaliação de acompanhamento de 18 meses, a média do PES foi de 12,0 ± 0,7 mm (IC 95% 11,5–12,5). A diferença foi estatisticamente significativa (3,8 ± 0,4; IC 95% 3,5–4,1; P = 0,0000) (Tabela 2).
Discussão
A presente pesquisa foi realizada para avaliar dados clínicos e radiológicos, um ano após a carga, de uma regeneração óssea guiada usando uma membrana de malha de titânio ultra-fina com colocação simultânea de implante, para fornecer um efeito de suporte (manutenção de espaço) que é necessário para permitir a reconstrução óssea de defeitos ósseos crestais. Como esta pesquisa foi projetada como um estudo de série de casos prospectivo, sua principal limitação é a falta de um grupo controle. A principal limitação do presente estudo foi o pequeno tamanho da amostra. No entanto, esta pesquisa foi projetada como um estudo de série de casos prospectivo. Essa limitação poderia ser resolvida realizando novos ensaios com tamanhos de amostra maiores, que poderiam ser calculados com base nos resultados preliminares do presente estudo. Outra limitação deste estudo, que poderia ser um fator de confusão, foi que o biotipo gengival não foi considerado. No entanto, os resultados do presente estudo estavam de acordo com relatórios publicados anteriormente. De fato, vários pesquisadores apoiaram as propriedades mecânicas ideais da malha de Ti em termos de rigidez, plasticidade e elasticidade. Além disso, a malha de Ti parece ser menos suscetível à contaminação bacteriana, em comparação com materiais reabsorvíveis. Para sublinhar esse conceito, os autores observaram apenas uma leve exposição da membrana um mês após a colocação do implante. Os pacientes foram instruídos a escovar cuidadosamente a membrana com uma escova de dentes macia e a aplicar spray de clorexidina duas vezes ao dia. A cicatrização completa dos tecidos moles foi observada quatro semanas depois. Esta complicação menor sugere a eficácia desta malha de titânio. Além disso, neste estudo prospectivo, nenhum implante e nenhuma prótese falharam durante o período de acompanhamento. Graças a esses dados, é razoável considerar este procedimento seguro e fácil para o clínico. Várias características das membranas de barreira são necessárias para uma reconstrução óssea guiada bem-sucedida, como manejabilidade clínica, biocompatibilidade, capacidade de criação de espaço, exclusão celular e integração tecidual. As malhas de Ti são membranas não reabsorvíveis, e sua porosidade pode ser variada para alcançar compatibilidade tecidual. No presente estudo, foi utilizada uma membrana de titânio puro grau 2 ultra-fina. A espessura da malha de titânio era de 100 µm, enquanto a porosidade variava de 0,6 a 1 mm de diâmetro. Os poros de 1 mm de diâmetro podem fornecer um suprimento sanguíneo ideal e difusão de fatores de crescimento, necessários para a promoção da cicatrização e regeneração óssea. No entanto, poros de 0,6 mm de diâmetro podem prevenir o deslocamento ou migração do material de enxerto ósseo, permitindo ao mesmo tempo a difusão do suprimento sanguíneo. Além disso, essas membranas apresentaram algumas perfurações laterais que deveriam ser capazes de manter alta resistência mecânica, ao mesmo tempo permitindo flexibilidade para moldagem e modificação.
No entanto, a exposição da membrana e a infecção são relativamente comuns. Em contraste com a membrana de PTFE, que é relativamente grossa, aproximadamente 200 µm, e suscetível ao aprisionamento bacteriano devido à sua estrutura porosa, o titânio pode ser fabricado em uma forma mais fina.
Recentemente, padrões de superfície ultrafinos associados a poros, canais e outras características em bioscaffolds são conhecidos por influenciar a migração, proliferação e diferenciação celular. Assim, a tecnologia de processamento a laser é favorável para criar uma variedade de padrões de superfície ultrafinos.
Para obter uma boa e previsível regeneração óssea, o enxerto ósseo deve incluir três características:
(1) Células osteoblásticas ou células-tronco mesenquimatosas; (2) Fatores de crescimento, para garantir o progresso da regeneração; e (3) Um 'esqueleto' capaz de oferecer suporte mecânico para a adesão e proliferação celular.
Os autores hipotetizaram que essa estrutura ultrafina, utilizada neste estudo prospectivo, permite a minimização do crescimento de tecidos moles nas microperfurações e mantém a permeabilidade de nutrientes ou fluido tecidual através da membrana, o que promoveria a adesão, migração e proliferação de células derivadas da medula óssea, resultando em mais regeneração óssea.
Durante a última década, estudos de longo prazo avaliaram e sublinharam que a GBR é uma técnica bem-sucedida e previsível para o clínico obter aumento vertical e horizontal da crista. A GBR pode ser alcançada com duas abordagens diferentes: aplicação de uma membrana de politetrafluoretileno (PTFE) reforçada com titânio (ou seja, uma membrana não reabsorvível) e uma malha de titânio ultrafina ou uma membrana de colágeno (ou seja, uma membrana reabsorvível). Os implantes foram colocados utilizando uma abordagem assistida por template guiado por computador, ao nível do osso ou 1 mm mais profundo, de acordo com o protocolo de perfuração sugerido pelo fabricante. Na nossa opinião, essa abordagem guiada permite uma melhor instalação do implante orientada pela prótese e permite a regeneração óssea de acordo com a prótese necessária.
Os resultados do presente estudo estão de acordo com a literatura recente publicada sobre implantes colocados após ou durante o procedimento de GBR.
Conclusões
Com a limitação do presente estudo prospectivo, a reconstrução óssea guiada utilizando uma membrana de malha de titânio ultrafina com colocação simultânea de implantes, para fornecer a manutenção de espaço necessária para o aumento ósseo de defeitos ósseos alveolares, parece proporcionar sucesso do implante/prótese. Mais pesquisas com um tamanho de amostra maior e acompanhamento mais longo são necessárias para confirmar esses resultados preliminares.
Marco Tallarico, Francesco Mattia Ceruso, Leonardo Muzzi, Silvio Mario Meloni, Yong-Jin Kim, Marco Gargari e Matteo Martinolli
Referências
- Atwood, D.A. Redução de cristas residuais: uma entidade de doença oral maior. J. Prosthet. Dent. 1971, 26, 266–279.
- Chiapasco, M.; Casentini, P.; Zaniboni, M. Procedimentos de aumento ósseo na odontologia de implantes. Int. J. Oral Implant. 2009, 24, 237–259.
- Rakhmatia, Y.D.; Jinno, Y.; Furuhashi, A.; Koyano, K.; Ayukawa, Y. Análise de microtomografia computadorizada da cicatrização óssea em estágio inicial usando malha de titânio micro-porosa para regeneração óssea guiada: experimento preliminar em um modelo canino. Odontology 2017, 8, 25–417.
- Meloni, S.M.; Jovanovic, S.A.; Pisano, M.; De Riu, G.; Baldoni, E.; Tallarico, M. Regeneração óssea guiada horizontal em uma única etapa com osso autólogo, osso bovino anorgânico e membranas de colágeno: Acompanhamento de um estudo prospectivo 30 meses após a carga. Eur. J. Oral Implantol. 2018, 11, 89–95.
- Becker, W.; Becker, B.; Mellonig, J. Um estudo multicêntrico prospectivo avaliando a regeneração periodontal para invasões de furca de classe II e defeitos infrabone após tratamento com uma membrana de barreira bioabsorvível: resultados de 1 ano. J. Periodontol. 1996, 67, 641–649.
- Zitzmann, N.U.; Naef, R.; Scharer, P. Membranas reabsorvíveis versus não reabsorvíveis em combinação com Bio-Oss para regeneração óssea guiada. Int. J. Oral Maxillofac. Implants 1997, 12, 844–852.
- Merli, M.; Moscatelli, M.; Mariotti, G.; Rotundo, R.; Bernardelli, F.; Nieri, M. Variação do nível ósseo após aumento vertical de crista: barreiras reabsorvíveis versus barreiras reforçadas com titânio. Um ensaio clínico randomizado duplo-cego de 6 anos. Int. J. Oral Maxillofac. Implants 2014, 29, 905–913.
- Meloni, S.M.; Jovanovic, S.A.; Urban, I.; Canullo, L.; Pisano, M.; Tallarico, M. Aumento de crista horizontal usando GBR com uma membrana de colágeno nativo e proporção de 1:1 de xenógeno particulado e osso autólogo: Um estudo clínico prospectivo de 1 ano. Clin. Implant Dent. Relat. Res. 2017, 19, 38–45.
- Sottosanti, J.S. Sulfato de cálcio: uma adição valiosa ao complexo de regeneração de implante/osso. Dent. Implant. Updat. 1997, 8, 25–29.
- Roccuzzo, M.; Ramieri, G.; Spada, M.C.; Bianchi, S.D.; Berrone, S. Aumento vertical da crista alveolar por meio de uma malha de titânio e enxertos ósseos autógenos. Clin. Oral Implant. 2004, 15, 73–81.
- Rakhmatia, Y.D.; Ayukawa, Y.; Furuhashi, A.; Koyano, K. Membranas de barreira atuais: malha de titânio e outras membranas para regeneração óssea guiada em aplicações dentais. J. Prosthodont. 2013, 57, 3–14.
- Tallarico, M.; Martinolli, M.; Kim, Y.; Cocchi, F.; Meloni, S.M.; Alushi, A.; Xhanari, E. Precisão do posicionamento de implantes assistido por computador usando dois modelos cirúrgicos diferentes projetados com ou sem mangas metálicas: Um ensaio controlado randomizado. Dent. J. 2019, 7, 41.
- Tallarico, M.; Kim, Y.J.; Cocchi, F.; Martinolli, M.; Meloni, S.M. Precisão de modelos projetados com novas mangas para inserção de implantes dentários: Um ensaio clínico multicêntrico prospectivo. Clin. Implant Dent. Relat. Res. 2019, 21, 108–113.
- Fürhauser, R.; Florescu, D.; Benesch, T.; Haas, R.; Mailath, G.; Watzek, G. Avaliação de tecidos moles ao redor de coroas de implantes unitários: o escore estético rosa. Clin. Oral Implant. 2005, 16, 639–644.
- Ciocca, L.; Lizio, G.; Baldissara, P.; Sambuco, A.; Scotti, R.; Corinadesi, G. Aumento ósseo guiado por CAD-CAM prostético de mandíbulas atróficas usando malha de titânio personalizada: Resultados preliminares de um estudo prospectivo aberto. J. Oral Implant. 2018, 44, 131–137.
- Schopper, C.H.; Goriwoda, W.; Moser, D. Resultados a longo prazo após regeneração óssea guiada com membranas de titânio reabsorvíveis e microporosas. J. Oral Maxillofac. Surg. Clin. North Am. 2001, 13, 449–458.
- Scantlebury, T.V. 1982-1992: uma década de desenvolvimento tecnológico para regeneração tecidual guiada. J. Periodontol. 1993, 64, 1129–1137.
- A Fugazzotto, P. Taxas de sucesso e falha de implantes osseointegrados em função em osso regenerado por 72 a 133 meses. Int. J. Oral Implant. 2005, 20, 77–83.
- Kim, Y.-K.; Yun, P.-Y.; Kim, S.-G.; Oh, D.S. Comparação em microscopia eletrônica de varredura in vitro da superfície interna de membranas não reabsorvíveis expostas e não expostas. Oral Surgery, Oral Med. Oral Pathol. Oral Radiol. Endodontology 2009, 107, e5–e11.
- Watzinger, F.; Luksch, J.; Millesi, W.; Schopper, C.; Neugebauer, J.; Moser, D.; Ewers, R. Regeneração óssea guiada com membranas de titânio: um estudo clínico. Br. J. Oral Surg. 2000, 38, 312–315.
- Selvig, K.A.; Kersten, B.G.; Chamberlain, A.D.H.; Wikesjö, U.M.E.; Nilvúus, R.E. Cirurgia regenerativa de defeitos periodontais intrabone usando membranas de barreira de ePTFE: Avaliação em microscopia eletrônica de varredura de membranas recuperadas versus cicatrização clínica. J. Periodontol. 1992, 63, 974–978.
- Hasegawa, H.; Masui, S.; Ishihata, H.; Kaneko, T.; Ishida, D.; Endo, M.; Kanno, C.; Yamazaki, M.; Kitabatake, T.; Utsunomiya, S.; et al. Avaliação de uma membrana de titânio puro microperfurada recém-projetada para regeneração óssea guiada. Int. J. Oral Maxillofac. Implants 2019, 34, 411–422.
- Roberts, E.W.; E Simmons, K.; Garetto, L.P.; A DeCastro, R. Fisiologia e metabolismo ósseo na implantologia dentária: fatores de risco para osteoporose e outras doenças ósseas metabólicas. Implant. Dent. 1992, 1, 11–21.
- Wessing, B.; Urban, I.; Montero, E.; Zechner, W.; Hof, M.; Chamorro, J.A.; Martin N.A.; Polizzi, G.; Meloni, S.; Sanz, M. Um ensaio clínico randomizado multicêntrico usando uma nova membrana de colágeno não cruzada reabsorvível para regeneração óssea guiada em locais de implantes unitários deiscente: resultados intermediários de um procedimento de aumento ósseo. Clin. Oral Implants Res. 2017, 28, e218–e226, doi: 10.1111/clr.12995.
- Urban, I.; Wessing, B.; Alández, N.; Meloni, S.; González-Martin, O.; Polizzi, G.; Sanz-Sanchez, I.; Montero, E.; Zechner, W. Um ensaio clínico randomizado multicêntrico usando uma nova membrana de colágeno para regeneração óssea guiada em locais de implantes unitários deiscente: Resultado na entrega protética e no acompanhamento de 1 ano. Clin. Oral Implants Res. 2019, doi: 10.1111/clr.13426.