Correção da Deiscência Óssea Bucal Peri-Implantar Após Técnica de Camada Aumentada Subperióstica com Xenógrifo em Bloco ou Particulado: Um Estudo Retrospectivo
Tradução automática
O artigo original está escrito em EN language (link para lê-lo) .
Resumo
Objetivo: Avaliar a eficácia da técnica de Camada Aumentada Sub-periosteal Peri-implante (SPAL) realizada com mineral de osso bovino desprotéinizado (DBBM), entregue como particulado (pDBBM) ou bloco (bDBBM), na correção de uma deiscência óssea peri-implante (PIBD). Implantes com uma placa óssea bucal peri-implante (PBBP) espessa (≥ 2 mm) na colocação também foram examinados.
Material e Métodos: Pacientes com PIBD ≥ 1 mm, tratados com SPAL com pDBBM (SPALparticulado) ou bDBBM (SPALbloco), e pacientes com um implante mostrando uma PBBP ≥ 2 mm na inserção (CONTROLE) foram incluídos. A reentrada foi realizada em 6 meses (grupos SPAL) ou 3 meses (CONTROLE). A taxa de pacientes apresentando nenhuma PIBD na reentrada foi o resultado primário. A altura da deiscência óssea (BDH) e largura (BDW), espessura dos tecidos bucais (BTT) e nível ósseo marginal (MBL) foram resultados secundários.
Resultados: Trinta e nove implantes em 39 pacientes (14 em SPALparticulado, 14 em SPALbloco e 11 em CONTROLE) foram analisados. Nenhuma PIBD foi encontrada em SPALparticulado, enquanto em SPALbloco uma PIBD estava presente. Dois pacientes no CONTROLE apresentaram uma PIBD. Uma redução tanto na BDH quanto na BDW foi observada em ambos SPALparticulado (2.7 ± 1.6 mm para BDH e 3.9 ± 0.2 mm para BDW) e SPALbloco (2.5 ± 1.8 mm para BDH e 3.8 ± 1.1 mm para BDW). SPALbloco mostrou uma BTT maior do que SPALparticulado na reentrada (3.6 ± 1.3 mm para SPALbloco e 2.6 ± 0.6 mm para SPALparticulado, p = 0.0160). Todos os grupos mostraram MBL semelhante.
Introdução
A colocação de implantes orientada por prótese em uma dimensão óssea horizontal reduzida frequentemente resulta em uma deiscência óssea peri-implantar (PIBD) (Bressan et al. 2017; Pramstraller et al. 2018).
Pequenos defeitos de deiscência óssea deixados para cicatrização espontânea revelaram mais perda óssea vertical na face bucal após a inserção do implante e também mais perda óssea marginal em comparação com locais tratados com GBR (Jung et al. 2017; Monje et al. 2023). Embora implantes com pequenas deiscências ósseas bucais não contidas apresentassem altas taxas de sobrevivência e tecidos peri-implantares saudáveis em um acompanhamento de 7,5 anos (Waller et al. 2020), a presença de uma PIBD evidente estava associada a uma maior incidência de mucosite e peri-implantite, bem como a uma progressão mais rápida da peri-implantite em comparação com implantes completamente rodeados por osso (Schwarz, Sahm e Becker 2012; Monje et al. 2019). Apesar do valor prognóstico de uma PIBD sobre a saúde dos tecidos peri-implantares a longo prazo ainda ser controverso, a correção de uma deiscência óssea bucal na colocação do implante foi recentemente recomendada para favorecer a estabilidade e as condições saudáveis dos tecidos peri-implantares ao longo do tempo (Herrera et al. 2023; Monje et al. 2023; Song et al. 2024).
Para tratar uma PIBD, foram propostas tanto procedimentos de aumento ósseo quanto de tecido mole. Ambos os tratamentos mostraram fornecer resultados clínicos e radiográficos estáveis a médio e longo prazo (Jensen et al. 2023; Monje et al. 2023). Entre os diferentes procedimentos de aumento ósseo lateral na colocação simultânea de implantes, a Regeneração Óssea Guiada (GBR) e a técnica de Camada Aumentada Sub-periosteal Peri-implante (SPAL, Trombelli et al. 2018) foram associadas a uma alta probabilidade de corrigir completamente uma PIBD (Severi et al. 2022). Em particular, a SPAL é baseada no uso do periosto do paciente como uma membrana de barreira para conter um enxerto que atua como um andaime "formador de espaço". Quando realizada em combinação com um enxerto particulado de mineral ósseo bovino desproteinizado (DBBM), a SPAL mostrou-se eficaz em corrigir completamente até 90,9% das PIBDs (Trombelli et al. 2019, 2020). Um estudo retrospectivo recente comparou as condições de tecido duro e mole peri-implante em implantes apresentando uma PIBD tratada com SPAL ou uma PBBP espessa (≥ 2 mm) na colocação do implante (Trombelli et al. 2020). Embora condições saudáveis semelhantes dos tecidos peri-implante tenham sido encontradas em ambos os grupos, uma posição mais apical do nível ósseo marginal radiográfico (MBL) foi encontrada no grupo SPAL, sugerindo um padrão de remodelação diferente do enxerto em comparação com o osso nativo (Trombelli et al. 2020). Essas descobertas podem questionar a relevância das características físico-químicas do enxerto em relação à estabilidade do resultado reconstrutivo após a SPAL. Nesse sentido, um relato anedótico sugeriu que o uso de um bloco de DBBM (bDBBM) pode ser uma alternativa bem-sucedida em combinação com a SPAL (Trombelli et al. 2022).
Portanto, o objetivo do presente estudo retrospectivo foi avaliar a eficácia do SPAL realizado em combinação com pDBBM ou bDBBM na correção de um PIBD. Além disso, as mudanças no tecido duro peri-implantar ocorrendo desde a colocação do implante até a reentrada para a descoberta do implante foram analisadas. Um grupo de controle composto por implantes mostrando uma PBBP espessa (≥ 2 mm) na colocação do implante também foi examinado.
Materiais e Métodos
2.1 Aspectos Éticos
O presente estudo retrospectivo foi aprovado pelo Comitê de Ética da Área Vasta Emilia Centro, Itália (protocolo n° 523/2024/Oss/UniFe, data de aprovação 16.10.2024). Cada paciente forneceu um consentimento informado por escrito antes do tratamento cirúrgico.
Todos os procedimentos clínicos foram realizados de acordo com a Declaração de Helsinque e as Diretrizes de Boas Práticas Clínicas (GCPs).
2.2 População do Estudo
Os prontuários dos pacientes submetidos à reabilitação protética suportada por implantes no período de maio de 2020 a setembro de 2021 no Centro de Pesquisa para o Estudo de Doenças Periodontais e Peri-implantares, Universidade de Ferrara, e em um consultório odontológico privado localizado em Ferrara foram analisados para determinar a elegibilidade dos pacientes para o estudo. O presente estudo retrospectivo foi realizado seguindo as diretrizes/lista de verificação da declaração STROBE para estudos transversais.
Com base nas condições da placa óssea bucal no momento da colocação do implante e manejo cirúrgico, os pacientes foram categorizados em 2 grupos:
- Pacientes com pelo menos um implante apresentando um PIBD ≥ 1 mm, tratados com SPAL em combinação com pDBBM (grupo SPALparticulado);
- Pacientes com pelo menos um implante apresentando um PIBD ≥ 1 mm, tratados com SPAL em combinação com bDBBM (grupo SPALbloco).
Os grupos SPAL foram compostos por pacientes tratados consecutivamente, onde medições clínicas e radiográficas pertinentes puderam ser recuperadas para análise de dados. Se dois ou mais implantes no mesmo paciente fossem elegíveis para o estudo, apenas o implante apresentando o PIBD com a maior deiscência óssea foi selecionado para análise. Além disso, pacientes com pelo menos um implante apresentando uma espessura residual de PBBP ≥ 2 mm após a inserção do implante foram considerados como grupo controle (grupo CONTROLE).
Todos os implantes selecionados tiveram que ser colocados em uma crista óssea cicatrizada (implantes tipo 4C, Gallucci et al. 2018) e tiveram que mostrar estabilidade primária, conforme avaliado pelo torque de inserção. Fumantes pesados (consumo de cigarros > 10 cigarros/dia) e pacientes com diabetes mellitus no momento da cirurgia foram excluídos do estudo.
2.3 Procedimentos Clínicos
2.3.1 Procedimentos Pré-Operatórios
Antes da colocação do implante, todos os pacientes haviam passado por terapia ativa para tratar lesões cariosas e doenças periodontais, e estavam inscritos em uma manutenção profissional com frequência de retornos agendados de acordo com a ferramenta de avaliação PerioRisk (Trombelli et al. 2009, 2017; Farina et al. 2021).
Todos os procedimentos cirúrgicos foram realizados por dois operadores treinados (L.T., M.S.). Os pacientes receberam 2 g de amoxicilina + ácido clavulânico (Augmentin, GlaxoSmithKline, Verona, Itália) 1 h antes da cirurgia. A anestesia local foi obtida utilizando articaína com 1:100.000 de epinefrina administrada por infiltração local.
2.3.2 Procedimentos Cirúrgicos
2.3.2.1 Grupos SPAL.
Nos grupos SPALparticulado e SPAL-bloco, o acesso cirúrgico à crista óssea foi realizado de acordo com um procedimento previamente descrito (Trombelli et al. 2018). Resumidamente, uma camada mucosa foi levantada na face bucal por dissecção de espessura parcial com uma lâmina 15C (Figuras 1a e 2a). Em seguida, a camada periosteal foi elevada do osso com um elevador periosteal (PTROM, Hu-Friedy, Chicago, Illinois), bem como facas de tunelamento (KPAX, TKN1X e TKN2X, Hu Friedy, Chicago, Illinois) com bordas afiadas anguladas variadas, criando um bolso sub-periosteal que poderia acomodar um enxerto (Figuras 1b e 2b). Um retalho de espessura total foi elevado na face oral (lingual/palatina). As fibras do músculo milo-hióideo foram destacadas do retalho lingual usando um instrumento rombo para permitir o avanço coronal. Perfurações corticais foram realizadas com uma broca cilíndrica de carboneto calibrada para aumentar o suprimento sanguíneo na área cirúrgica (Majzoub et al. 1999; Acar et al. 2016).
Implantes em nível de tecido (SPI Element; Thommen Medical, Grenchen, Suíça) foram colocados com a margem coronal do colar polido de 1 mm ao nível da crista óssea (Figuras 1c e 2c).
Um xenógeno derivado de bovino, fornecido como particulado (grânulos de Bio-Oss spongiosa, tamanho de partícula 0,25–1,0 mm; Geistlich Pharma, AG, Wolhusen, Suíça) (Trombelli et al. 2018) ou bloco (bloco de Bio-Oss; Geistlich Pharma, AG, Wolhusen, Suíça) (Trombelli et al. 2022), foi utilizado para preencher o espaço criado cirurgicamente entre a camada periosteal e a superfície exposta do implante. O bloco foi fragmentado em pedaços menores por meio de uma lâmina 15C ou broca de diamante para ser adaptado à extensão do espaço sub-periosteal e alcançar o recontorno desejado da placa bucal. O enxerto foi realizado para corrigir completamente o PIBD até a crista óssea. Em todos os casos, o enxerto sub-periosteal forneceu pelo menos 2 mm de espessura na parte polida do colar do implante.
A porção coronal da camada periosteal foi então fixada ao retalho oral por meio de suturas internas de colchão reabsorvíveis (Vicryl 6/0, Ethicon, Somerville NJ, EUA) (Figuras 1d e 2d). Subsequentemente, a camada mucosa foi avançada coronariamente e suturada ao retalho oral por suturas internas de colchão horizontais e suturas interrompidas para proporcionar uma cicatrização submersa tanto para o enxerto quanto para o implante (Figuras 1e–2e).
Após 6 meses, foi realizada uma reentrada cirúrgica para a exposição do implante, e um retalho bucal de espessura parcial foi dissecado para posicionar o pilar de cicatrização. Para avaliar a presença/ausência de PIBD residual, a presença de tecido duro ao redor da superfície do implante foi avaliada usando uma sonda UNC-15. Se não houve penetração da sonda além do colar do implante polido, o implante foi categorizado como “deiscência completamente corrigida”.
Para fornecer dimensões adequadas da mucosa peri-implantar queratinizada (KT), foi realizada uma posição apical do retalho (APF) ou um enxerto gengival livre (FGG) (Trombelli et al. 2019) (Figuras 1f,g e 2f). A escolha de realizar um APF ou um FGG foi baseada na necessidade de garantir uma altura de KT de pelo menos 2 mm em ambos os aspectos bucal e lingual do implante.
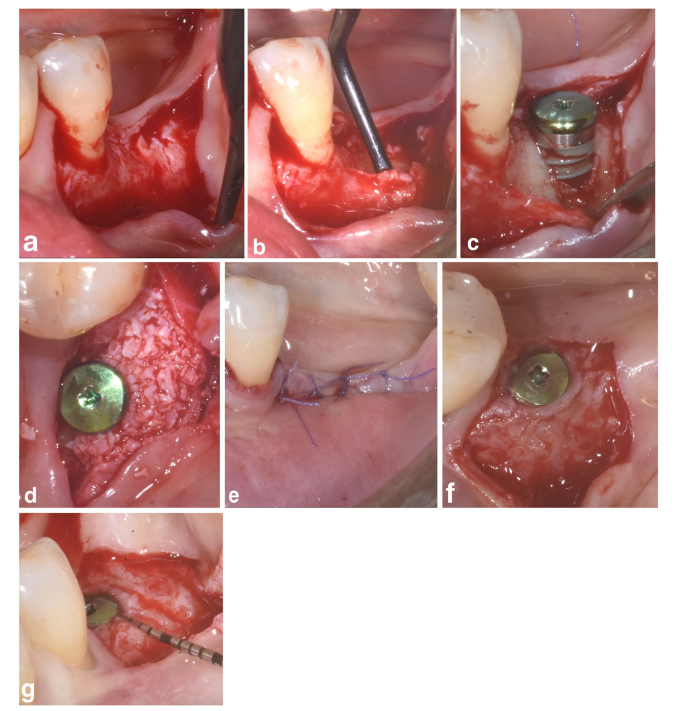
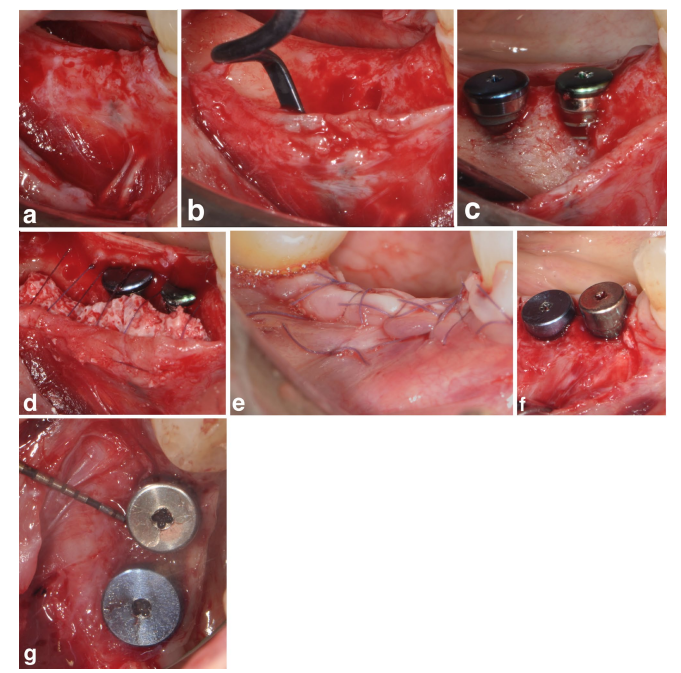
2.3.2.2 Grupo Controle.
Um retalho bucal e lingual/palatino de espessura total foi levantado para expor a crista óssea. O local do implante foi preparado de acordo com as instruções do fabricante e implantes de nível tecidual (SPI Element; Thommen Medical, Grenchen, Suíça) foram inseridos com a margem coronal do colar polido de 1 mm ao nível da crista óssea. Nenhum procedimento de aumento ósseo foi realizado. Em todos os casos, o retalho foi suturado usando suturas internas em colchão e suturas interrompidas (Vicryl 5/0, Ethicon, Somerville NJ, EUA) para proporcionar uma cicatrização submersa.
Após 3 meses, uma reentrada cirúrgica para descoberta do implante foi realizada, e um retalho bucal de espessura total foi elevado para parafusar o pilar de cicatrização. O retalho foi então aparado e adaptado ao pilar de cicatrização para proporcionar dimensões adequadas de mucosa queratinizada peri-implantar.
2.3.2.3 Procedimentos Pós-Operatórios.
Um medicamento anti-inflamatório de resgate (ou seja, comprimidos de ibuprofeno 600 mg) foi prescrito imediatamente após a cirurgia, e depois pro re nata nos dias pós-operatórios seguintes. Os pacientes foram instruídos a não usar próteses removíveis para evitar compressão no local cirúrgico por pelo menos 4 semanas, e a não mastigar ou escovar na área tratada por aproximadamente 2 semanas. O uso domiciliar de uma solução de clorexidina a 0,12% (Dentosan, Recor-dati, Milão, Itália) foi prescrito para controle químico da placa (bochecho de 1 minuto duas vezes ao dia por 3 semanas). As suturas foram removidas 2 semanas após a cirurgia.
2.4 Parâmetros do Estudo
2.4.1 Medições Clínicas
Para avaliar o efeito do tratamento na PIBD, as seguintes medições clínicas foram recuperadas dos prontuários clínicos:
- Altura da deiscência óssea (BDH): medida no aspecto médio-bucal do implante como a distância entre a margem apical do colar polido do implante e o primeiro contato osso-implante;
- Largura da deiscência óssea (BDW): medida no aspecto bucal do implante como a porção exposta mais larga da superfície rugosa do implante.
Em todos os grupos, BDH e BDW foram avaliados imediatamente após a colocação do implante e na reentrada para a exposição do implante.
Além disso, a espessura dos tecidos bucais (BTT) foi medida como a distância entre o contorno bucal do colar polido e o aspecto externo da área enxertada (grupos SPAL) ou da crista óssea nativa (grupo CONTROLE) no aspecto médio-bucal do implante. A BTT basal foi registrada:
- Imediatamente após a colocação do implante para o grupo CONTROLE;
- Imediatamente após o enxerto para ambos os grupos SPAL; BTT foi registrado novamente na reentrada cirúrgica para todos os grupos.
Todas as medições foram realizadas usando uma sonda periodontal UNC-15 e arredondadas para o milímetro mais próximo.
2.4.2 Medições Radiográficas
Radiografias periapicais, tiradas com a técnica de cone longo paralelo imediatamente após a cirurgia e na reentrada para todos os grupos, foram digitalizadas e analisadas usando um software especificamente projetado (NIS elements v4.2; Nikon Instruments, Campi Bisenzio, Firenze, Itália). O nível de osso marginal (MBL) foi medido como a distância (aproximada para o 0,1 mm mais próximo) entre a margem apical mais baixa do colar do implante polido e a crista óssea no aspecto mesial (mMBL) e distal (dMBL) de cada implante usando uma ampliação de 10×–15×. O MBL foi registrado como negativo ou positivo quando a margem apical do colar polido estava localizada apicalmente ou coronalmente à crista óssea, respectivamente.
Uma marca de referência de 1 mm de altura presente na radiografia digital foi utilizada para calibração.
Dois examinadores (C.F. e M.S.) realizaram as medições radiográficas. Os examinadores participaram de uma sessão de calibração em uma amostra de radiografias obtidas de pacientes não selecionados para o presente estudo. A sessão de calibração consistiu em duas sessões de medições de MBL, realizadas com um intervalo de 7 dias, e permitiu alcançar um excelente acordo inter- e intraexaminador (k-score 0.87).
Análise Estatística
A taxa de pacientes apresentando a superfície rugosa do implante coberta até a parte apical do colar polido (ou seja, sem PIBD) na reentrada foi considerada como o resultado primário. Valores e mudanças em BDH, BDW, BTT e MBL foram variáveis de resultado secundário.
O tamanho da amostra foi calculado usando dados derivados de um estudo anterior (Benic et al. 2019) onde a taxa de pacientes apresentando a superfície rugosa do implante coberta até o ombro do implante na reentrada foi de 91,7% nos grupos de bloco de DBBM e 25,0% no grupo de partículas de DBBM, respectivamente. O teste Z estimou que pelo menos 11 pacientes para cada um dos dois grupos independentes de SPAL eram necessários para alcançar 95% de poder estatístico com um erro alfa de 0,05.
O paciente foi considerado a unidade estatística. Os dados foram descritos usando média, desvio padrão, mediana, intervalo interquartil (IR) e valores mínimo-máximo para variáveis quantitativas, e proporções percentuais para variáveis categóricas.
As comparações intra-grupo para variáveis contínuas/ordinais foram realizadas usando o teste de postos sinalizados de Wilcoxon para dados pareados. As comparações inter-grupo para variáveis contínuas/ordinais foram realizadas usando ANOVA de Kruskal-Wallis. Em caso de significância no teste de Kruskal-Wallis, comparações múltiplas (post hoc) das médias de postos foram computadas; valores z normais foram computados para cada comparação, assim como probabilidades post hoc (corrigidas pelo número de comparações) para um teste de significância bilateral. As comparações inter-grupo para variáveis binárias foram realizadas usando testes de qui-quadrado de Máxima Verossimilhança com correção de Yates. A mudança nas variáveis de resultado secundário foi avaliada estatisticamente usando Modelos Lineares Generalizados (GLZ) ajustados para os confundidores significativos, seguidos de ANOVA para medidas repetidas para comparações inter-grupo e com o teste HSD de N desigual post hoc.
Resultados
4.1 População do Estudo
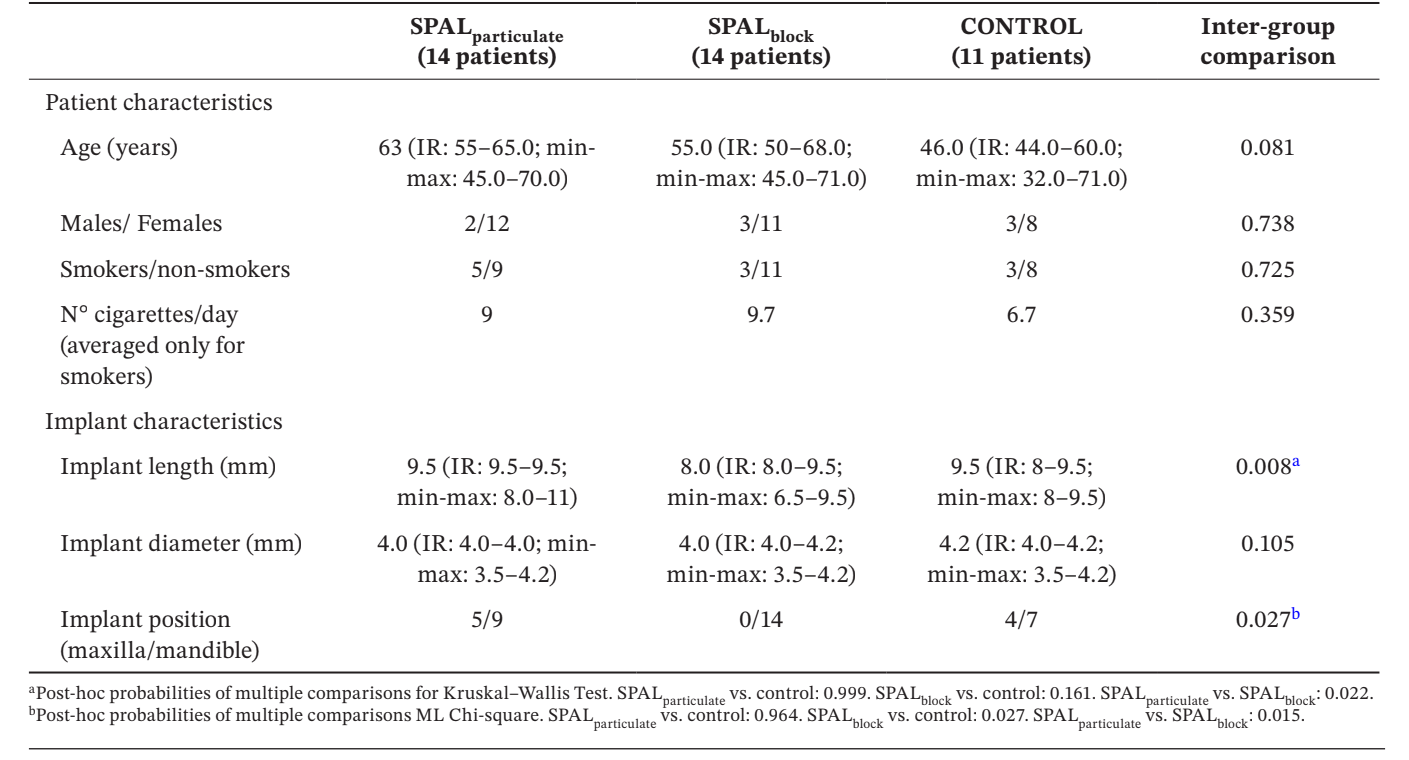
Trinta e nove implantes em 39 pacientes (14 no grupo SPALparticulado, 14 no grupo SPALbloco e 11 no grupo CONTROLE) foram selecionados para análise (Tabela 1). Nenhuma diferença em idade, gênero e status de tabagismo foi observada entre os grupos, sendo a vasta maioria dos pacientes não fumantes. Nos grupos SPALparticulado e CONTROLE, um terço dos implantes estava localizado na maxila, enquanto todos os implantes estavam localizados na mandíbula no grupo SPALbloco. Essa diferença foi estatisticamente significativa (p = 0,027). Os implantes colocados no grupo SPALbloco eram significativamente mais curtos do que aqueles colocados nos grupos SPALparticulado e CONTROLE (p = 0,008).
4.1.1 Cicatrização Pós-Operatória
Em ambos os grupos SPALparticulado e CONTROLE, a cicatrização inicial foi sem complicações em todos os pacientes.
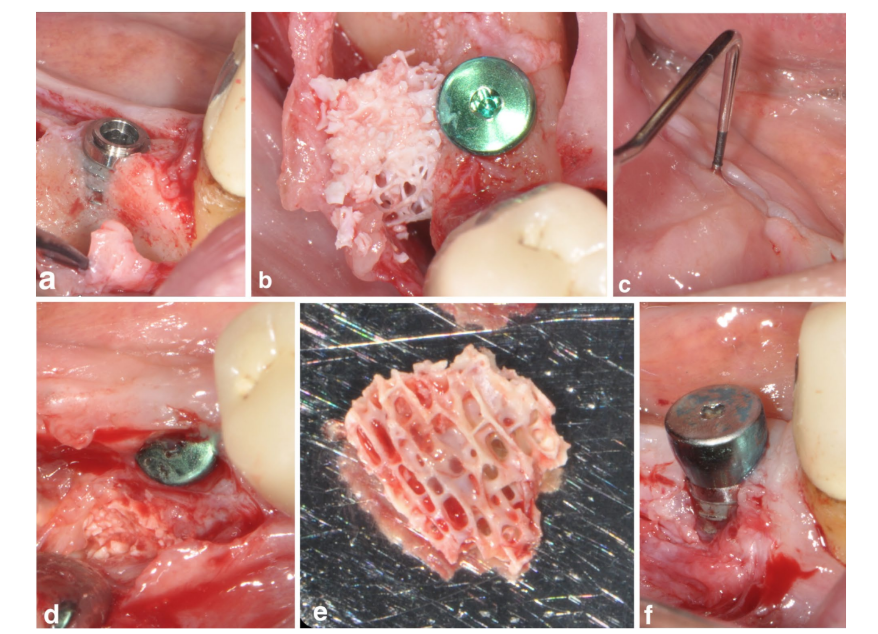
Um paciente do grupo SPALbloqueio apresentou uma infecção pós-operatória 4 semanas após a intervenção cirúrgica. O paciente relatou inchaço e dor na área tratada cirurgicamente, e uma fístula drenando exsudato purulento era evidente (Figura 3a–f). Após a elevação do retalho de espessura parcial, o enxerto de bloco de DBBM foi encontrado embutido em tecido de granulação e, portanto, removido.
4.2 Resultados do Estudo
4.2.1 Resultado Primário
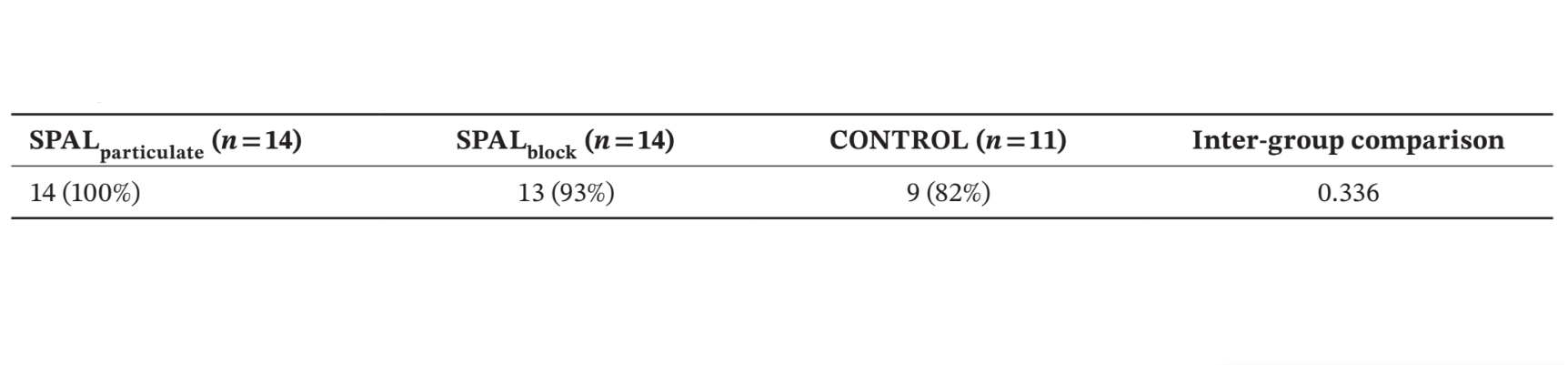
Número e % de pacientes apresentando a superfície rugosa do implante coberta até a parte apical do colar polido na reentrada (ou seja, sem PIBD) estão mostrados na Tabela 2. Nenhum defeito residual foi encontrado no grupo SPALparticulado, enquanto no grupo SPALbloco o paciente que havia experimentado a infecção do enxerto pós-operatório apresentou um PIBD residual. Dois pacientes no grupo CONTROLE apresentaram um PIBD incidente na reentrada (Tabela 2). As diferenças entre os grupos não foram estatisticamente significativas.
4.2.2 Resultados Secundários
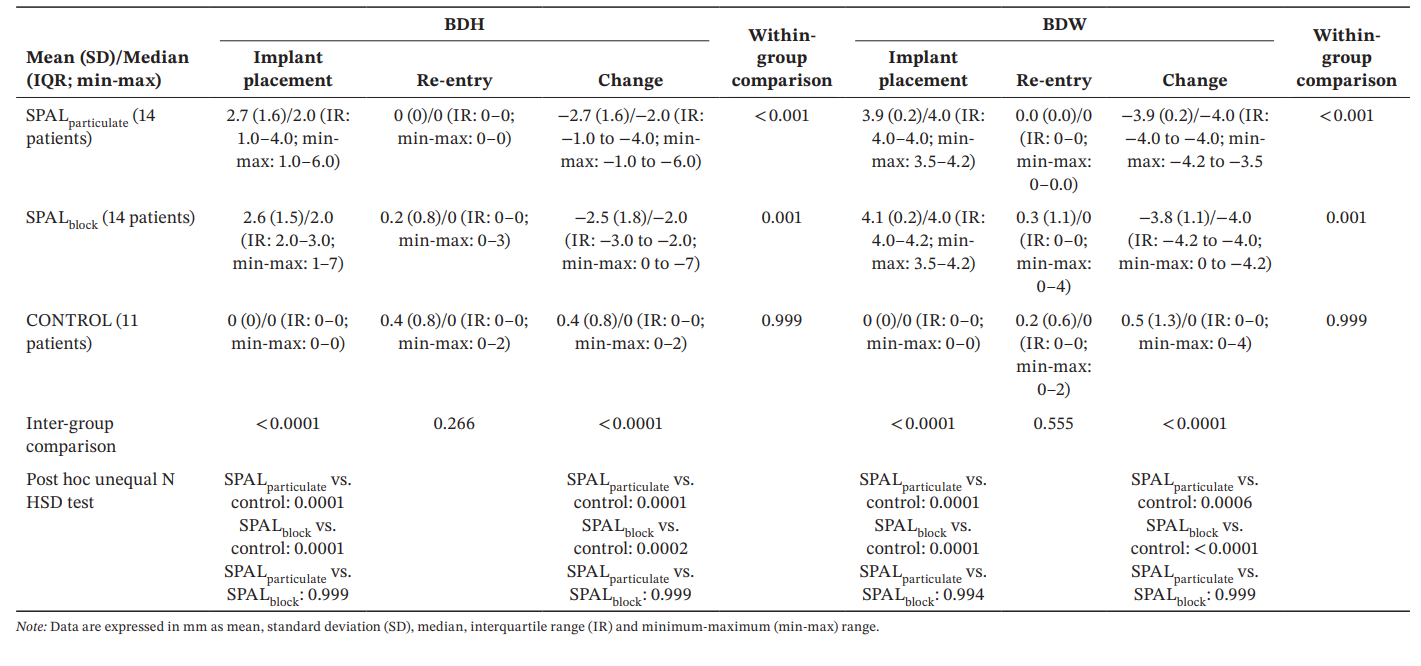
O modelo GLZ ajustado para os fatores de confusão identificados (comprimento e posição do implante) mostrou que tanto o tratamento quanto o tempo foram preditores significativos para ambos BDH e BDW (tempo, p < 0.0001 para ambos; tratamento, p < 0.001 para ambos). As comparações intra e intergrupos para BDH e BDW estão relatadas na Tabela 3. O teste de Wilcoxon para dados pareados mostrou uma redução significativa no tempo para ambos os grupos SPALparticulate (p < 0.001 para ambos BDH e BDW) e SPALblock (p = 0.001 para ambos BDH e BDW). Na colocação do implante, os grupos SPAL foram ambos significativamente diferentes do grupo CONTROLE (p = 0.0001 para ambos BDH e BDW). No entanto, nenhuma diferença significativa foi detectada entre os grupos na reentrada para ambos BDH e BDW. No grupo SPALblock o paciente com PIBD residual apresentou um BDH de 3 mm e um BDW de 4 mm. No grupo CONTROLE, os dois pacientes com um PIBD incidente na reentrada apresentaram um BDH de 2 mm e BDW de 2 mm e um BDH de 2 mm e BDW de 4 mm, respectivamente.
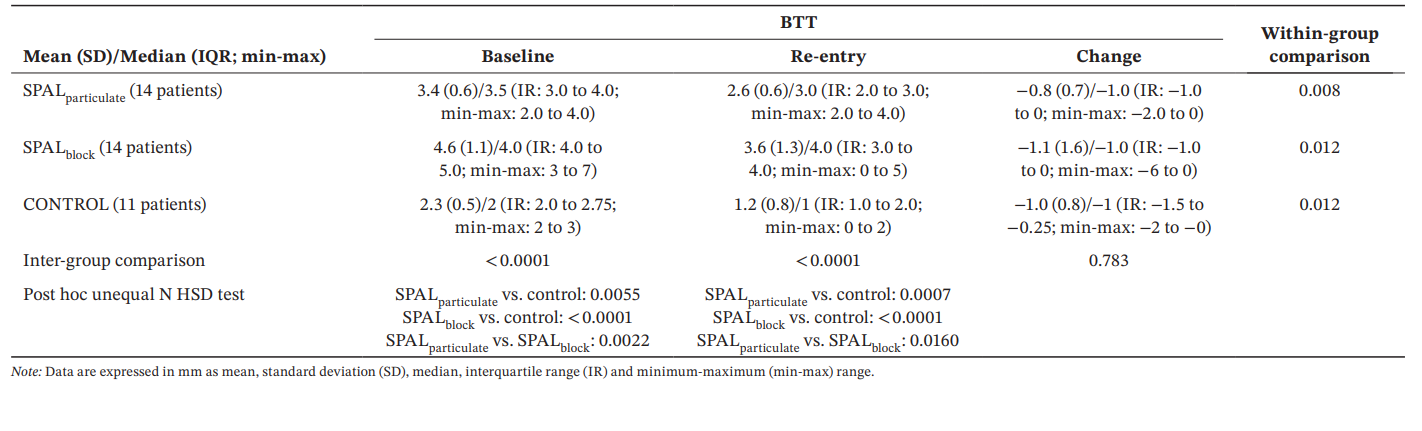
Para BTT, o modelo GLZ ajustado para os confundidores identificados mostrou que tanto o tratamento quanto o tempo foram preditores significativos (p < 0.0001 para ambos os fatores). As comparações intra e intergrupos para BDH e BDW estão relatadas na Tabela 4. Uma diferença significativa entre os grupos foi observada tanto na linha de base quanto na reentrada (p < 0.0001). Em particular, o grupo SPALblock mostrou valores significativamente maiores do que o SPALparticulate tanto na linha de base (p = 0.0022) quanto na reentrada (p = 0.0160). As comparações intra-grupo mostraram uma redução significativa em BTT ao longo do tempo para todos os grupos, a magnitude dessa redução sendo semelhante entre os grupos.
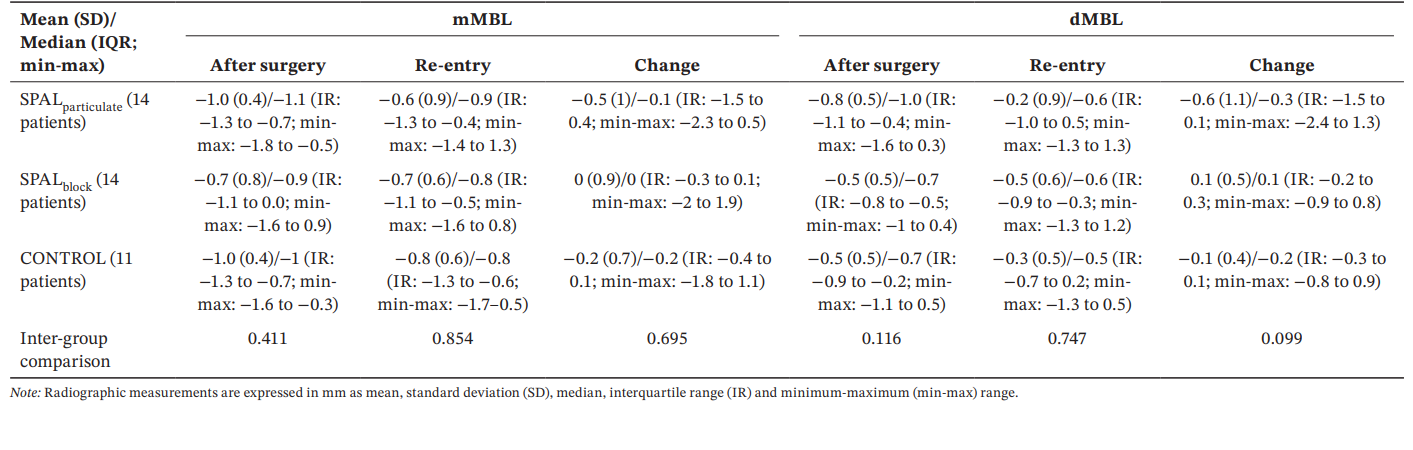
Todos os grupos mostraram valores semelhantes de mMBL e dMBL após a cirurgia e na reentrada, bem como mudanças ao longo do tempo (Tabela 5).
Discussão
O objetivo do presente estudo retrospectivo foi avaliar a eficácia da técnica SPAL realizada em combinação com DBBM na forma de partículas ou bloco para corrigir completamente um PIBD na colocação do implante. Os grupos SPAL também foram comparados com um grupo de pacientes apresentando uma placa óssea bucal peri-implantar de pelo menos 2 mm após a colocação do implante. Os resultados mostraram que, independentemente da forma do DBBM, os implantes tratados com a técnica SPAL apresentaram uma taxa igualmente alta de pacientes mostrando uma correção completa do defeito na reentrada de 6 meses. O grupo SPALbloco apresentou uma BTT significativamente maior tanto na linha de base quanto na reentrada. No entanto, a extensão do remodelamento do enxerto/ósseo foi semelhante entre os grupos.
A escolha de usar a taxa de correção completa da deiscência como resultado primário deve-se ao fato de que um PIBD não tratado ou parcialmente corrigido pode (i) favorecer a ocorrência de uma complicação biológica (Monje et al. 2019; Schwarz, Sahm e Becker 2012) e (ii) levar a uma maior perda óssea peri-implantar interproximal (Jung et al. 2017). O grupo CONTROLE foi incluído para avaliar a extensão do remodelamento dos dois biomateriais de enxerto em comparação com o osso nativo.
A eficácia do SPAL realizado em combinação com um pDBBM para o tratamento de um PIBD foi consistente com a relatada em estudos clínicos anteriores onde o mesmo particulado de enxerto foi utilizado, mostrando uma taxa de cobertura de deiscência completa variando de 80% a 91% (Trombelli et al. 2019, 2020). Esses achados podem ser parcialmente atribuídos a aspectos biológicos e técnicos específicos do procedimento regenerativo. Na técnica SPAL, a camada periosteal representa uma fonte de células osteogênicas que podem (i) contribuir favoravelmente para a nova formação óssea (Ceccarelli et al., 2016) e (ii) atuar como um indutor neoangiogênico, proporcionando assim a vascularização precoce do enxerto de DBBM (Nobuto et al. 2005). Além disso, a criação de um espaço sub-periosteal isolado pode permitir uma acomodação e estabilização adequadas do enxerto na porção mais coronal do implante (Trombelli et al. 2018, 2019, 2020). A estabilidade do enxerto para suportar a atividade osteocondutiva do enxerto também é aprimorada por meio de suturas internas em colchão que fixam a porção coronal da camada periosteal ao retalho oral. Consistentemente, uma meta-análise em rede comparando diferentes opções de tratamento para corrigir completamente um PIBD mostrou que o SPAL com um pDBBM tem a maior probabilidade de sucesso entre os procedimentos incluídos (Severi et al. 2022).
Recentemente, o uso de um bDBBM em combinação com SPAL foi proposto como uma alternativa promissora a um enxerto particulado (Trombelli et al. 2022). O bDBBM foi sugerido para atuar como um suporte osteocondutivo eficaz devido às suas propriedades mecânicas que abrangem uma deslocação limitada na manipulação do retalho, bem como uma maior estabilidade dimensional (Benic et al. 2016; Benic et al. 2017; Mir-Mari et al. 2016). A eficácia do bDBBM é apoiada por nossas descobertas que mostraram uma taxa de 93% de correção completa de PIBD. Além disso, o uso de bDBBM resultou em um BTT maior do que o pDBBM tanto na linha de base quanto na reentrada. Esses resultados são consistentes com aqueles provenientes de um estudo onde a combinação de um bDBBM e uma membrana de colágeno, simultaneamente com a colocação do implante, mostrou ser superior à combinação da mesma membrana e um pDBBM na resolução completa do defeito e restauração de uma placa bucal espessa (Benic et al. 2019). Deve-se, no entanto, enfatizar que um paciente que recebeu o enxerto em bloco apresentou uma infecção no enxerto pós-cirurgia, levando a uma deiscência persistente em 6 meses. Estudos anteriores onde um bloco ósseo xenogênico foi utilizado para um procedimento de aumento de rebordo realizado antes da colocação do implante relataram uma taxa de infecção do enxerto e subsequente remoção de 33% (Ortiz-Vigón et al. 2017) a 40% (Schwarz et al. 2021) dos casos tratados. Estudos pré-clínicos (Benic et al. 2016; Benic et al. 2017) e clínicos (Laas, et al., 2020) mostraram que o bDBBM foi pouco colonizado por osso novo quando comparado ao pDBBM. A formação óssea limitada observada estava relacionada a uma vascularização prejudicada do bloco devido à sua macroestrutura (Laass et al. 2020). Se e em que medida o uso de um bDBBM pode representar uma alternativa segura e eficaz ao pDBBM quando combinado à técnica SPAL precisa ser mais avaliado.
Nosso desenho de estudo pode fornecer uma visão preliminar sobre a extensão da remodelação do enxerto após procedimentos de SPAL com diferentes formas de enxerto em comparação com a remodelação óssea após a colocação de implantes. Apesar do grupo SPALblock ter mostrado um BTT significativamente maior tanto após a cirurgia quanto na reentrada, a magnitude da remodelação do enxerto foi semelhante para os dois enxertos e em comparação com o osso nativo. As mudanças no BTT no grupo SPALblock foram consistentes com estudos anteriores que avaliaram a remodelação do enxerto após o procedimento GBR realizado utilizando um bDBBM em combinação com uma membrana de colágeno (Benic et al. 2019). Em contraste, o mesmo estudo mostrou que a redução média na espessura para um pDBBM mais membrana de colágeno foi duas vezes maior (2 mm) em comparação com nossos dados. As diferenças nas mudanças de BTT observadas nos dois estudos podem ser explicadas por dinâmicas de remodelação do enxerto variadas, bem como pela extensão do deslocamento do enxerto em consequência do procedimento regenerativo específico. Coletivamente, essas observações sugerem a necessidade de corrigir excessivamente a dimensão do BTT para compensar o encolhimento horizontal pós-cirúrgico do enxerto, independentemente dos procedimentos de aumento ósseo utilizados.
No nosso material, o grupo CONTROLE consistiu em pacientes onde uma espessura de PBBP de pelo menos 2 mm estava presente após a colocação do implante. Essa escolha foi baseada em estudos anteriores que mostraram que a espessura de PBBP correlaciona-se com a incidência de perda óssea vertical na placa bucal após a inserção do implante (Spray et al. 2000) e a consequente necessidade de procedimentos de aumento ósseo (Roccuzzo, Imber e Jensen 2021). Curiosamente, uma redução média na BTT de 1 mm também foi observada no grupo CONTROLE, o que levou dois pacientes (18%) a experienciar um incidente PIBD na reentrada. O remodelamento ósseo excedeu o relatado em estudos anteriores, onde a redução na espessura de PBBP após a colocação do implante variou de 0,3 (Merheb et al. 2017) a 0,4 mm (Cardaropoli, Lekholm e Wennström 2006). Diferentes fatores, incluindo o posicionamento 3D do implante (Nomiyama et al. 2022), métodos de preparação do local do implante (Baggi et al. 2008; Peker Tekdal et al. 2016), design/superfície do implante (Linkevicius et al. 2020; Galindo-Moreno et al. 2016; Camarda et al. 2021), localização anatômica (anterior/posterior, mandíbula/maxila) (Ghaly et al. 2023), espessura da mucosa peri-implantar (Maia et al. 2015; Suárez-López Del Amo et al. 2016), e conexão protética (Linkevicius et al. 2015) podem ter contribuído parcialmente para essa observação discrepante.
Para facilitar o fechamento por intenção primária, implantes de nível tecidual foram colocados com a margem coronal do colar polido no nível da crista óssea. Nesse sentido, não se pode excluir o impacto da posição do implante na quantidade de correção de PIBD, bem como a extensão do remodelamento ósseo peri-implantar após a inserção do implante (Saleh et al. 2018). Além disso, os grupos SPAL e o grupo CONTROLE foram reentrados para a descoberta do implante em diferentes períodos pós-cirúrgicos (6 meses vs. 3 meses). Essa diferença pode ter impactado de várias maneiras o remodelamento tecidual após a inserção do implante.
A perda óssea marginal peri-implantar após a instalação do implante pode resultar de remodelamento fisiológico devido a trauma mecânico e térmico durante a preparação do local do implante. Curiosamente, em nosso material, uma quantidade limitada de remodelamento de enxerto/ósseo foi observada de maneira semelhante entre os grupos e foi consistente com estudos anteriores onde implantes de nível tecidual foram colocados de forma equicrestal (Saleh et al. 2018) ou tratados com SPAL mais pDBBM (Trombelli et al. 2020).
Algumas limitações do presente estudo devem ser consideradas ao interpretar seus achados. A escolha de um estudo piloto com um desenho retrospectivo foi baseada na falta de indicações clínicas específicas (ou seja, fatores relacionados ao paciente/defeito) para combinar a técnica SPAL com DBBM particulado ou bloco de DBBM devido à evidência limitada e anedótica (Trombelli et al. 2022) que apoia o uso do bloco de DBBM em combinação com a técnica SPAL. Uma formulação específica de DBBM foi utilizada de acordo com a preferência do operador. Essa seleção imparcial do enxerto utilizado não resultou em diferenças significativas em termos de características do paciente e do defeito. No entanto, alguns fatores, como localização anatômica e comprimento dos implantes, estavam distribuídos de maneira desigual entre os grupos e, embora controlados pela análise estatística, podem ter influenciado os resultados observados. Como os pacientes incluídos foram tratados consecutivamente durante a atividade clínica de rotina, uma sonda UNC 15 foi a ferramenta regular/padronizada utilizada para realizar todas as medições clínicas, incluindo as dimensões PIBD. Outros métodos de medição, como um paquímetro (Roccuzzo, Imber e Jensen 2021) ou um dispositivo especificamente projetado (Merheb et al. 2017), poderiam ter resultado em registros mais apropriados do tamanho da deiscência e BBT.
Em conclusão, nossos resultados parecem indicar que o SPAL realizado em combinação com um enxerto de DBBM particulado ou em bloco é igualmente eficaz na correção de um PIBD, bem como no aumento do BTT em 6 meses.
Mattia Severi, Franzini Chiara, Anna Simonelli, Chiara Scapoli, Leonardo Trombelli
Referências
- Baggi, L., I. Cappelloni, M. Di Girolamo, F. Maceri, e G. Vairo. 2008. “A Influência do Diâmetro e Comprimento do Implante na Distribuição de Estresse de Implantes Osseointegrados Relacionados à Geometria do Osso Crestado: Uma Análise de Elementos Finitos Tridimensionais.” Journal of Prosthetic Dentistry 100, n.º 6: 422–431. https://doi.org/10.1016/S0022-3913(08)60259-0.
- Benic, G. I., B. M. Eisner, R. E. Jung, T. Basler, D. Schneider, e C. H. F. Hämmerle. 2019. “Mudanças em Tecidos Duros Após Regeneração Óssea Guiada de Defeitos Peri-Implantares Comparando Bloco Versus Substitutos Ósseos Particulados: Resultados de 6 Meses de um Ensaio Clínico Controlado Randomizado.” Clinical Oral Implants Research 30: 1016– 1026. https://doi.org/10.1111/clr.13515.
- Benic, G. I., D. S. Thoma, F. Muñoz, I. S. Martin, R. E. Jung, e C. H. F. Hämmerle. 2016. “Regeneração Óssea Guiada de Defeitos Peri-Implantares Com Substitutos Ósseos Xenogênicos Particulados e em Bloco.” Clinical Oral Implants Research 27, n.º 5: 567–576. https://doi.org/10.1111/clr.12625.
- Benic, G. I., D. S. Thoma, I. Sanz-Martin, et al. 2017. “Regeneração Óssea Guiada em Implantes Dentários de Zircônia e Titânio: Uma Investigação Histológica Piloto.” Clinical Oral Implants Research 28, n.º 12: 1592–1599. https://doi.org/10.1111/clr.13030.
- Bressan, E., N. Ferrarese, M. Pramstraller, D. Lops, R. Farina, e C. Tomasi. 2017. “Dimensões do Alvéolo da Mandíbula Edêntula no Sextante Posterior: Um Estudo Observacional em Radiografias de Tomografia Computadorizada de Feixe Cônico.” Implant Dentistry 26, n.º 1: 66–72. https:// doi.org/10.1097/ID.0000000000000489.
- Camarda, A. J., R. Durand, M. Benkarim, P. H. Rompré, G. Guertin, e H. Ciaburro. 2021. “Ensaio Clínico Randomizado Prospectivo Avaliando os Efeitos de Dois Diferentes Projetos de Colar de Implante na Cicatrização Peri-Implantar e na Osseointegração Funcional Após 25 Anos.” Clinical Oral Implants Research 32: 285–296. https://doi.org/10.1111/clr.13699.
- Cardaropoli, G., U. Lekholm, e J. L. Wennström. 2006. “Alterações Teciduais em Substituições de Dente Único Suportadas por Implantes: Um Estudo Clínico Prospectivo de 1 Ano.” Clinical Oral Implants Research 17, n.º 2: 165–171. https://doi.org/10.1111/j.1600-0501.2005.01210.x.
- Farina, R., A. Simonelli, A. Baraldi, et al. 2021. “Perda Dentária em Pacientes com Periodontite Conformada e Não Conformada com Diferentes Níveis de Risco Periodontal Durante o Cuidado Periodontal de Suporte.” Clinical Oral Investigations 25, n.º 10: 5897–5906. https://doi.org/10.1007/s00784-021-03895-8.
- Galindo-Moreno, P., A. León-Cano, A. Monje, I. Ortega-Oller, F. O'Valle, e A. Catena. 2016. “A Altura do Pino Influencia o Efeito da Mudança de Plataforma na Perda Óssea Marginal Peri-Implantar.” Clinical Oral Implants Research 27, n.º 2: 167–173. https://doi.org/10.1111/clr.12554.
- Gallucci, G. O., A. Hamilton, W. Zhou, D. Buser, e S. Chen. 2018. “Colocação de Implante e Protocolos de Carga em Pacientes Parcialmente Edêntulos: Uma Revisão Sistemática.” Clinical Oral Implants Research 29, n.º Supl 16: 106–134. https://doi.org/10.1111/clr.13276.
- Ghaly, M., D. Tarrazzi, V. Xia, S. Tharrington, e T. R. Schoenbaum. 2023. “Mudanças no Nível Ósseo Marginal Peri-Implantar por Localização da Mandíbula: Uma Revisão Sistemática e Meta-Análise de 4970 Implantes.” Journal of Oral Implantology 49, n.º 4: 444–455. https://doi.org/10.1563/aaid-joi-D-22-00252.
- Herrera, D., T. Berglundh, F. Schwarz, et al. 2023. “Prevenção e Tratamento de Doenças Peri-Implantares—A Diretriz de Prática Clínica de Nível S3 da EFP.” Journal of Clinical Periodontology 50, n.º Supl 26: 4–76. https://doi.org/10.1111/jcpe.13823.
- Jensen, S. S., T. Aghaloo, R. E. Jung, et al. 2023. “Relatório de Consenso do Grupo 1 ITI: O Papel das Dimensões Ósseas e dos Procedimentos de Aumento de Tecidos Moles na Estabilidade dos Resultados Clínicos, Radiográficos e Relatados pelos Pacientes do Tratamento com Implantes.” Clinical Oral Implants Research 34, n.º Supl 26: 43–49. https://doi.org/10.1111/clr.14154.
- Jung, R. E., M. Herzog, K. Wolleb, C. F. Ramel, D. S. Thoma, e C. H. F. Hämmerle. 2017. “Um Ensaio Clínico Controlado Randomizado Comparando Pequenos Defeitos de Deiscência Bucal em Torno de Implantes Dentários Tratados com Regeneração Óssea Guiada ou Deixados para Cicatrização Espontânea.” Clinical Oral Implants Research 28, n.º 3: 348–354. https://doi.org/10.1111/clr.12806.
- Laass, A., B. M. Eisner, C. H. F. Hämmerle, R. E. Jung, D. S. Thoma, e G. I. Benic. 2020. “Resultados Histológicos Após Regeneração Óssea Guiada de Defeitos Peri-Implantares Comparando Blocos Individualmente Moldados Versus Substitutos Ósseos Particulados.” International Journal of Periodontics and Restorative Dentistry 40, n.º 4: 519–527. https://doi.org/10.11607/prd.4575.
- Linkevicius, T., A. Puisys, L. Linkeviciene, V. Peciuliene, e M. Schlee. 2015. “Estabilidade do Osso Crestado em Torno de Implantes com Conexão Horizontalmente Correspondente Após Espessamento do Tecido Mole: Um Ensaio Clínico Prospectivo.” Clinical Implant Dentistry and Related Research 17, n.º 3: 497–508. https://doi.org/10.1111/cid.12155.
- Linkevicius, T., A. Puisys, R. Linkevicius, J. Alkimavicius, E. Gineviciute, e L. Linkeviciene. 2020. “A Influência do Pino de Cicatrização Submerso ou da Colocação Subcrestal do Implante na Espessura do Tecido Mole e na Estabilidade do Osso Crestado. Um Ensaio Clínico Randomizado de 2 Anos.” Clinical Implant Dentistry and Related Research 22, n.º 4: 497–506. https://doi.org/10.1111/cid.12903.
- Maia, L. P., D. M. Reino, V. A. Muglia, et al. 2015. “Influência da Espessura do Tecido Periodontal na Remodelação da Placa Bucal em Implantes Imediatos com Xenógeno.” Journal of Clinical Periodontology 42: 590–598. https:// doi.org/10.1111/jcpe.12405.
- Merheb, J., M. Vercruyssen, W. Coucke, L. Beckers, W. Teughels, e M. Quirynen. 2017. “O Destino do Osso Bucal em Torno de Implantes Dentários. Um Estudo de Acompanhamento de 12 Meses Pós-Carregamento.” Clinical Oral Implants Research 28, n.º 1: 103–108. https://doi.org/10.1111/clr.12767.
- Mir-Mari, J., H. Wui, R. E. Jung, C. H. F. Hämmerle, e G. I. Benic. 2016. “Influência do Fechamento de Feridas Cegas na Estabilidade do Volume de Diferentes Materiais GBR: Um Exame Tomográfico de Feixe Cônico In Vitro.” Clinical Oral Implants Research 27, n.º 2: 258–265. https://doi.org/10.1111/clr.12590.
- Monje, A., V. Chappuis, F. Monje, et al. 2019. “A Espessura Crítica da Parede Óssea Bucal Peri-Implantar Revisada: Um Estudo Experimental no Cão Beagle.” International Journal of Oral & Maxillofacial Implants 34, n.º 6: 1328–1336. https://doi.org/10.11607/jomi.7657.
- Monje, A., A. Roccuzzo, D. Buser, e H. L. Wang. 2023. “Influência da Espessura da Parede Óssea Bucal nas Mudanças Dimensionais dos Tecidos Duros e Moles Peri-Implantares: Uma Revisão Sistemática.” Clinical Oral Implants Research 34, n.º 3: 157–176. https://doi.org/10.1111/clr.14029.
- Nobuto, T., F. Suwa, T. Kono, et al. 2005. “Resposta Microvascular no Periósteo Após Cirurgia de Retalho Mucoperiósteo em Cães: Angiogênese e Reabsorção e Formação Óssea.” Journal of Periodontology 76, n.º 8: 1346–1353. https://doi.org/10.1902/jop.2005.76.8.1346.
- Nomiyama, L. M., E. K. Matumoto, M. G. Corrêa, et al. 2022. “Comparação Entre Cirurgia Guiada Sem Retalho e Cirurgia Convencional para Colocação de Implante: Um Ensaio Clínico Randomizado de 12 Meses.” Clinical Oral Investigations 27: 1665–1679. https://doi.org/10.1007/s00784-022-04793-3.
- Ortiz-Vigón, A., I. Suarez, S. Martínez-Villa, I. Sanz-Martín, J. Bollain, e M. Sanz. 2017. “Segurança e Desempenho de um Novo Bloco Ósseo Xenogênico Colagenado para Aumento do Alvéolo Alveolar Lateral para Colocação de Implante em Etapas.” Clinical Oral Implants Research 29, n.º 1: 36–45. https://doi.org/10.1111/clr.13036.
- Peker Tekdal, G., N. Bostanci, G. N. Belibasakis, e A. Gürkan. 2016. “O Efeito da Osteotomia de Implante com Cirurgia Piezoelétrica nos Parâmetros Radiológicos e Moleculares da Perda Óssea Crestada Peri-Implantar: Um Ensaio Randomizado, Controlado, de Boca Dividida.” Clinical Oral Implants Research 27, n.º 5: 535–544. https://doi.org/10.1111/clr.12620.
- Pramstraller, M., G. P. Schincaglia, R. Vecchiatini, R. Farina, e L. Trombelli. 2018. “Dimensões do Alvéolo em Regiões Posteriores Mandibulares: Um Estudo Comparativo Retrospectivo de Locais Dentados e Edêntulos Usando Dados de Tomografia Computadorizada.” Surgical and Radiologic Anatomy 40, n.º 12: 1419–1428. https://doi.org/10.1007/s00276-018-2095-0.
- Roccuzzo, A., J. C. Imber, e S. S. Jensen. 2021. “Necessidade de Aumento Ósseo Lateral em Dois Implantes de Diâmetro Estreito: Um Estudo Clínico Prospectivo e Controlado.” Clinical Oral Implants Research 32, n.º 4: 511–520. https://doi.org/10.1111/clr.13721.
- Saleh, M. H. A., A. Ravidà, F. Suárez-López Del Amo, G. H. Lin, F. Asa'ad, e H. L. Wang. 2018. “O Efeito da Posição da Junta Implante-Pino na Perda Óssea Crestada: Uma Revisão Sistemática e Meta-Análise.” Clinical Implant Dentistry and Related Research 20, n.º 4: 617–633. https://doi.org/10.1111/cid.12600.
- Schwarz, F., D. Sahin, S. Civale-Schweighöfer, e J. Becker. 2021. “Resultados a Longo Prazo Após Aumento Lateral do Alvéolo Alveolar Usando um Bloco Ósseo Xenogênico Colagenado: Um Estudo Clínico Prospectivo Monocêntrico de Braço Único.” International Journal of Implant Dentistry 7, n.º 1: 9. https://doi.org/10.1186/s40729-021-00293-3.
- Schwarz, F., N. Sahm, e J. Becker. 2012. “Impacto do Resultado da Regeneração Óssea Guiada em Defeitos do Tipo Deiscência na Estabilidade a Longo Prazo da Saúde Peri-Implantar: Observações Clínicas em 4 Anos.” Clinical Oral Implants Research 23, n.º 2: 191–196. https://doi.org/10.1111/j.1600-0501.2011.02214.x.