Elevação do seio crestal usando um implante com canal interno em L: resultados após 1 ano de carga de um estudo de coorte prospectivo
Tradução automática
O artigo original está escrito em EN language (link para lê-lo) .
Objetivo: Avaliar os resultados clínicos e radiográficos de um procedimento de elevação de seio crestal em uma única etapa utilizando um sistema de implante endosseous auto-rosqueante (iRaise, Maxillent, Herzliya, Israel) desenvolvido para aumento de seio, 1 ano após a carga.
Materiais e métodos: Pacientes que necessitam de restauração na maxila posterior com um cume alveolar residual de 3 a 8 mm de altura e 5 mm de largura distal ao canino, conforme medido na tomografia computadorizada (CBCT), foram tratados utilizando o sistema de elevação de seio iRaise. As medidas de resultado foram: falhas de implante e prótese, quaisquer complicações, aumento da altura óssea (iBH), perda óssea marginal (MBL), quociente de estabilidade do implante (ISQ), padrões de remodelação de tecido radiográfico usando o índice de remodelação de enxerto de seio (SGRI), medições volumétricas do enxerto de seio, inchaço pós-cirúrgico relatado pelo paciente, consumo de medicação para dor e análise histológica.
Resultados: Um total de 30 participantes consecutivos com uma idade média de 54,2 ± 9,4 anos foram submetidos a uma elevação transcrestal da membrana do seio, inserção de enxerto ósseo e colocação de implante. Um total de 50 implantes foram colocados (30 implantes do sistema iRaise e 20 implantes adjuntos iSure, Maxillent). O seguimento médio foi de 15,8 ± 2,1 meses após a carga do implante. Um paciente desistiu na avaliação de seguimento após 1 ano da carga. Nenhum implante e nenhuma prótese falharam durante todo o seguimento. Um paciente apresentou uma pequena ruptura da membrana. Antes da inserção do implante, a altura média do rebordo alveolar residual era de 4,64 ± 0,86 mm (intervalo: 3,4–6,4 mm; IC 95%: 4,39–5,01 mm). Um ano após a carga, a altura óssea era de 16,86 ± 3,13 mm (IC 95% 15,83–18,07 mm). No seguimento de 1 ano após a carga, a média de MBL foi de 0,19 ± 1,05 mm (IC 95% 0,02–0,78 mm). A média de ISQ na colocação do implante foi de 65,2 ± 5,4 (IC 95% 63,6–67,4) e aumentou durante o período de cicatrização, alcançando o valor médio de 73,6 ± 3,7 (IC 95% 73,1–75,9; intervalo 62–79). A diferença foi estatisticamente significativa (8,4 ± 5,3; IC 95% 5,9–39,7; P = 0,0000). Um ano após a carga, a pontuação SGRI foi avaliada em 23 implantes. No geral, o valor médio de SGRI foi de 2,29 ± 2,41 mm (IC 95% 1,22–2,98 mm). O volume ósseo na colocação do implante foi de 2,41 ± 0,25 CC (IC 95% 2,22–2,48 CC). Durante o período de cicatrização submersa de 6 meses, foi observada uma leve contração óssea de 11,3% (2,13 ± 0,24 CC; IC 95% 2,02–2,26; diferença = 0,27 ± 0,25 CC; IC 95% 0,10–0,36; P = 0,0011). No primeiro ano pós-carga, o enxerto ósseo permaneceu estável (2,11 ± 0,22 CC; IC 95% 2,02–2,24). A diferença não foi estatisticamente significativa (0,02 ± 0,07 CC; IC 95% 0,01–0,04; P = 0,2166). Do ponto de vista do paciente, o valor médio da dor foi de 0,52 ± 0,74 (intervalo 0–3); o valor médio do inchaço foi de 0,27 ± 0,52 (intervalo 0–2); e o consumo médio de analgésicos foi de 0,87 ± 4,94 comprimidos (intervalo 0–4) 3 dias após a cirurgia. Análises morfológicas e histomorfométricas mostraram que todas as amostras apresentavam uma estrutura normal sem infiltrado inflamatório, seis meses após a cicatrização. As seguintes frações (%) foram encontradas: osso (osso imaturo + osso maduro): 44,07 ± 4,91; biomaterial residual: 23,98 ± 2,64; espaços medulares: 31,95 ± 3,16.
Conclusões: A elevação do assoalho do seio maxilar pode ser realizada com sucesso com uma abordagem transcrestal usando um sistema de implante dedicado. Uma contração fisiológica de 11,3% do volume original do enxerto ósseo foi observada durante os primeiros 6 meses de cicatrização; após isso, nenhuma redução adicional do volume do enxerto foi observada. Estudos clínicos de longo prazo são necessários para confirmar esses resultados preliminares.
Introdução
A elevação do assoalho do seio em etapas é a solução comum para a colocação de implantes em maxilas atrofiadas severas. No entanto, a elevação do assoalho do seio maxilar usando uma abordagem lateral implica a execução de um grande retalho mucoso periosteal que inevitavelmente afeta a recuperação pós-operatória e o custo adicional do procedimento de aumento. Perfurações da membrana do seio, sangramento nasal, dor pós-operatória, inchaço, hematoma e infecção do seio são complicações possíveis.
A elevação do assoalho do seio maxilar através da crista alveolar (transalveolar) foi descrita pela primeira vez por Tatum no final da década de 1970 e foi publicada pela primeira vez por Boyne em 1980. A técnica foi repetidamente modificada. As principais preocupações com essa técnica são a quantidade limitada de aumento ósseo, a falta de acesso visual ao local, o risco de perfuração da membrana de Schneider e os sintomas pós-operatórios.
Uma elevação hidráulica transcrestal fechada da membrana de Schneider e um aumento simultâneo do enxerto ósseo podem ser realizados usando um implante dentário dedicado. Essa abordagem difere principalmente das técnicas hidráulicas descritas anteriormente porque a elevação da membrana de Schneider e o enxerto ósseo são realizados através do implante.
Em geral, os procedimentos de elevação do seio aumentam adequadamente a dimensão vertical do processo alveolar reabsorvido na maxila posterior, permitindo assim a colocação de implantes de comprimento suficiente. A taxa de contração do volume do enxerto relatada na literatura varia de 20% a 50% tanto para osso autógeno quanto para substitutos ósseos, como enxerto ósseo desmineralizado liofilizado (DFDBA), enxerto ósseo mineralizado liofilizado (FDBA) e xenófitos. Nos últimos anos, biocerâmicas reabsorvíveis, feitas de uma mistura de hidroxiapatita e beta tricalcio fosfato, ganharam popularidade, demonstrando bioatividade e osteocondutividade em diferentes estudos histológicos. No entanto, o uso de substitutos ósseos é questionável quando mais de 3 mm de altura óssea está presente.
Um relatório interim de 6 meses deste estudo sobre os primeiros 18 pacientes mostrou uma contração fisiológica de 13,9% do volume original do enxerto ósseo utilizando o Sistema de Elevação de Seio iRaise. O presente estudo avaliou os resultados clínicos e radiográficos de um procedimento de elevação de seio crestal em uma única etapa utilizando um sistema de implante endosseous auto-perfurante (iRaise, Maxillent, Herzliya, Israel) desenvolvido para aumento de seio, utilizando tomografia computadorizada de feixe cônico (CBCT), 1 ano após a carga. Este estudo seguiu a declaração de Fortalecimento da Reportagem de Estudos Observacionais em Epidemiologia (STROBE) para melhorar a qualidade dos estudos observacionais (http://www.strobe-statement.org).
Materiais e métodos
Este estudo foi projetado como um estudo observacional prospectivo. Os pacientes foram tratados em uma clínica privada em Roma, Itália, entre setembro e dezembro de 2014. Todos os pacientes foram informados sobre a natureza do estudo e deram seu consentimento por escrito para os procedimentos cirúrgicos e protéticos e para o uso de dados clínicos e radiológicos. Os procedimentos cirúrgicos foram realizados por dois clínicos (MT e SMM) que têm ampla experiência em colocação de implantes e procedimentos de aumento de seio.
Pacientes consecutivos com 18 anos ou mais, capazes de assinar um consentimento informado, que necessitam de restaurações suportadas por implantes para reabilitar seu maxilar posterior atrófico, foram considerados elegíveis para inclusão. O local selecionado deveria ter uma crista alveolar residual de pelo menos 3 a 8 mm de altura e 5 mm de largura distal ao canino, conforme medido em uma tomografia computadorizada (CBCT).
Os critérios de exclusão foram:
- Contraindicações gerais à cirurgia de implante;
- Submetido a irradiação na área da cabeça e pescoço < 1 ano antes da implantação;
- Diabetes não controlada;
- Grávida ou amamentando;
- Abuso de substâncias;
- Fumante pesado (≥ 11 cigarros/dia);
- Terapia psiquiátrica ou expectativas irreais;
- Imunossuprimido ou imunocomprometido;
- Tratado ou em tratamento com aminobifosfonatos orais ou intravenosos;
- Falta de dentição/protese oclusal oposta na área destinada à colocação do implante;
- Bruxismo severo ou apertamento;
- Locais cicatrizados (pelo menos 3 meses após a extração dos dentes);
- Periodontite não tratada;
- Má higiene bucal e motivação (sangramento em toda a boca ao sondar e índice de placa em toda a boca > 25%);
- Pacientes participando de outros estudos, se isso impedir que o presente protocolo seja seguido adequadamente.
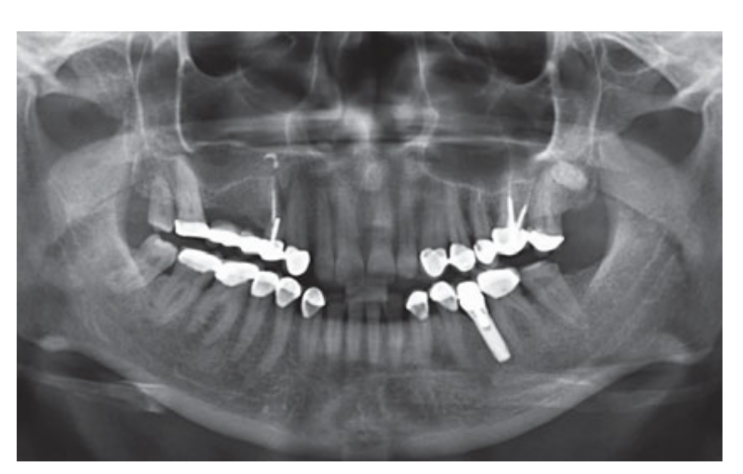
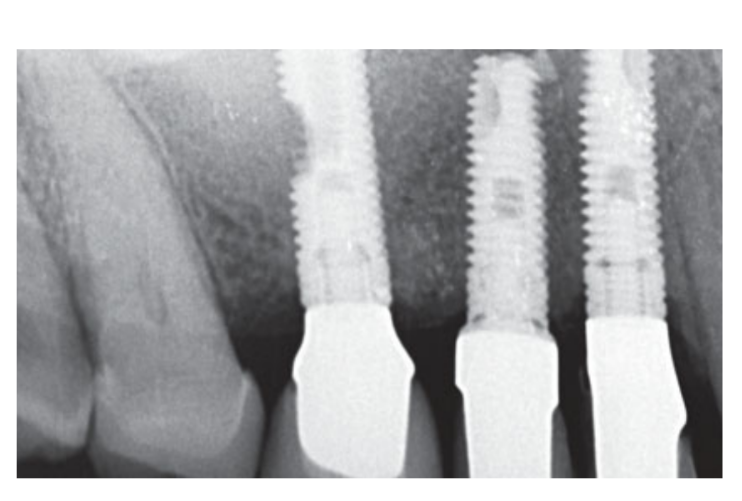
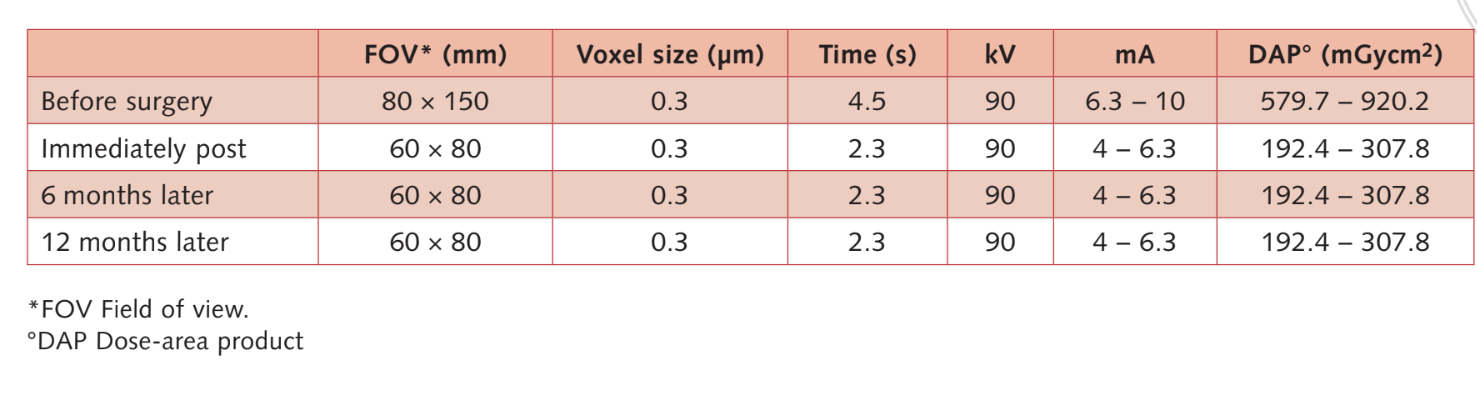
Fumantes moderados foram incluídos e os pacientes foram categorizados como não fumantes ou fumantes moderados (≤ 10 cigarros/dia). Radiografias panorâmicas ou periapicais pré-operatórias e fotos foram usadas para a triagem inicial (Figs 1 e 2). Tomografias computadorizadas de feixe cônico foram realizadas para cada paciente dentro de 2 semanas antes da cirurgia (campo de visão 80 A~ 150 mm; tamanho do voxel 0.3 μm; 4.5 s; 90 kV; 6.3–10 mA; 579.7–920.9 mGy cm2), imediatamente após o procedimento, 6 meses após a colocação do implante e 1 ano após a carga (campo de visão 60 Å~ 80 mm; tamanho do voxel 0.3μm; 2.3 s; 90 kV; 5–8 mA; 192.4–307.8 mGy cm2) como parte do protocolo de tratamento regular. Os parâmetros de exposição foram definidos o mais baixo possível.
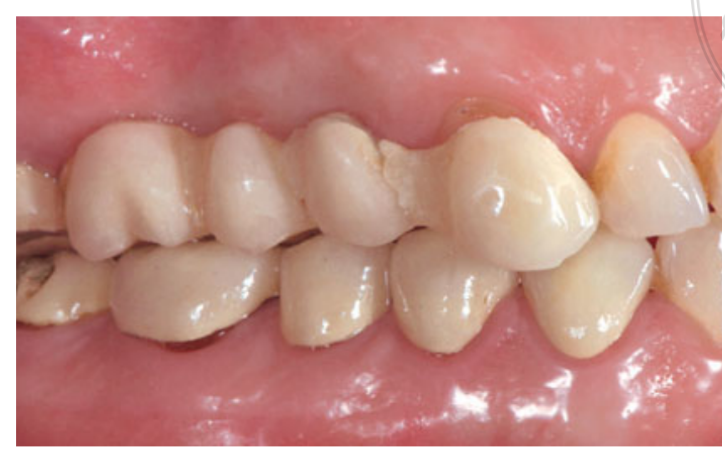
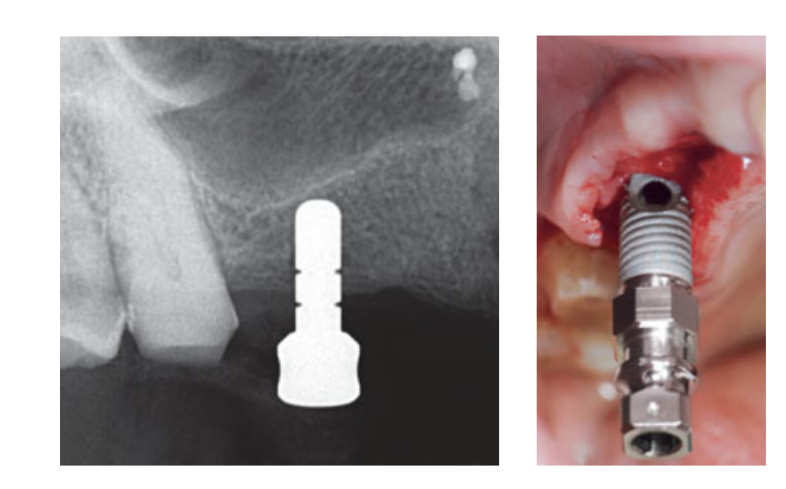
A terapia com spray intranasal (acetilcisteinato de glicinato de tiamina 810 mg/4 mL) e cortisona (betametasona 1 mg) foram administrados duas vezes ao dia, começando no dia anterior à cirurgia. No dia da cirurgia, uma dose única de antibiótico (2 g de amoxicilina e ácido clavulânico, ou 600 mg de clindamicina, se alérgico à penicilina) foi administrada profilaticamente 1 h antes da cirurgia. Um enxágue bucal de clorexidina a 0,2% foi administrado por 1 min antes da cirurgia. Anestesia local usando articaína com adrenalina 1:100.000 foi administrada. Uma incisão mediana foi feita e um retalho mucoperióstico de espessura total foi elevado. Os locais receptores de implante foram preparados de acordo com o protocolo de perfuração sugerido pelo fabricante (Fig 3a). Paradas de perfuração e guias de profundidade foram usadas para alcançar um controle preciso e seguro da profundidade da osteotomia. O comprimento do implante (variando de 13 a 16 mm) foi selecionado previamente com base na altura óssea residual, medida usando as tomografias CBCT pré-operatórias, da crista óssea ao fundo do seio ao longo do eixo planejado do implante, e confirmado usando ferramentas radiográficas dedicadas (Maxillent). Os implantes iRaise Sinus Lift (Maxillent) foram inseridos nos locais de osteotomia alinhando a abertura no implante mid-bucalmente e deixando um fio de parafuso visível acima da abertura (Fig 3b). O conector de tubo de uso único foi rosqueado na porta do tubo do implante. O conector não toca o implante, exceto pelo anel de silicone (silicone médico destinado à implantação). Em seguida, 2 a 3 mL de solução salina foram gentilmente injetados no seio através do conector de tubo e do canal interno em forma de L do implante (diâmetro 1,5 mm), isolado da conexão protética e, portanto, da cavidade oral. A solução salina foi retratada de volta para a seringa e um leve sangramento fisiológico foi notado na solução salina retratada. Depois, uma seringa preenchida com 1 mL de material de enxerto ósseo fluido (MBCP Gel, Biomatlante, Vigneux-de-Bretagne, França) foi misturada com 0,1 mL de solução salina estéril a 0,9%, que foi lentamente injetada através da mesma porta. O MBCP Gel é um substituto ósseo injetável 100% sintético composto por 60% de fosfato de cálcio bifásico e 40% de hidroxiapatita suspensa em um polímero solúvel, com uma granulometria variando de 80 a 200 μm. Após a conclusão do procedimento de enxerto, o sistema hidráulico foi desconectado e todo o comprimento do implante foi inserido no local da osteotomia e na cavidade do seio enxertada e deixado para cicatrizar por 6 meses, de acordo com um protocolo submerso. Implantes adicionais (iSure, Maxillent) foram colocados na área tratada após a sequência cirúrgica iRaise (Maxillent) ser concluída, ou 6 meses depois em casos onde os pacientes tinham altura óssea residual ≤ 3 mm no local planejado.
A terapia com spray intranasal (acetilcisteinato de glicinato de tiamina 810 mg/4 mL) e cortisona (betametasona 1 mg) foram continuadas por 10 dias após a cirurgia. Os antibióticos foram continuados por 7 dias (1 g de amoxicilina e ácido clavulânico ou 300 mg de clindamicina duas vezes ao dia) após a cirurgia. O enxaguante bucal de clorexidina 0,2% foi utilizado por 1 min duas vezes ao dia durante 2 semanas, e uma dieta leve foi recomendada por 1 mês. Ibuprofeno 400 mg ou paracetamol 1 g foram administrados em caso de dor. Os pontos foram removidos após 1 semana e as instruções de higiene bucal foram reforçadas.
Seis meses após a colocação do implante e aumento do seio, os pilares de cicatrização foram conectados. Em pacientes que necessitam de implantes em etapas, uma broca trephine calibrada com diâmetro externo de 3,0 mm foi utilizada para preparar o local e uma amostra de núcleo foi coletada para análise histológica.
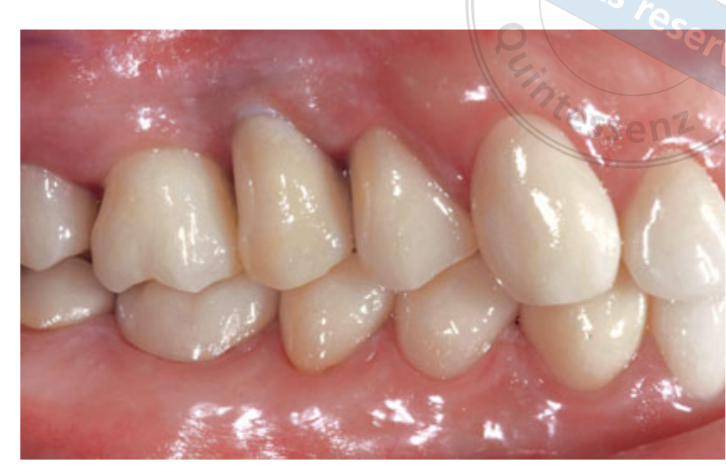
Duas semanas após a segunda cirurgia, uma impressão com bandeja aberta foi feita com um material de polietere (Impregum, 3M ESPE, Seefeld, Alemanha). Nenhuma restauração temporária foi utilizada. As restaurações finais foram fabricadas por tecnologia de design assistido por computador (CAD)/fabricação assistida por computador (CAM) e entregues de 4 (coroas unitárias) a 6 semanas (próteses fixas) depois. A oclusão foi então cuidadosamente verificada. Consultas de acompanhamento para manutenção da higiene bucal foram agendadas a cada 4 meses após a carga. A oclusão também foi avaliada em cada visita (Figs 4 e 5).
Medidas de resultado
As medidas de resultado deste estudo foram:
- Um implante foi considerado uma falha se apresentasse qualquer mobilidade, avaliada por batidas ou balanço da cabeça do implante com as alças metálicas de dois instrumentos, e/ou infecção que exigisse a remoção do implante ou quaisquer complicações mecânicas (por exemplo, fratura do implante) tornando o implante inútil, embora ainda mecanicamente estável no osso. A avaliação radiográfica utilizou uma radiografia intraoral realizada com uma técnica de paralelismo estritamente perpendicular à interface implante-osso.
- Uma prótese foi considerada uma falha se precisasse ser substituída por uma prótese alternativa.
- Quaisquer complicações biológicas (dor, inchaço ou supuração, etc) e/ou mecânicas (afrouxamento de parafusos ou fratura da estrutura e/ou do material de revestimento, etc).
- Mudanças nos níveis de osso marginal foram avaliadas por radiografias periapicais digitais intraorais (dispositivo Digora Optime, Soredex, Tuusula, Finlândia; placa de imagem, PSP [Placa de Fósforo Fotoestimulável] tamanho 2, tamanho do pixel 30 μm, resolução 17 lp/mm.) feitas com a técnica de paralelismo usando suportes de filme comercialmente disponíveis (Rinn XCP; Dentsply Rinn, Elgin, IL, EUA) na colocação do implante (linha de base), carga do implante e 1 ano após a carga. Em caso de uma radiografia ilegível, a radiografia foi realizada novamente. Todas as radiografias foram exibidas em um pacote de software de análise de imagem (DfW 2.8 para Windows, Soredex) que foi calibrado usando o comprimento ou diâmetro conhecido dos implantes dentários. A distância da margem mais coronária do colar do implante até o topo da crista óssea foi medida com precisão de 0,01 mm e considerada como o nível de osso marginal. Os valores mesiais e distais foram calculados como média para cada implante. A diferença negativa entre os pontos de tempo foi considerada como perda de osso marginal (MBL).
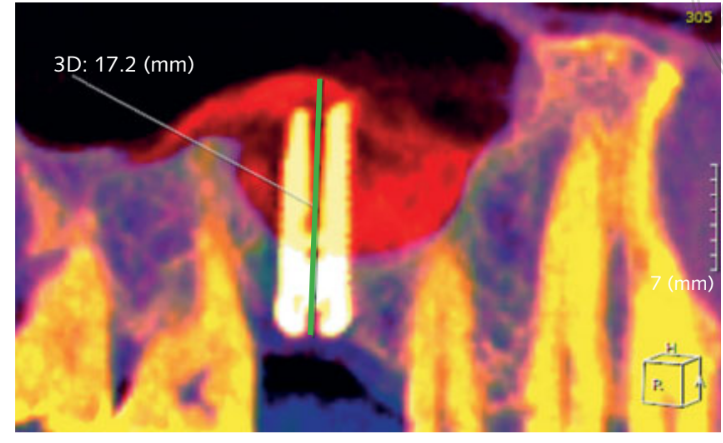
- Aumentos na altura óssea (iBH) foram calculados na tomografia computadorizada de feixe cônico (CBCT) como a distância entre a crista óssea e o sinal radiopaco mais superior do material do enxerto, medido ao longo do eixo longo do implante. O ganho ósseo foi determinado pela diferença entre a iBH e a altura do osso alveolar residual pré-operatório (aBH), calculada como a distância entre a crista óssea e o fundo do seio, medida ao longo do eixo longo na posição ideal do implante (Fig 6).
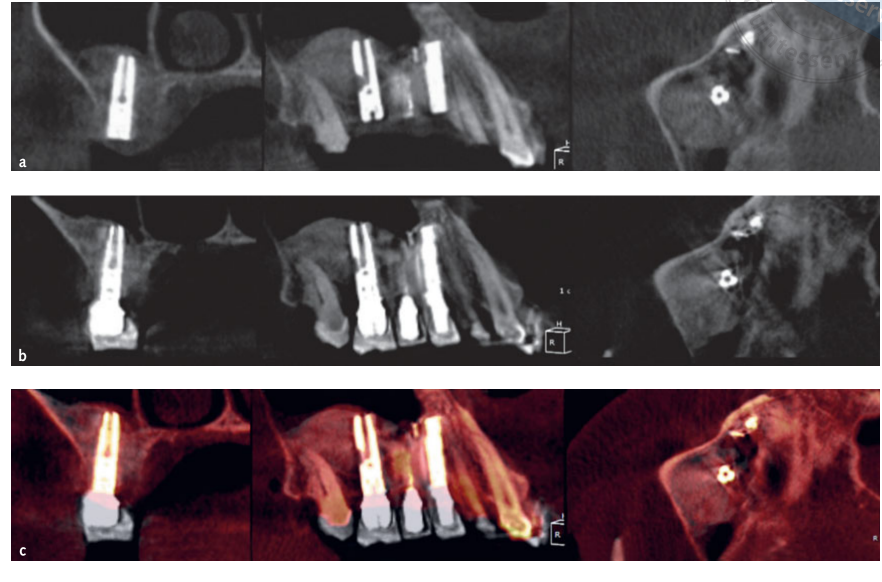
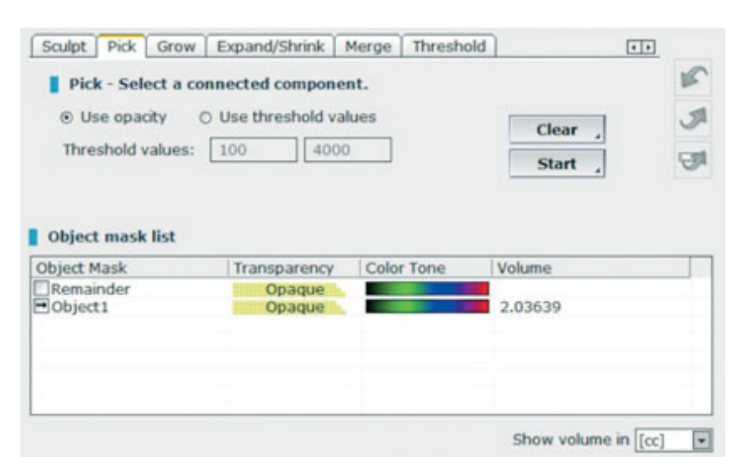
- Medições volumétricas de enxertos de seio foram realizadas na tomografia computadorizada de feixe cônico (CBCT) usando o software OnDemand 3D, módulo adjunto Fusion (Cybermed, Yuseong-gu, Daejeon, Coreia) (Fig 7). Fusion é uma ferramenta de visualização que utiliza uma técnica avançada de registro para sobrepor dados de volume usando informações de voxel. A tecnologia por trás do Fusion, conhecida como MI ou Informação Mútua, calcula a dependência estatística entre dois volumes, os valores de intensidade e correlação de entropia e compara a diferença na entropia da soma de imagens individuais e a entropia conjunta de imagens combinadas para fundir os dados. Sobreposições dos dados DICOM do paciente pós-operatório e pré-operatório foram feitas automaticamente desenhando uma área de interesse (VOI) sobre uma área envolvendo marcos anatômicos inalterados (por exemplo, dentes, crânio basal, implantes) e verificadas manualmente para uma correspondência completa, garantindo a maior precisão para a sobreposição. Em seguida, os volumes do material enxertado foram calculados por segmento na cavidade do seio usando a ferramenta de segmentação (OnDemand 3D, Cybermed). Esta ferramenta fornece informações volumétricas com base na opacidade do material enxertado (Figs 8 e 9). A área segmentada incluiu implantes e enxerto. No entanto, os implantes puderam ser claramente distinguidos dos materiais enxertados por sua densidade e estrutura e foram excluídos das medições. As tomografias CBCT foram realizadas antes da colocação do implante, imediatamente após, e nos acompanhamentos de 6 e 12 meses de acordo com o princípio ALARA (tão baixo quanto razoavelmente alcançável) (Tabela 1). A tecnologia SMAR (Redução de Artefatos Metálicos Soredex) foi utilizada para minimizar a dispersão de artefatos metálicos. O mesmo clínico, que não havia participado anteriormente do estudo, avaliou todas as medições radiográficas 2D e 3D.
- O torque de inserção foi registrado na colocação do implante usando a unidade cirúrgica (iChiro Pro, BienAir, Bienne, Suíça).
- O quociente de estabilidade do implante (ISQ) foi registrado pelo cirurgião usando análise de frequência de ressonância (dispositivo Osstell Mentor, Osstell, Göteborg, Suécia). Duas medições foram realizadas para cada implante: uma bucopalatina do lado bucal e uma mesiodistal do lado mesial. Ambas as medições foram calculadas como média, com o resultado sendo exibido pelo dispositivo em unidades ISQ, variando de 1 a 100. Os valores foram registrados na colocação do implante (linha de base) e no acompanhamento de 6 meses.
- O paciente relatou dor pós-cirúrgica, em uma escala ordinal (0 = sem dor; 1 = dor leve; 2 = dor moderada; 3 = dor severa): avaliada 3 dias após a cirurgia na consulta pós-operatória por um avaliador cego.
- O paciente relatou inchaço pós-cirúrgico, em uma escala ordinal (0 = sem inchaço; 1 = inchaço leve; 2 = inchaço moderado; 3 = inchaço severo): avaliado 3 dias após a cirurgia na consulta pós-operatória pelo avaliador cego.
- Consumo de analgésicos: número de comprimidos utilizados (de 12 comprimidos fornecidos [Ibuprofeno 400 mg, ou paracetamol 1 g para aqueles alérgicos a AINEs]): registrado 3 dias após a cirurgia na consulta pós-operatória pelo avaliador cego.
- A análise histomorfométrica foi utilizada para calcular as frações de volume de tecido (expressas como uma porcentagem do volume total) que compunham a amostra (osso, biomaterial, tecido mole). Amostras histológicas foram coletadas e fixadas em formalina a 10% e, em seguida, desidratadas em quantidades crescentes de álcool (70%, 80%, 90%, 96%, 100%), infiltradas em resina de álcool em proporções decrescentes (3 álcool:1 resina, 1:1, 1:3, resina pura) e finalmente embebidas em resina de metacrilato de metila pura (Technovit 7200 VLC, Exact Kulzer, Bio-Optica, Milão, Itália). Após isso, as amostras foram cortadas ao meio com uma lâmina de diamante para obter duas seções para cada amostra. Essas seções foram coladas em lâminas plásticas, lixadas até uma espessura de 100 μm e finalmente polidas com alumina 0,1%. As amostras foram coradas com uma coloração dicromática composta de azul de toluidina e amarelo de pironina, que destaca todas as diferentes frações de tecido. As lâminas foram observadas e fotografadas com um microscópio de luz e polarizado (Nikon Eclipse, Nikon Instruments S.p.A, Florença, Itália).
Análise estatística
Toda a análise de dados foi realizada de acordo com um plano de análise pré-estabelecido. A análise descritiva foi realizada utilizando a média ± desvio padrão (DP), mediana e intervalo de confiança de 95% (IC) (SPSS para Mac OS X versão 22.0, IBM Corporation, Armonk, Nova York, EUA). Comparações entre os vários pontos finais de acompanhamento e as medições basais foram feitas por meio de um teste t de Student pareado para detectar quaisquer alterações. Todas as comparações estatísticas foram conduzidas no nível de significância de 0,05. Os pacientes foram utilizados como a unidade estatística.
Resultados
No total, 33 pacientes foram selecionados para elegibilidade, mas três se recusaram a participar do protocolo de pesquisa. Portanto, 30 participantes consecutivos (17 mulheres, 13 homens) com uma idade média de 54,2 ± 9,4 anos (faixa: 28–75) e atrofia severa do maxilar posterior passaram por elevação transcrestal da membrana do seio, inserção de enxerto ósseo e colocação de implante no local planejado, sem desvio do protocolo original. O acompanhamento médio foi de 15,8 ± 2,1 meses após a carga do implante (faixa: 12–18). As principais características dos pacientes e dos implantes estão relatadas na Tabela 2.
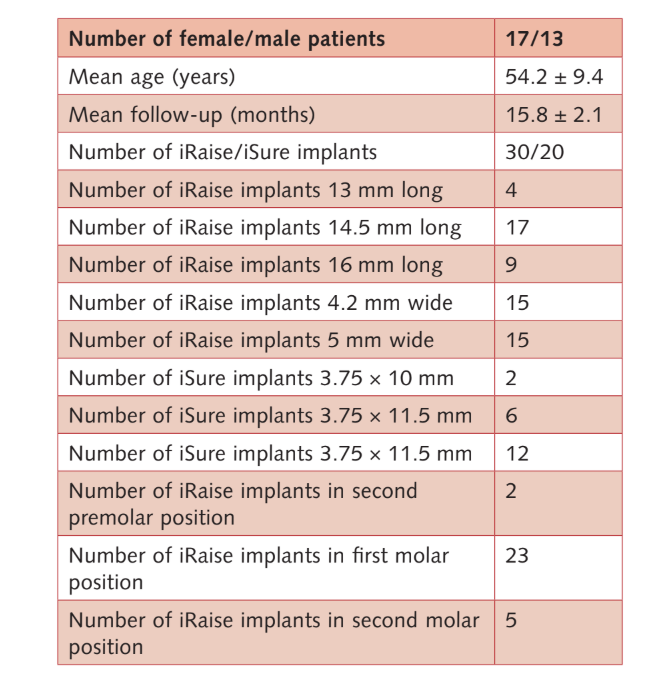
Um total de 50 implantes foram colocados (30 sistemas de implante iRaise e 20 implantes iSure adjuntos. Um paciente desistiu no exame de acompanhamento de 1 ano após a carga (o paciente não quis voltar para as avaliações). Nenhum implante e nenhuma prótese falharam durante o período de acompanhamento. Um paciente apresentou uma pequena ruptura na membrana que foi selada com uma esponja de colágeno (Parasorb Cone, RESORBA Medical GmbH, Nürmberg, Alemanha). O procedimento foi abortado e repetido com sucesso 2 meses depois. Nenhum outro evento adverso intra-operatório ou pós-operatório foi observado.
Antes da inserção do implante, a altura média da crista alveolar residual era de 4,64 ± 0,86 mm (faixa: 3,4–6,4 mm; IC 95%: 4,39 a 5,01 mm). Imediatamente após a colocação do implante, a altura do osso era de 17,92 ± 2,63 mm (IC 95% 17,02 a 18,90). Um ano após a carga, a altura do osso permaneceu estável, com um valor médio de 16,86 ± 3,13 mm (IC 95% 15,83 a 18,07). A diferença foi de 1,09 ± 1,60 mm (IC 95% 0,00 a 1,16; P = 0,0010). O ganho ósseo médio (iBH - aBH) em comparação com a linha de base foi de 12,15 ± 2,96 mm (IC 95% 11,22 a 13,38; P = 0,0000).
O nível médio de osso marginal na colocação do implante foi de -0,16 ± 0,86 mm (IC 95% -0,41 a -0,21).
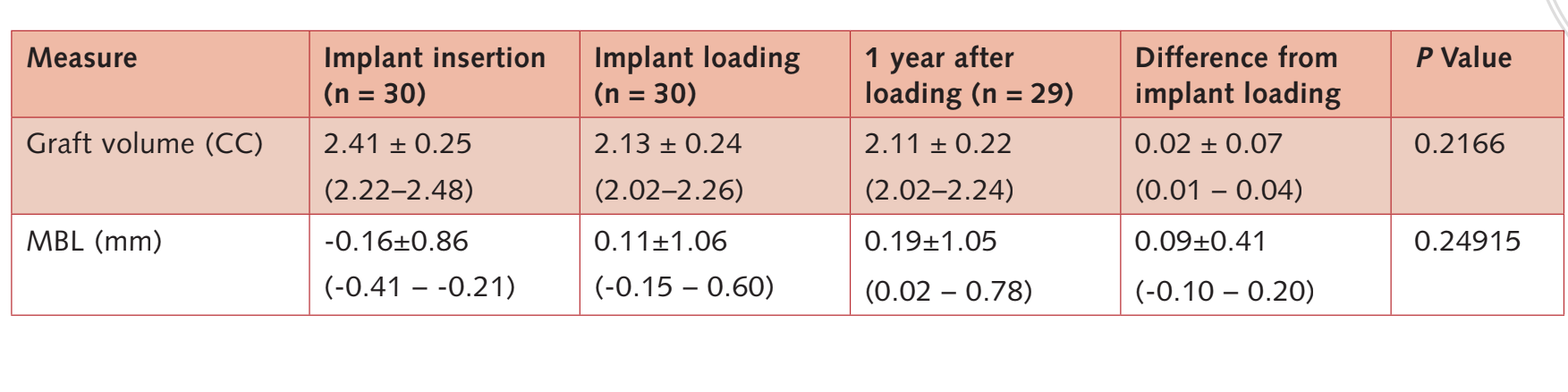
Na carga do implante, o nível médio de osso marginal foi de 0,11 ± 1,06 mm (IC 95% -0,15 a 0,60). No acompanhamento de 1 ano após a carga, o MBL médio foi de 0,19 ± 1,05 mm (IC 95% 0,02 a 0,78). A diferença em relação à linha de base foi de 0,36 ± 0,53 mm; IC 95% 0,08 a 0,47; P = 0,00095). Os dados estão relatados na Tabela 3.
O torque médio de inserção na colocação do implante foi de 31,6 ± 8,1 Ncm (IC 95% 29,9 a 35,7) (iChiro Pro, BienAir). O ISQ médio na colocação do implante foi de 65,2 ± 5,4 (IC 95% 63,6 a 67,4) e aumentou durante o período de cicatrização, alcançando um valor médio de 73,6 ± 3,7 (IC 95% 73,1 a 75,9; intervalo 62–79) na conexão do pilar de cicatrização (6 meses após a colocação do implante). A diferença foi estatisticamente significativa (8,4 ± 5,3; IC 95% 5,9 a 39,7; P = 0,0000).
Na colocação do implante, 24 de 30 implantes apresentaram enxerto ósseo sobre o ápice do implante. No total (n = 30), o valor médio foi de 2,95 ± 2,56 mm (IC 95% 2,18 a 4,0). Um ano após a carga, foi observado enxerto ósseo médio sobre o topo do ápice em 23 implantes. No total (n = 29), o valor médio foi de 2,29 ± 2,41 mm (IC 95% 1,22 a 2,98).
O volume ósseo na colocação do implante foi de 2,41 ± 0,25 CC (IC 95% 2,22 a 2,48). Durante o período de cicatrização submerso de 6 meses, foi observada uma leve contração óssea de 11,3%. (2,13 ± 0,24 CC; IC 95% 2,02 a 2,26; diferença = 0,27 ± 0,25 CC; IC 95% 0,10 a 0,36; P = 0,0011). Durante o primeiro ano após o período de carga, o enxerto ósseo permaneceu estável (2,11 ± 0,22 CC; IC 95% 2,02 a 2,24).
A diferença não foi estatisticamente significativa (0,02 ± 0,07 CC; IC 95% 0,01 a 0,04; P = 0,2166).
Os dados estão relatados na Tabela 3.
Os pacientes relataram suas experiências após a cirurgia. O valor médio da dor foi de 0,52 ± 0,74 (faixa 0–3); o valor médio do inchaço foi de 0,27 ± 0,52 (faixa 0–2); e o consumo médio de analgésicos foi de 0,87 ± 4,94 comprimidos (faixa 0–4).
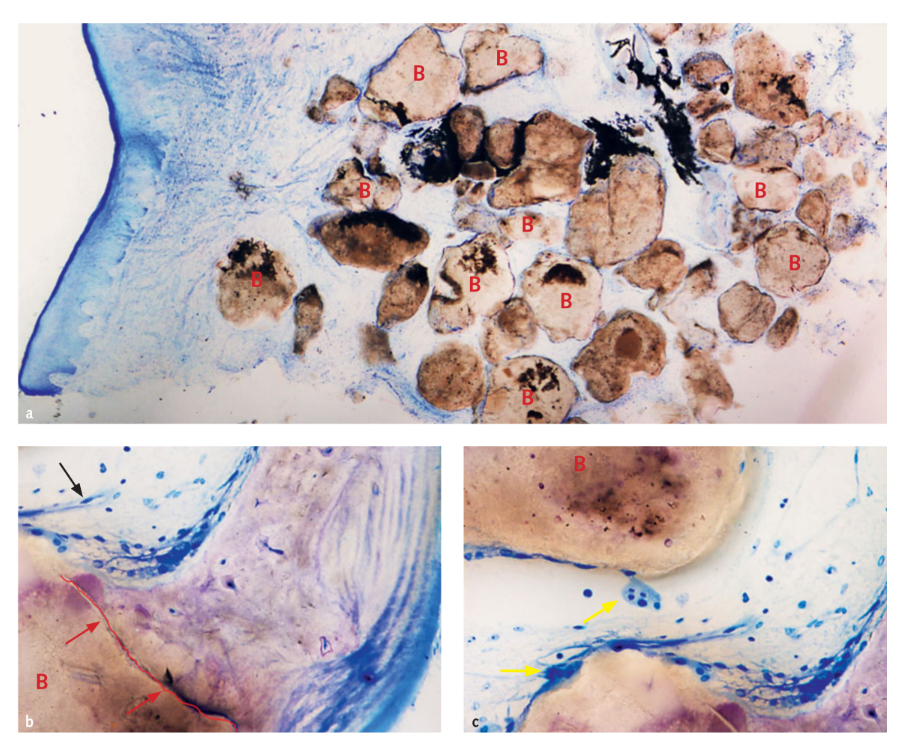
Em três casos onde um implante adjunto foi colocado em etapas, uma amostra de enxerto foi retirada para análise histológica. As análises morfológicas e histomorfométricas mostraram que após 6 meses de cicatrização, todas as amostras apresentavam uma estrutura normal sem a presença de um infiltrado inflamatório (Fig 10). O biomaterial parecia estar cercado por uma matriz mineralizada indicativa de grandes áreas de mineralização tanto em baixa (Fig 10a) quanto em alta ampliação. Na figura 10b, a microfotografia revela o contato próximo entre o enxerto e a nova matriz óssea. Os vasos sanguíneos eram evidentes nos espaços medulares presumivelmente para sustentar o tecido durante as fases de formação e organização (Figs 10b e 10c). Muitas células ósseas foram detectadas, em particular células semelhantes a osteoblastos nas bordas do novo osso trabecular em estreito contato com células osteoclastos durante a fase ativa de formação e remodelação do novo osso (Fig 10c). A análise histomorfométrica mostrou as seguintes frações teciduais (%): osso (osso imaturo + osso maduro): 44,07% ± 4,91; biomaterial residual: 23,98% ± 2,64; espaços medulares: 31,95% ± 3,16.
Discussão
O objetivo do presente estudo prospectivo foi relatar os dados de 1 ano após a carga de um novo sistema de implante que permite a colocação simultânea de enxerto de seio e implante utilizando uma abordagem transcrestal. Como foi projetado como um estudo de coorte prospectivo, a principal limitação é a falta de um grupo de controle. No entanto, o presente estudo é um dos primeiros a avaliar dados clínicos e radiográficos de um procedimento de elevação de seio crestal utilizando um implante dedicado com um canal interno em forma de L 1 ano após a carga. Outra limitação do presente estudo pode ser a tecnologia utilizada para medir a contração do volume ósseo. Embora essa tecnologia permita a sobreposição e segmentação de diferentes volumes ósseos, não há evidência científica presente. Portanto, os dados devem ser interpretados com cautela.
Durante todo o período de acompanhamento, nenhum implante falhou, e apenas uma ruptura de membrana foi registrada, sem outros eventos adversos. Portanto, a principal consideração clínica deste estudo prospectivo foi que a elevação da membrana do seio pode ser realizada com segurança utilizando pressão hidráulica diretamente através do canal do implante, permitindo o enxerto ósseo (também através do canal) e a colocação do implante ao mesmo tempo. A abordagem apresentada pode ser realizada com um mínimo de osso residual de 3 mm entre a crista óssea e o assoalho do seio.
De acordo com a recente revisão Cochrane de Esposito et al sobre procedimentos de elevação de seio, o uso de substituto ósseo é questionável quando mais de 3 mm de altura óssea está presente. No entanto, uma variedade de materiais de enxerto, isoladamente ou em combinação, foram validados para uso eficaz em procedimentos de aumento de seio, incluindo osso autógeno, osso alogênico, osso xeno gênico e materiais aloplásticos (por exemplo, hidroxiapatita [HA], fosfato tricálcico beta [β-TCP]). No presente estudo, foi utilizada uma mistura de 60% de HA e 40% de β-TCP. Um manuscrito provisório relatando os dados de 6 meses após a colocação do implante em 18 pacientes concluiu que uma contração fisiológica de 13,9% do volume original do enxerto foi observada durante o período de cicatrização. O presente estudo analisou o tamanho total da amostra de 30 pacientes relatando uma leve contração óssea de 11,3% durante o período de 6 meses de cicatrização submersa. Depois, o enxerto ósseo permaneceu estável, com uma contração de 0,95%. Uma recente revisão sistemática de Shanbhag et al sobre procedimentos de aumento de seio realizados com uma abordagem lateral convencional relatou reduções nos volumes de aumento durante a cicatrização inicial variando de 18% a 22% ao usar substitutos ósseos, sem diferenças significativas entre os materiais de enxerto. Especificamente, em um ensaio clínico randomizado de Kühl et al, dentro dos primeiros 6 meses de aumento do seio maxilar, o volume diminuiu em 15% para fosfato de cálcio bifásico (BCP, 60% de HA e 40% de β-TCP) e 18% quando os investigadores adicionaram osso autólogo particulado no local do teste, sem diferenças estatisticamente significativas entre os dois grupos. Vários outros estudos também confirmaram uma redução no volume do material de enxerto. Hatano et al sugeriram que o osso autógeno ou substituto ósseo tem uma contração dimensional em altura de 20% até 2 anos. Embora o osso autólogo seja considerado o padrão ouro de acordo com Wiltfang, muitas preocupações estão relacionadas a uma reabsorção imprevisível observada. Esta afirmação foi confirmada por Shanbhag et al em uma revisão sistemática ao usar blocos de osso autólogo que reduziram de volume 45% ao longo do tempo após 6 a 24 meses. Os mesmos autores confirmaram que o osso bovino anorgânico usado isoladamente ou em combinação com osso autólogo mostrou uma mudança de volume de 15% a 21%, sugerindo uma melhor estabilidade de volume em comparação com o osso autólogo isoladamente. Os resultados desses estudos apoiam as conclusões deste estudo.
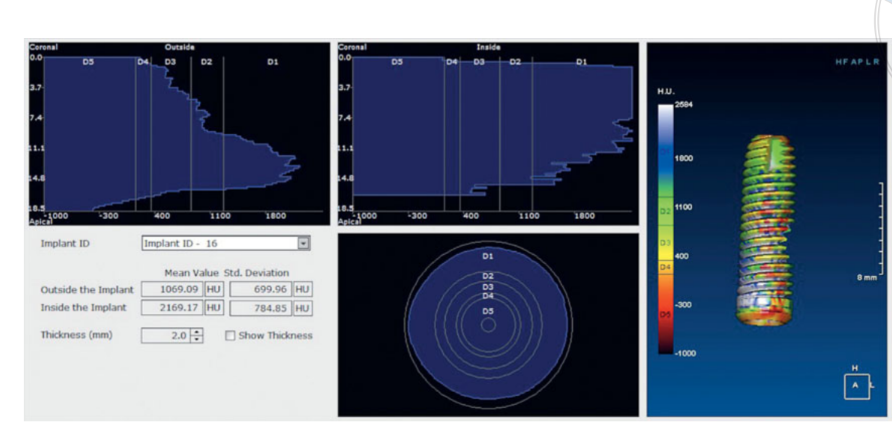
A histologia mostrou que após 6 meses, as amostras foram caracterizadas por 44,07% ± 4,91 de osso em diferentes estágios de mineralização, 23,98% ± 2,64 de partículas de enxerto residuais e 31,95% ± 3,16 de espaços medulares. Embora cerca da metade do material enxertado original ainda estivesse presente 6 meses após a cicatrização submersa, dados radiológicos de um estudo preliminar anterior23 indicaram que a densidade do enxerto melhorou significativamente de 322,0 ± 100,42 Unidades Hounsfield (UH) (faixa: 177–449 UH; IC 95%: 246,4 a 377,6) para 1.062,0 ± 293,7 UH (faixa: 573–1.489 UH; IC 95%: 876,12 a 1.259,88). Essa diferença foi estatisticamente significativa (740,0 ± 295,35 UH; faixa: 324–1.231; IC 95%: 426,04 a 811,96; P = 0,0001).
As Unidades Hounsfield referem-se a uma escala D1-D5, que é baseada em valores de tomografia computadorizada médica e não são completamente confiáveis quando se trata de exames de CBCT. No entanto, de acordo com Cassetta et al, a UH era igual aos valores de densidade em cinza multiplicados por uma razão de conversão de 0,7. Assim, pesquisas preliminares anteriores do presente estudo indicaram uma densidade média do enxerto (Figura 11) comparável a um valor D2 de acordo com a classificação de Lekholm e Zarb. Além disso, dados clínicos mostraram que a média do ISQ na colocação do implante foi de 65,2 ± 5,4 (IC 95% 63,6 a 67,4) e aumentou durante o período de cicatrização, alcançando o valor médio de 73,6 ± 3,7 (IC 95% 73,1 a 75,9; faixa 62–79). A diferença foi estatisticamente significativa (8,4 ± 5,3; IC 95% 5,9 a 39,7; P = 0,0000). Todos esses dados estão de acordo com as altas taxas de sobrevivência dos implantes, sem falhas ocorridas durante todo o período de acompanhamento.
Implantes curtos foram sugeridos como uma alternativa aos procedimentos de elevação do seio maxilar. As vantagens dos implantes curtos incluem uma operação menos tecnicamente exigente, portanto, potencialmente menos complicações e menor custo (sem enxerto ósseo). Dados de vários ensaios clínicos randomizados mostraram que implantes curtos de 4 a 8 mm poderiam ser uma alternativa adequada, mais simples, mais barata e mais rápida em relação a implantes mais longos colocados em osso aumentado. Também foi demonstrado que procedimentos de elevação do seio maxilar usando pressão hidráulica proporcionam alta previsibilidade nos resultados clínicos, juntamente com morbidade extremamente baixa e tecidos cirúrgicos encurtados. Portanto, tanto implantes curtos quanto mais longos colocados em conjunto com elevação hidráulica do seio representam opções de tratamento viáveis. No entanto, ensaios clínicos randomizados são necessários, e os períodos de acompanhamento ainda são muito curtos para tirar conclusões definitivas sobre o melhor tratamento para indicações específicas.
Conclusões
A elevação do assoalho do seio maxilar pode ser realizada com sucesso por meio de uma abordagem transcrestal utilizando um sistema de implante dedicado que permite a elevação hidráulica da membrana de Schneider, injeção de um material de enxerto ósseo fluido e colocação simultânea de implantes dentários, com desconforto mínimo para o paciente. Durante a cicatrização, foi observada uma contração fisiológica de 11,3% do volume original do enxerto ósseo. Após isso, nenhuma redução adicional do volume do enxerto foi observada. Estudos clínicos de longo prazo são necessários para confirmar esses resultados.
Marco Tallarico, David L Cochran, Erta Xhanari, Claudia Dellavia, Elena Canciani, Eitan Mijiritsky, Silvio Mario Meloni
Referências
- Nickenig HJ, Wichmann M, Zoller JE, Eitner S. Elevação lateral do seio maxilar minimamente invasiva em 3-D – um estudo clínico piloto randomizado prospectivo com avaliação cega das mudanças visíveis no volume dos tecidos moles faciais pós-operatórios. J Craniomaxillofac Surg 2014;42:890–895.
- Bechara S, Kubilius R, Veronesi G, Pires JT, Shibli JA, Mangano FG. Implantes dentários curtos (6 mm) versus elevação do assoalho do seio maxilar e colocação de implantes dentários mais longos (≥10 mm): um ensaio controlado randomizado com acompanhamento de 3 anos. Clin Oral Implants Res 2016 Jul 12. doi: 10.1111/clr.12923. [Epub ahead of print].
- Katranji A, Fotek P, Wang HL. Complicações da elevação do seio: Etiologia e tratamento. Implant Dent 2008;17: 339–349.
- Tatum H Jr. Reconstruções de implantes maxilares e de seios. Dent Clin North Am 1986;30:207–229.
- Boyne PJ, James RA. Enxerto do assoalho do seio maxilar com medula e osso autógenos. J Oral Surg 1980;38:613–616.
- Misch CE. Elevação do seio maxilar para implantes endosteais. Planos de tratamento alternativos organizados. Int J Oral Implantol 1987;4:49–58.
- Smiler DG, Holmes RE. Procedimento de elevação do seio utilizando hidroxiapatita porosa: um relatório preliminar. J Oral Implantol 1987;13:239–253.
- Wood R, Moor P. Enxerto do seio maxilar com osso autógeno colhido intraoralmente antes da colocação do implante. Int J Oral Maxillofac Implants 1988;3:209–214.
- Kent JN, Block MS. Enxerto ósseo do assoalho do seio maxilar e colocação de implantes revestidos com hidroxiapatita simultaneamente. J Oral Maxillofac Surg 1989;47:238–242.
- Misch CE, Dietsh F. Materiais de enxerto ósseo na odontologia de implantes. Implant Dent 1993;2:158–167.
- Better H, Slavescu D, Barbu H, Cochran DL, Chaushu G. Dispositivo de implante de elevação do seio minimamente invasivo: resultados preliminares de um ensaio multicêntrico de segurança e eficácia. Clin Implant Dent Relat Res 2014;16:520–526.
- Johansson B, Grepe A, Wannfors K, Hirsch JM. Um estudo clínico das mudanças no volume dos enxertos ósseos na maxila atrófica. Dentomaxillofac Radiol 2001;30:157–161.
- Hallman M, Sennerby L, Zetterqvist L, Lundgren S. Um estudo de acompanhamento prospectivo de 3 anos de próteses fixas suportadas por implantes em pacientes submetidos à elevação do assoalho do seio maxilar com uma mistura de 80:20 de osso bovino desproteinizado e osso autógeno: análise clínica, radiográfica e de frequência de ressonância. Int J Oral Maxillofac Surg 2005;34:273–280.
- Wanschitz F, Figl M, Wagner A, Rolf E. Medição das mudanças de volume após a elevação do assoalho do seio com um hidroxiapatita psicogênica. Int J Oral Maxillofac Implants 2006;21:433–438.
- Kirmeier R, Payer M, Wehrschuetz M, Jakse N, Platzer S, Lorenzoni M. Avaliação das mudanças tridimensionais após a elevação do assoalho do seio com diferentes materiais de enxerto. Clin Oral Implants Res 2008;19:366–372.
- Klijn RJ, van den Beucken JJ, Bronkhorst EM, Berge SJ, Meijer GJ, Jansen JA. Valor preditivo das dimensões da crista na reabsorção do enxerto ósseo autólogo em cirurgia de elevação do seio maxilar em etapas usando Cone-Beam CT. Clin Oral Implants Res 2012;23:409–415.
- Umanjec-Korac S, Wu G, Hassan B, Liu Y, Wismeijer D. Uma análise retrospectiva da taxa de reabsorção do osso bovino desproteinizado como material de enxerto do seio maxilar em tomografia computadorizada de feixe cônico. Clin Oral Implants Res 2014;25:781–785.
- Meloni SM, Jovanovic SA, Lolli FM, Cassisa C, De Riu G, Pisano M, Lumbau A, Luglie PF, Tullio A. Enxerto após elevação do seio com osso bovino anorgânico isoladamente comparado com 50:50 de osso bovino anorgânico e osso autógeno: resultados de um ensaio piloto randomizado após um ano. Br J Oral Maxillofac Surg 2015;53:436–441.
- Frayssinet P, Trouillet JL, Rouquet N, Azimus E, Autefage A. Osseointegração de cerâmicas de fosfato de cálcio macroporosas com diferentes composições químicas. Biomaterials 1993;14:423–429.
- Daculsi G, Laboux O, Malard O, Weiss P. Estado atual das biocerâmicas de fosfato de cálcio bifásicas. J Mater Sci Mater Med 2003;14:195–200.
- Le Nihouannen D, Saffarzadeh A, Aguado E, Goyenvalle E, Gauthier O, Moreau F, Pilet P, Spaethe R, Daculsi G, Layrolle P. Propriedades osteogênicas de cerâmicas de fosfato de cálcio e compósitos à base de cola de fibrina. J Mater Sci Mater Med 2007;18:225–235.
- Esposito M, Felice P, Worthington HV. Intervenções para substituir dentes ausentes: procedimentos de aumento do seio maxilar. Cochrane Database Syst Rev 2014;13:CD008397.
- Tallarico M, Meloni SM, Xhanari E, Pisano M, Cochran DL. Procedimento de elevação do seio minimamente invasivo utilizando um dispositivo de implante de elevação hidráulica dedicado: um estudo de série de casos prospectivo sobre resultados clínicos, radiológicos e centrados no paciente. Int J Periodontics Restorative Dent 2017;37: 125–135.
- Tallarico M, Better H, De Riu G, Meloni SM. Um novo sistema de implante dedicado à elevação hidráulica da membrana de Schneider e simultaneamente ao aumento do enxerto ósseo: um estudo clínico retrospectivo de até 45 meses. J Craniomaxillofac Surg. 2016;44:1089–1094.
- Shanbhag S, Shanbhag V, Stavropoulos A. Mudanças de volume das elevações do seio maxilar ao longo do tempo: uma revisão sistemática. Int J Oral Maxillofac Implants 2014;29:881–892.
- Kühl S, Payer M, Kirmeier R, Wildburger A, Acham S, Jakse N. A influência do osso autógeno particulado na estabilidade de volume precoce dos enxertos do seio maxilar com fosfato de cálcio bifásico: um ensaio clínico randomizado. Clin Implant Dent Relat Res 2015;17:173–178.
- Hatano N, Shimizu Y, Ooya K. Uma avaliação radiográfica clínica de longo prazo das mudanças na altura do enxerto após a elevação do assoalho do seio maxilar com uma mistura de osso autógeno/xenógeno de 2:1 e colocação simultânea de implantes dentários. Clin Oral Implants Res 2004;15:339–345.
- Wiltfang J, Schultze-Mosgau S, Nkenke E, Thorwarth M, Neukam FW, Schlegel KA. Aumento onlay versus procedimento de elevação do seio no tratamento da maxila severamente reabsorvida: um estudo longitudinal comparativo de 5 anos. Int J Oral Maxillofac Surg 2005;34:885–889.
- Lekholm U, Zarb GA. Seleção e preparação do paciente. In: Brånemark PI, Zarb GA, Albrektsson T, editores. Prótese integrada aos tecidos: osseointegração na odontologia clínica. Chicago: Quintessence Publishing Co. 1985;1–356.
- Cassetta M, Stefanelli LV, Pacifici A, Pacifici L, Barbato E. Quão precisa é a CBCT na medição da densidade óssea? Um estudo comparativo in vitro de CBCT-CT. Clin Implant Dent Relat Res 2014;16:471–478.
- Esposito M, Pellegrino G, Pistilli R, Felice P. Reabilitação de mandíbulas edêntulas atróficas posteriores: próteses suportadas por implantes curtos de 5 mm ou por implantes mais longos em osso aumentado? Resultados de um ano de um ensaio clínico randomizado piloto. Eur J Oral Implantol 2011;4:21–30.
- Pistilli R, Felice P, Cannizzaro G, Piatelli M, Corvino V, Barausse C, Buti J, Soardi E, Esposito M. Mandíbulas posteriores atróficas reabilitadas com próteses suportadas por implantes de 6 mm de comprimento e 4 mm de largura ou por implantes mais longos em osso aumentado. Resultados de um ano após a carga de um ensaio clínico randomizado piloto. Eur J Oral Implantol 2013;6:359–372.
- Pistilli R, Felice P, Piattelli M, Gessaroli M, Soardi E, Barausse C, Buti J, Corvino V. Mandíbulas posteriores atróficas reabilitadas com próteses suportadas por implantes de 5 x 5 mm com uma nova superfície de titânio incorporada com nanoestrutura de cálcio ou por implantes mais longos em osso aumentado. Resultados de um ano de um ensaio clínico randomizado controlado. Eur J Oral Implantol 2013;6:343–357.
- Gulje FL, Raghoebar GM, Vissink A, Meijer HJ. Coroas unitárias na maxila posterior reabsorvida suportadas por implantes de 6 mm ou por implantes de 11 mm combinados com cirurgia de elevação do assoalho do seio: um ensaio controlado randomizado de 1 ano. Eur J Oral Implantol 2014;7:247–255.
- Esposito M, Barausse C, Pistilli R, Sammartino G, Grandi G, Felice P. Implantes curtos versus aumento ósseo para colocação de implantes mais longos em maxilas atróficas: resultados de um ano após a carga de um ensaio clínico randomizado piloto. Eur J Oral Implantol 2015;8:257–268.
- Esposito M, Pistilli R, Barausse C, Felice P. Resultados de três anos de um ensaio clínico randomizado comparando próteses suportadas por implantes de 5 mm de comprimento ou por implantes mais longos em osso aumentado em mandíbulas edêntulas atróficas posteriores. Eur J Oral Implantol 2014;7:383–395.