Uma revisão sistemática sobre a definição de periimplantite: Limites relacionados aos diversos diagnósticos propostos
Tradução automática
O artigo original está escrito em EN language (link para lê-lo) .
Resumo
Objetivo: O objetivo desta revisão sistemática abrangente foi apresentar as diferentes definições de periimplantite propostas na literatura.
Materiais e métodos: Pesquisas eletrônicas e manuais na literatura foram conduzidas por três revisores independentes para identificar manuscritos que relatassem dados sobre a definição de periimplantite com diagnóstico clínico, escritos em inglês e publicados até outubro de 2015. Várias bases de dados foram referenciadas, incluindo PubMed, Embase, a Biblioteca Cochrane e a Base de Dados de Literatura Cinza.
Resultados: Quarenta e nove artigos foram considerados adequados para a revisão. As evidências atuais sugerem o uso de definições de caso inequívocas para periimplantite, definidas por alterações no nível do osso crestal, presença de sangramento à sondagem e/ou supuração, com ou sem aprofundamento concomitante de bolsas periimplantares. No entanto, vários pontos de referência foram utilizados para medir essas alterações, incluindo diferentes níveis de gravidade e anos de acompanhamento.
Conclusão: A literatura científica disponível sugere a ausência de uma definição unânime de periimplantite. Estudos futuros que apliquem definições de casos consistentes devem ser considerados.
Introdução
O termo “periimplantite” foi introduzido no início da década de 1960 para descrever condições patológicas infecciosas do tecido periimplantário. Hoje, a periimplantite é a complicação mais frequente dos implantes dentários e ocorre com uma frequência que varia de 1% a 47% em nível de implante. Diferente da mucosite periimplantária (definida como a presença de infiltrado inflamatório reversível de tecido mole, sem perda óssea adicional além da remodelação óssea fisiológica inicial), a periimplantite tem sido descrita como caracterizada por um processo inflamatório ao redor de um implante, incluindo tanto a inflamação do tecido mole quanto a perda progressiva de osso de suporte além da remodelação óssea crestal fisiológica. No entanto, como destacado em revisões recentes da literatura e conferências de consenso, diferentes definições de periimplantite foram relatadas. Isso pode ser devido em parte à falta de consenso sobre terminologia, etiologia, diagnóstico e sistemas de prognóstico.
A periimplantite foi descrita como uma doença com um componente infeccioso que é semelhante à periodontite crônica. O 8º Workshop Europeu sobre Periodontologia concordou que as definições publicadas em 200810 e 20118 devem ser adotadas. A definição sugerida deve incluir o seguinte: alterações no nível do osso crestal, sangramento positivo à sondagem (BOP) e/ou supuração (SUP), com ou sem a presença concomitante de bolsas periimplantares (profundidade da bolsa de sondagem, PPD). Hoje em dia, embora a acumulação de placa ainda seja considerada o principal fator etiológico, foi demonstrado que existem outros fatores de risco potenciais relacionados à doença, incluindo fatores do paciente, cirúrgicos e protéticos que podem certamente contribuir para seu desenvolvimento.
No banco de dados MeSH (Medical Subject Headings), o termo “periimplantite” foi introduzido em 2011 e definido como um processo inflamatório com perda de osso de suporte no tecido ao redor de implantes dentários funcionais. Apesar dessa definição de doença ser muito clara e abrangente, inconsistências e confusões surgem na aplicação da terminologia clinicamente. Todos esses fatores juntos levaram a diferentes interpretações e definições dessa doença emergente comum. Além disso, recentemente, a hipótese da reação não infecciosa do corpo estranho complicou ainda mais a compreensão dessa questão. O objetivo da presente revisão sistemática foi apresentar as diferentes definições de periimplantite propostas na literatura.
Materiais e métodos
O presente artigo foi preparado em cumprimento parcial a uma declaração de consenso realizada em Roma, Itália, em janeiro de 2016. Esta revisão sistemática foi escrita de acordo com as diretrizes PRISMA (Itens de Relato Preferenciais para Revisões Sistemáticas e Meta-Análises) (http://www.prisma-statement.org/PRISMAStatement/PRISMA-Statement.aspx).
A questão focada foi: Existe uma definição unânime de periimplantite, incluindo diagnóstico clínico. A questão de pesquisa foi adaptada ao formato PICO:
P = população: pacientes humanos derivados de estudos clínicos, revisões sistemáticas, revisões narrativas, declarações de consenso, comentários ou editoriais, que apresentaram pelo menos um implante dentário em função por um mínimo de um ano, afetados por periimplantite;
I = intervenção: dados clínicos coletados com o objetivo de estabelecer a gravidade da doença periimplantar e de definir novos critérios para classificar doenças periimplantares;
C = comparador/controle: resultados clínicos da periimplantite comparados com sinais clínicos de periodontite, bem como com pacientes saudáveis;
O = resultados: parâmetros clínicos e avaliação radiográfica da periimplantite: BOP, PPD, índice de sangramento, presença de SUP e perda óssea marginal (MBL).
Estratégia de busca
Uma estratégia de busca inicial abrangendo a literatura em inglês de 1967 até outubro de 2015 foi realizada online para identificar estudos relevantes que atendiam aos critérios de inclusão. As seguintes bases de dados eletrônicas foram consultadas: a base de dados PubMed da Biblioteca Nacional de Medicina dos EUA, Embase (Excerpta Medica dataBASE) e a Biblioteca Cochrane. De acordo com a lista de verificação AMSTAR (A Measurement Tool to Assess Systematic Reviews), a Base de Dados de Literatura Cinza foi examinada no Relatório de Literatura Cinza da Academia de Medicina de Nova York para encontrar possíveis trabalhos não publicados. A triagem foi realizada de forma independente e simultânea por dois examinadores (MT e AM). Um terceiro revisor (LC) reavaliou os estudos incluídos e excluídos. As bases de dados eletrônicas foram pesquisadas usando uma combinação de palavras-chave booleanas, incluindo MeSH e vários termos em texto livre (Tabela 1).
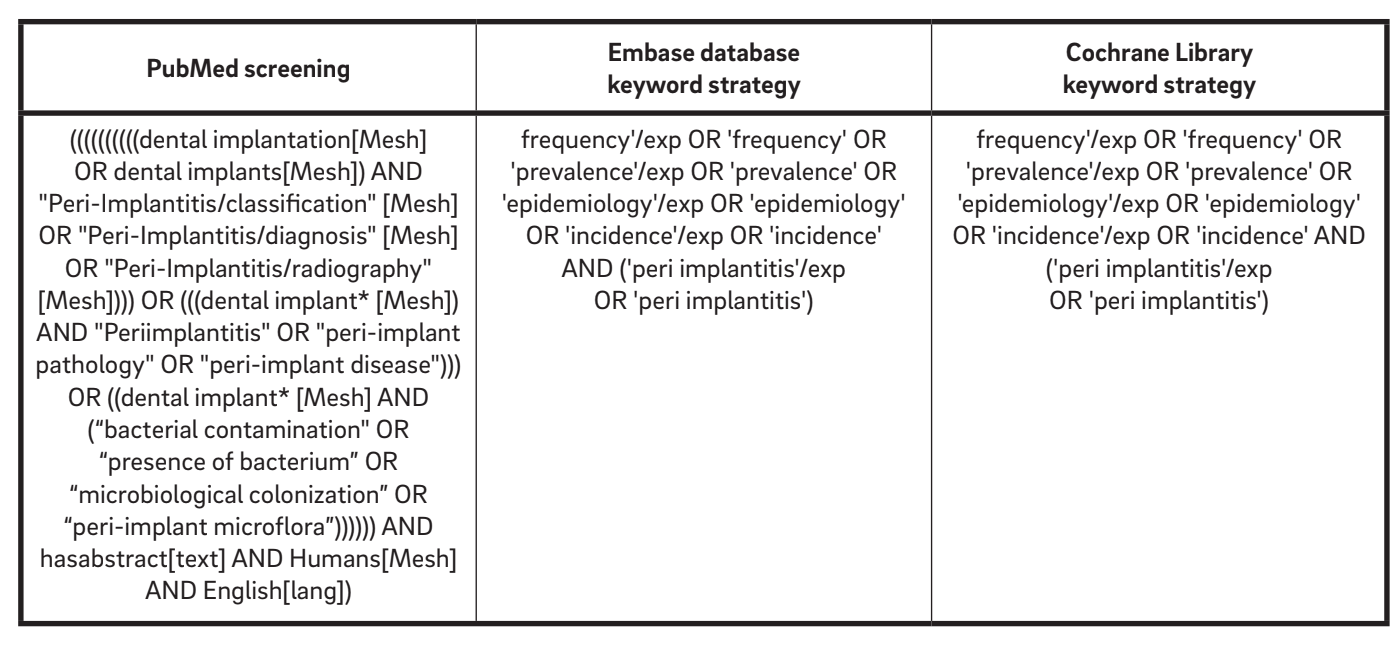
Critérios de elegibilidade
Os seguintes critérios de inclusão foram definidos para a seleção de artigos:
- escritos em inglês;
- envolvendo exame clínico de pacientes humanos;
- ensaios clínicos controlados randomizados de implantes com ≥ 1 ano de função;
- estudos de coorte prospectivos e retrospectivos de implantes com ≥ 1 ano de função;
- estudos transversais com ≥ 1 ano de função; e
- revisões sistemáticas, revisões narrativas, declarações de consenso, comentários ou editoriais.
Artigos foram excluídos se fossem
- estudos com animais;
- in vitro estudos;
- relatórios de locais e/ou condições comprometidos localmente ou sistemicamente;
- relatórios com < 15 casos;
- relatórios envolvendo mini-implantes, implantes de uma peça ou implantes em lâmina; ou
- relatórios sobre implantes < 1 ano de função.
Artigos sem resumos, mas com títulos relacionados aos objetivos desta revisão foram selecionados para que o texto completo pudesse ser analisado quanto à elegibilidade. Os textos completos foram obtidos para todos os resumos e títulos que pareciam atender aos critérios de inclusão e foram avaliados para inclusão pelos mesmos dois examinadores. As listas de referências dos estudos selecionados foram analisadas em busca de artigos adicionais que pudessem atender aos critérios de elegibilidade do estudo. Além disso, buscas manuais nas listas de referências de revisões sistemáticas selecionadas foram realizadas, limitadas às seguintes revistas: Clinical Implant Dentistry and Related Research, Clinical Oral Implants Research, International Journal of Oral and Maxillofacial Implants, Journal of Clinical Periodontology e Journal of Periodontology. Qualquer desacordo entre os dois revisores foi resolvido após uma discussão adicional. Além disso, o acordo entre os investigadores foi calculado na segunda etapa. Um revisor final (LC) avaliou possíveis inconsistências entre os dois revisores. Todos os textos completos dos artigos selecionados foram armazenados em pastas compartilhadas acessíveis a todos os revisores.
Avaliação qualitativa dos parâmetros para definir periimplantite
Uma avaliação descritiva foi realizada para analisar qualitativamente a gama de parâmetros considerados para definir a periimplantite como uma condição inflamatória irreversível que resulta na destruição de tecidos duros. Assim, os seguintes parâmetros comuns foram avaliados: PPD, BOP, SUP e MBL radiográfico. Esses parâmetros dos vários artigos foram agrupados para analisar a variância ou uniformidade entre as definições de casos relatados de periimplantite. Gráficos para apresentar a variância foram gerados. Enquanto o PPD foi classificado em três grupos diferentes (< 3 mm, 3–5 mm e > 5 mm), o MBL radiográfico foi categorizado em quatro faixas principais, dependendo da referência principal considerando a entrega da prótese como a linha de base: ≤ 1 mm, > 1–2 mm, > 3–4 mm e ≥ 5 mm.
Resultados
Processo de triagem
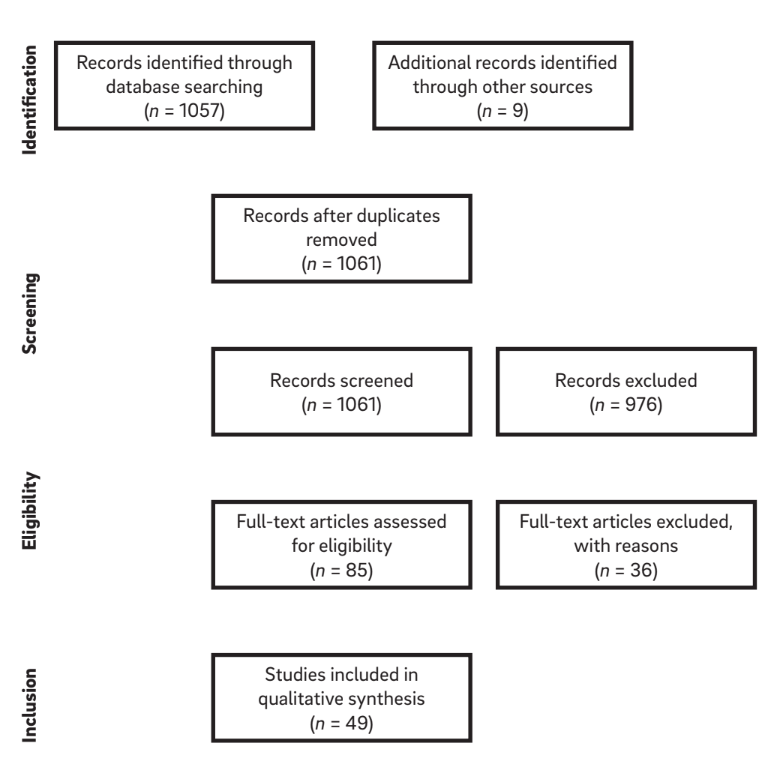
As combinações de termos de busca e uma busca manual de referências em artigos selecionados resultaram em uma lista de 1.061 títulos. Desses, 976 artigos foram excluídos com base na avaliação do título e resumo, deixando 85 artigos elegíveis para inclusão (k = 0,84). Após a aplicação dos critérios de elegibilidade, um total de 49 artigos foram considerados para revisão. Após a seleção e leitura dos artigos completos, as informações relevantes de cada artigo foram extraídas. Um diagrama da estratégia de busca é mostrado na Figura 1.
Definições de “periimplantite”
Dezoito manuscritos, incluindo revisões narrativas e sistemáticas, declarações de consenso e artigos originais, foram selecionados e os dados foram extraídos. Em 1965, Levignac relatou uma inflamação de tecido mole periimplantar com subsequente destruição do osso e a rotulou de “periimplantite.” Em 1987, Mombelli et al. descreveram a periimplantite como uma doença infecciosa que compartilha características com a periodontite crônica. O mesmo autor enfatizou a natureza infecciosa dessa condição patológica, focando na carga bacteriana da superfície do implante e na subsequente aparição de uma reação inflamatória de tecido mole adjacente aos implantes dentários que às vezes resultava na perda de osso de suporte. Assim como a periodontite, a etiopatogenia da periimplantite foi mostrada como desencadeada por infecção bacteriana que ativa uma cascata de citocinas, levando à perda óssea inflamatória.
“Periimplantite” tornou-se um termo aceito no relatório de consenso do 1º Workshop Europeu sobre Periodontologia em 1993. Foi descrita como uma reação inflamatória destrutiva irreversível ao redor de implantes em função que resulta na perda de osso de suporte. O 6º Workshop Europeu sobre Periodontologia apresentou uma definição modificada, não apenas para reconhecer que a periimplantite é uma condição tratável, mas também para incluir o termo coletivo “doença peri-implante” tanto para mucosite periimplantar quanto para periimplantite.
Para melhorar a qualidade da pesquisa sobre doenças periimplantares, o 7º Workshop Europeu sobre Periodontologia recomendou o uso de definições de caso inequívocas: mudanças no nível do osso crestal e presença de BOP e/ou SUP, com ou sem aprofundamento concomitante de bolsas peri-implantares.8 Finalmente, a Academia Americana de Periodontologia em 2013 definiu “periimplantite” como uma reação inflamatória associada à perda de osso de suporte além da remodelação óssea biológica inicial ao redor de um implante em função.
A extensão e a gravidade das doenças periimplantares raramente foram relatadas. Froum e Rosen propuseram uma combinação de BOP e/ou SUP, PPD e a extensão da MBL radiográfica ao redor do implante para classificar a periimplantite em categorias de doença inicial, moderada ou avançada. Da mesma forma, Decker et al. propuseram um sistema de prognóstico baseado no diagnóstico para cada categoria seguindo a classificação de prognóstico de Kwok e Caton para dentição natural. Em seu estudo, os autores afirmaram que PPD, extensão da MBL radiográfica, presença de SUP e mobilidade do implante foram considerados os fatores mais críticos para categorizar os casos como tendo um prognóstico favorável, questionável, desfavorável ou sem esperança.
Recentemente, Albrektsson et al. modificaram o conceito de periimplantite como uma perda de osso ao redor de um implante como uma reação de corpo estranho clinicamente desfavorável e desbalanceada, afirmando especificamente que a osseointegração é um processo pelo qual o osso reage ao implante dentário formando uma estrutura calcificada adjacente a ele. De fato, às vezes, essa reação de corpo estranho pode resultar em atividade osteoclástica que pode destruir o osso de suporte. Os autores acreditam que o termo “periimplantite” é bastante apropriado, pois não é uma doença primária, mas uma complicação de uma reação de corpo estranho clinicamente desfavorável e desbalanceada que é o ponto de partida do processo patológico e das consequentes sequelas teciduais.
Atualmente, conforme previsto pelo consenso do 7º Workshop Europeu sobre Periodontologia, assume-se que a infecção em si é sempre causada pela placa e seus produtos; no entanto, numerosos fatores de risco são reconhecidos como especificamente associados à periimplantite, como fatores relacionados à cirurgia ou à prótese, características do implante, tabagismo e resposta do hospedeiro.
Definição de periimplantite com diagnóstico clínico e radiográfico
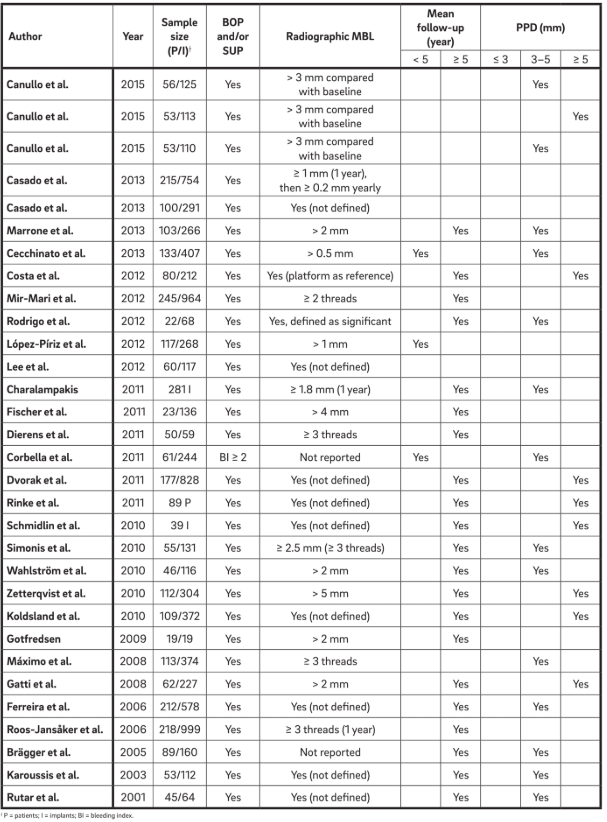
Trinta e um manuscritos (Tabela 2) foram selecionados e os dados foram extraídos. Informações de 1.711 pacientes com 5.432 implantes foram analisadas. O termo “periimplantite” tem sido geralmente usado para descrever qualquer implante com diferentes graus de perda óssea, e uma definição clara não foi apresentada ou foi extraída diretamente da terminologia.
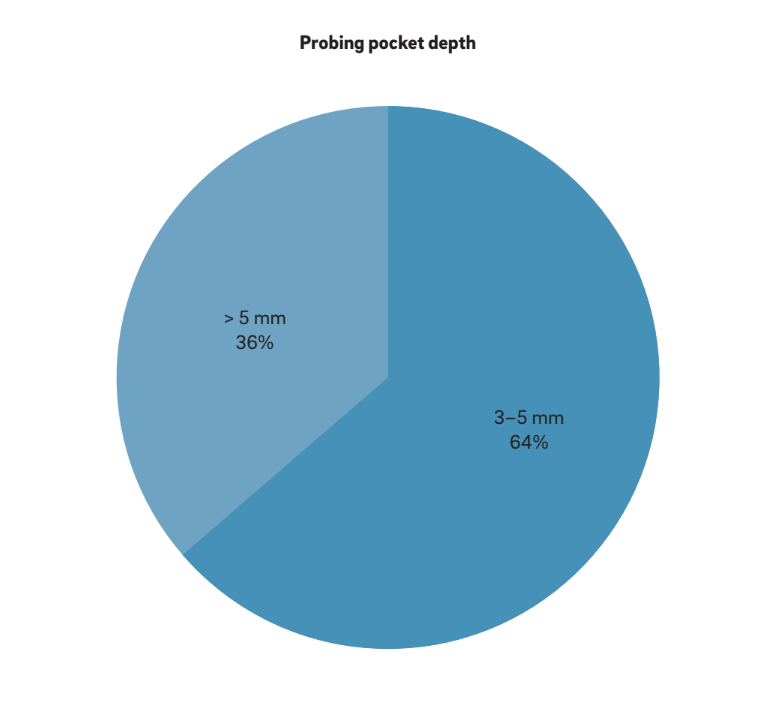
Quatro características principais foram usadas para definir “periimplantite”. Curiosamente, todos os autores consideram BOP e SUP como indicadores de periimplantite. Essa abordagem considera a periimplantite induzida puramente por placa e corpos estranhos, onde uma resposta inflamatória é frequentemente desencadeada pelo biofilme ou seus produtos e/ou substâncias estranhas, como cimento residual. Além disso, 22 estudos relataram claramente PPD como um parâmetro crucial para determinar a periimplantite. Nenhum estudo considerou PPD < 3 mm como indicativo de periimplantite. Enquanto a grande maioria (64%) dos estudos definiu PPD = 3–5 mm como indicativo de periimplantite, os 36% restantes consideraram PPD > 5 mm como referência (Fig. 2). Um MBL radiográfico ≥ 0,5–1 mm, > 1–2 mm, > 3–4 mm e ≥ 5 mm, considerando a entrega da prótese como base, foi considerado como definidor de periimplantite em 15%, 45%, 35% e 5% dos estudos, respectivamente (Fig. 3). Assim, especulou-se que um MBL radiográfico < 1 mm deveria ser considerado como remodelação óssea fisiológica.
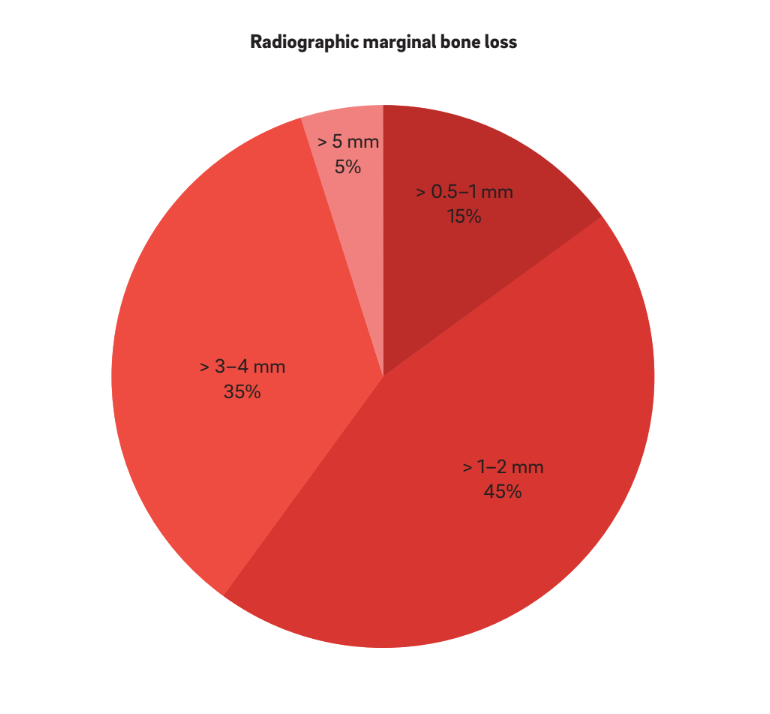
BOP e/ou SUP foram pré-requisitos em todos os estudos analisados. Na maioria dos estudos, a combinação de medições clínicas e radiográficas foi utilizada para a definição de casos. Em dois estudos prospectivos, o MBL radiográfico não foi relatado, e apenas medições clínicas foram utilizadas para avaliar complicações biológicas. Nesses casos, a presença de BOP e/ou SUP na sondagem e PPD ≥ 4 mm foram pré-requisitos para um diagnóstico de periimplantite. Em nove estudos, um ensaio clínico randomizado, três estudos prospectivos e cinco estudos retrospectivos, BOP e avaliações radiográficas foram realizadas isoladamente, sem relatar quaisquer medições de PPD. Nesses casos, um MBL variando de 0,5 mm a > 4 mm34 foi considerado associado à periimplantite.
Antes de 2012, mudanças no nível do osso crestal não eram definidas ou não eram claramente relatadas, dificultando o diagnóstico de periimplantite. No entanto, mesmo em estudos que definiram a entidade de MBL, diferentes critérios diagnósticos foram utilizados. Em um estudo de longo prazo, a periimplantite foi definida como a presença de BOP, PPD ≥ 4 mm e MBL > 0,5 mm. No entanto, outro estudo utilizou MBL > 4 mm como valor de referência.34 A maioria dos estudos considerou MBL > 2 mm para o diagnóstico de periimplantite. Anteriormente, nosso grupo utilizou um MBL radiográfico > 3 mm, a partir da radiografia de base realizada no momento da entrega da prótese, para diagnosticar periimplantite. Em outros três estudos, o MBL foi considerado em relação ao tempo que a prótese estava em função. Todos os estudos, exceto cinco, calcularam MBL em milímetros. Nos outros estudos, as roscas do implante foram utilizadas como referência.
Oito estudos aplicaram PPD > 5 mm para o diagnóstico de periimplantite. Marrone et al. definiram periimplantite como a presença de BOP, PPD > 5 mm e MBL > 2 mm. Charalampakis et al. aplicaram os critérios da presença de BOP e/ou SUP, PPD ≥ 5 mm e MBL ≥ 1,8 mm após um ano em função. Zetterqvist et al. incluíram casos de PPD > 5 mm e MBL ≥ 3 mm. Dois outros estudos, um prospectivo e um retrospectivo, aplicaram a presença de BOP e/ou SUP, PPD > 5 mm e sinais radiográficos de MBL, sem especificar o nível ósseo basal. BOP positivo e/ou SUP, MBL radiográfico ≥ 3 mm e PPD ≥ 6 mm foram utilizados por Koldsland et al.
No 7º e 8º Workshop Europeu sobre Periodontologia, a mucosite periimplantar e a periimplantite foram descritas da seguinte forma: “mudanças no nível do osso crestal, presença de sangramento à sondagem e/ou supuração; com ou sem aprofundamento concomitante das bolsas periimplantares.” A mucosite periimplantar foi definida com BOP positivo e/ou SUP e a periimplantite com BOP positivo e/ou SUP, em combinação com MBL radiográfico ≥ 2 mm. Os mesmos parâmetros foram utilizados por Zitzmann e Berglundh para definir a periimplantite. No entanto, Atieh et al. usaram os mesmos critérios, além de PPD ≥ 5 mm, como a definição de periimplantite em seu artigo de revisão sistemática.
Discussão
As doenças periimplantares apresentam-se em duas formas: mucosite periimplantar e periimplantite. Ambas são caracterizadas por uma reação inflamatória no tecido ao redor de um implante. A mucosite periimplantar foi definida como uma reação inflamatória reversível no tecido mole ao redor de um implante em função, enquanto a periimplantite foi definida como uma lesão inflamatória mais profunda caracterizada por um bolso periimplantar aprofundado e perda de osso de suporte ao redor de um implante funcional.
Estudos publicados no início de 2010 sugeriram que mucosite e periimplantite são equivalentes à periodontite, uma vez que ambas são descritas como um desequilíbrio entre a carga bacteriana e a resposta do hospedeiro. Com base nisso, ambas as doenças estão intimamente relacionadas à formação de um biofilme contendo microbiota rica em bactérias Gram-negativas na presença de um hospedeiro suscetível. No entanto, foi demonstrado que microrganismos podem estar presentes, mas não são uma necessidade para a periimplantite. Além disso, tanto a periodontite quanto a periimplantite compartilham vários fatores de risco ou indicadores sistêmicos comuns (por exemplo, tabagismo, má higiene oral, diabetes ou histórico de periodontite, osteoporose). Da mesma forma, a periimplantite, assim como ocorre com a periodontite, parece ser influenciada por um perfil genético particular (ou seja, polimorfismo da interleucina-1). Outros rejeitaram a descrição de uma doença comparável à periodontite, devido às diferenças anatômicas que existem entre as estruturas periodontais e periimplantares (por exemplo, orientação diferente das fibras de colágeno [perpendicular vs. horizontal], vascularidade ou capacidade de reparo, e a resiliência mecânica proporcionada pelo ligamento periodontal). De fato, a periodontite é caracterizada pela destruição inflamatória do aparato de suporte da dentição (periodonto), incluindo o ligamento periodontal e o osso alveolar. Devido à composição diferente dos dois tecidos de suporte, reações teciduais semelhantes ao redor de um implante e de um dente parecem muito improváveis. O termo “osseo-insuficiência” foi proposto por Zarb e Koka para descrever a diferença entre a periimplantite e a perda óssea induzida pela periodontite. A imagem anatômica da reabsorção óssea devido à periodontite ou periimplantite difere, em muitas situações, com crateras ósseas muito amplas sendo típicas para o implante, mas não para o dente. Portanto, a periimplantite pode ser considerada distinta da periodontite, na medida em que difere significativamente em relação ao início e à progressão e tem baixa previsibilidade de tratamento; consequentemente, seu tratamento deve ser focado no diagnóstico precoce e no controle dos fatores de risco ou indicadores para preveni-la.
Até o momento, não existem parâmetros padronizados para diferenciar clinicamente os vários estágios e severidades da periimplantite. Os critérios utilizados para diagnosticar a periimplantite permanecem inconclusivos. A maioria dos estudos existentes utilizou parâmetros clínicos em combinação com achados radiográficos para definir a periimplantite. No entanto, parâmetros clínicos como BOP e PPD ao redor dos implantes são menos previsíveis, uma vez que são influenciados por mais fatores de confusão em comparação com a dentição natural. Além disso, qualquer fator que facilite a formação de placa (por exemplo, higiene bucal precária) ou a capacidade de defesa do hospedeiro (por exemplo, hábito de fumar, consumo excessivo de álcool, características genéticas, histórico de periodontite ou uso de bisfosfonatos) pode contribuir para o desenvolvimento da periimplantite. O diagnóstico e a progressão da periimplantite podem ser caracterizados por medições aumentadas para parâmetros clínicos (PPD, BOP, SUP ou até mesmo mobilidade), MBL e microbiologia. Em relação aos parâmetros clínicos, o PPD é um método de avaliação válido, uma vez que existe correlação entre os níveis ósseos registrados e a penetração do sonda radiográfica. No entanto, em um estudo transversal, os níveis ósseos periimplantares medidos intraoperatoriamente eram mais apicais do que os níveis ósseos radiográficos. O SUP ocorre com mais frequência em implantes com perda óssea progressiva do que em implantes sem perda óssea, particularmente em fumantes, e pode estar associado a episódios de destruição ativa do tecido. Em uma revisão sistemática, Berglundh et al. definiram a periimplantite como tendo um PPD ≥ 6 mm ou MBL ≥ 2,5 mm. Lang e Berglundh, no consenso da Federação Europeia de Periodontologia de 2011, afirmaram que dados clínicos e radiográficos devem ser obtidos rotineiramente após a instalação da prótese em implantes, a fim de estabelecer uma linha de base para o diagnóstico da periimplantite durante a manutenção de pacientes com implantes. Uma meta-análise de Derks e Tomasi mostrou claramente uma relação positiva entre a prevalência de periimplantite e o tempo de função. A presença de perda óssea e PPD isoladamente pode não ser suficiente para estabelecer um diagnóstico de periimplantite. Um fator importante que potencialmente influencia a ampla gama de prevalência da periimplantite é a falta de consenso em relação aos parâmetros clínicos. Por exemplo, um estudo relatou que se PPD > 4 mm fosse utilizado como critério, então 74,8% dos indivíduos tinham periimplantite, mas se essa medição fosse alterada para > 6 mm, a prevalência caiu para 43,9%. Quando o MBL radiográfico foi considerado para definir a periimplantite, 25,3% dos indivíduos mostraram > 2 mm, enquanto 13,1% tinham > 3 mm. De fato, se o PPD for considerado, pode-se encontrar uma heterogeneidade adicional. A sondagem ao redor dos implantes é influenciada por muitos fatores, como o tamanho da sonda, a força de sondagem, a direção da sonda, a saúde e a espessura do tecido mole periimplantar, e o design do pescoço do implante e da superestrutura.1 De fato, o design de plataforma switch, bem como restaurações defeituosas, podem complicar a sondagem e, assim, ocultar a verdadeira extensão da periimplantite. Além disso, a presença de discrepâncias nos níveis de tecido duro e mole bucolingual pode resultar em diferentes leituras de PPD.
Devido à falta de parâmetros padrão para determinar a presença e a gravidade da doença periimplantar, é difícil desenvolver uma estratégia clínica baseada na PPD para gerenciar esse problema comum na odontologia de implantes. No entanto, Froum e Rosen propuseram um sistema de classificação para determinar a gravidade da periimplantite com base na PPD, MBL e sinais clínicos de BOP e/ou SUP,28 mas esse sistema ainda precisa ser validado. Além disso, em uma série de estudos de Merli et al., o acordo entre avaliadores no diagnóstico da doença periimplantar foi considerado apenas bom, devido à definição pouco clara de periimplantite e mucosite, com concordância completa obtida apenas em metade dos casos (52%).
A grande maioria (45%) dos estudos incluídos na presente revisão encontrou MBL radiográfico > 1–2 mm após a carga protética. Portanto, os seguintes critérios para definir a periimplantite são propostos: um MBL radiográfico > 1 mm após a entrega da prótese do implante ou 2 mm pelo menos seis meses após a colocação da prótese do implante como um bom indicador de periimplantite. O BOP não possui um alto valor preditivo devido à fraca conexão de tecido mole ao redor dos implantes dentários. Da mesma forma, a PPD depende em grande parte do design do implante (nível ósseo vs. nível de tecido), posição apicocoronária e biotipo. A partir dos dados extraídos, parece lógico considerar o MBL radiográfico como o indicador mais uniforme e preciso de periimplantite. Embora o valor de corte dependa do padrão inflamatório do paciente, do tipo de cirurgia, da posição apicocoronária do implante, do macrodesign do implante e do módulo crestal, considerando a rápida progressão da doença ao longo do tempo, um controle radiográfico rigoroso deve ser seguido se qualquer sintoma clínico for detectado. Além disso, o clínico deve usar uma combinação dos muitos parâmetros clínicos disponíveis, como PPD, estado inflamatório da mucosa, BOP em sondagem leve, MBL radiográfico e possivelmente biomarcadores bacterianos e/ou de fluido crevicular periimplantar para estabelecer um diagnóstico preciso de periimplantite. Ao contrário do caso da periodontite, os testes bacterianos podem não ser confiáveis no diagnóstico da periimplantite. Isso sugere que os ecossistemas periodontal e periimplantar diferem significativamente e, portanto, a doença periimplantar pode não ser sempre abordada como uma doença infecciosa. Da mesma forma, tal diferença foi mostrada para se aplicar à patogênese. Além disso, nenhuma evidência foi encontrada de que a infecção primária causou reabsorção óssea marginal.
Conclusão
A literatura científica disponível sugere a ausência de uma definição unânime de periimplantite. As definições atuais de periimplantite foram baseadas exclusivamente em parâmetros clínicos, sem considerar outros potenciais fatores de risco relacionados à doença. Estudos futuros que apliquem definições de caso consistentes devem ser considerados.
Marco Tallarico, Alberto Monje, Hom-Lay Wang, Pablo Galindo Moreno, Erta Xhanarid & Luigi Canulloe
Referências
- Levignac J. [Osteólise periimplantária— periimplantose—periimplantite]. Rev Fr Odontostomatol. 1965 Out;12(8):1251–60. Francês.
- Hämmerle CH, Glauser R. Avaliação clínica do tratamento com implantes dentários. Periodontol 2000. 2004 Fev;34:230–9.
- Schwarz F, Becker K, Sager M. Eficácia da remoção de placa administrada profissionalmente com ou sem medidas adjuntas para o tratamento da mucosite peri-implantar. Uma revisão sistemática e meta-análise. J Clin Periodontol. 2015 Abr;42 Suppl 16:S202–13.
- Atieh MA, Alsabeeha NH, Faggion CM, Duncan WJ. A frequência de doenças peri-implantares: uma revisão sistemática e meta-análise. J Periodontol. 2013 Nov;84(11):1586–98.
- Zitzmann NU, Margolin MD, Filippi A, Weiger R, Krastl G. Avaliação e diagnóstico do paciente no tratamento com implantes. Aust Dent J. 2008 Jun;53 Suppl 1:S3–10.
- Sanz M, Chapple IL; Grupo de Trabalho 4 do VIII Workshop Europeu sobre Periodontologia. Pesquisa clínica sobre doenças peri-implantares: relatório de consenso do Grupo de Trabalho 4. J Clin Periodontol. 2012 Fev;39 Suppl 12:202–6.
- Academia Americana de Periodontologia. Relatório da academia: mucosite peri-implantar e periimplantite: uma compreensão atual de seus diagnósticos e implicações clínicas. J Periodontol. 2013 Abr;84(4):436–43.
- Lang NP, Berglundh T; Grupo de Trabalho 4 do Sétimo Workshop Europeu sobre Periodontologia. Doenças periimplantares: onde estamos agora?—Consenso do Sétimo Workshop Europeu sobre Periodontologia. J Clin Periodontol. 2011 Mar;38 Suppl 11:178–81.
- Chan HL, Lin GH, Suarez F, MacEachern M, Wang HL. Manejo cirúrgico da periimplantite: uma revisão sistemática e meta-análise dos resultados do tratamento. J Periodontol. 2014 Ago;85(8):1027–41.
- Lindhe J, Meyle J; Grupo D do Workshop Europeu sobre Periodontologia. Doenças periimplantares: relatório de consenso do Sexto Workshop Europeu sobre Periodontologia. J Clin Periodontol. 2008 Set;35(8 Suppl):282–5.
- Mombelli A, Müller N, Cionca N. A epidemiologia da periimplantite. Clin Oral Implants Res. 2012 Out;23 Suppl 6:67–76.