O Uso do Tratamento de Superfície por Plasma a Vácuo para Melhorar a Cicatrização e Regeneração Óssea na Preservação de Alvéolos e GBR: Uma Série de Casos com Análise Histológica
Tradução automática
O artigo original está escrito em EN language (link para lê-lo) .
Resumo
Objetivo: Avaliar os resultados clínicos e histológicos de pacientes que recebem coroas suportadas por implantes após tratamento de superfície com plasma a vácuo (VPST) de biomateriais utilizados na preservação de alvéolos (SP) e regeneração óssea guiada (GBR).
Materiais e métodos: Este estudo foi projetado como uma série de casos. Pacientes que necessitavam de extração dentária e preservação de alvéolos ou regeneração óssea guiada foram recrutados. A técnica de preservação de alvéolos foi realizada após a extração do dente utilizando um enxerto ósseo de colágeno heterólogo e uma xenomatriz de colágeno, ambos ativados com plasma a vácuo. Enquanto isso, uma ampliação horizontal em duas etapas foi realizada utilizando uma malha de titânio personalizada e uma mistura de enxertos ósseos autólogos (não tratados) e heterólogos (tratados), juntamente com uma membrana de colágeno tratada. O ACTILINK Reborn com Universal Vortex Holder (Plasmapp Co., Ltd., Daejeon, República da Coreia) foi utilizado para tratar todos os biomateriais. As medidas de resultado foram falhas de implante e prótese, complicações e exame histológico. Amostras de tecidos moles e duros foram coletadas no momento da colocação do implante apenas em pacientes tratados com SP.
Resultados: Um total de seis pacientes foi tratado—três com preservação do alvéolo e colocação de implante atrasada, e três com GBR em estágios. Nenhum implante ou prótese falhou. Uma malha de titânio personalizada quebrou após o tratamento com plasma, exigindo substituição por uma membrana de pericárdio. Nenhuma outra complicação ocorreu. A análise histológica três meses após a cirurgia revelou osso recém-formado bem vascularizado em diferentes estágios de maturação com partículas de enxerto ósseo integradas, enquanto o tecido mole parecia estar estruturado fisiologicamente.
Conclusão: O VPST pode aumentar a hidrofobicidade dos biomateriais, apoiando resultados de cicatrização favoráveis em SP e GBR. Mais ensaios clínicos randomizados com cálculos de tamanho de amostra apropriados são necessários para confirmar esses resultados preliminares.
Introdução
A implantologia oral é reconhecida como uma metodologia clínica segura e eficaz capaz de garantir sucesso a longo prazo na reabilitação oral. As origens deste campo médico remontam ao início da década de 1950, quando o Dr. Per-Ingvar Brånemark, um cirurgião ortopédico sueco, fez descobertas inovadoras enquanto realizava experimentos ortopédicos em pernas de coelho. Desde então, o campo evoluiu rapidamente, impulsionado por avanços em biomateriais e técnicas cirúrgicas, levando a melhores resultados e maior satisfação dos pacientes.
Atualmente, um implante é considerado osseointegrado quando não há movimento relativo progressivo entre o implante e o osso circundante, indicando contato direto e estabilidade. A estabilidade primária é amplamente influenciada pelo entrelaçamento mecânico entre a superfície do implante e o osso do hospedeiro, que depende de fatores como densidade óssea, design do implante e técnica cirúrgica.
Alcançar e manter a osseointegração a longo prazo é complexo e pode ser afetado por vários fatores biológicos e mecânicos. Estes incluem a saúde sistêmica do paciente, a qualidade do osso local, as condições de carga do implante e as características de superfície do implante. Estudos recentes sugerem que modificar as superfícies dos implantes para melhorar sua compatibilidade biológica pode melhorar significativamente os resultados da osseointegração. Vários métodos de tratamento de superfície foram investigados e implementados para aprimorar as características biológicas da superfície dos implantes, apoiando o processo de osseointegração para o sucesso tanto a curto quanto a longo prazo. Entre estes, a rugosidade da superfície e a hidrofobicidade são particularmente significativas para alcançar um alto contato osso-implante (BIC). Essas características de superfície são projetadas para proporcionar melhor estabilidade durante o processo de cicatrização e permitir uma carga mais rápida do implante, acelerando o mecanismo de osseointegração e promovendo uma formação óssea mais forte e rápida.
Para melhorar a osteocondução e osteoindução de biomateriais para regeneração óssea, a modificação de sua superfície demonstrou promover a adesão celular, proliferação e formação de novo osso. Esses tratamentos incluem modificações aditivas, como revestimentos, ou modificações subtrativas, incluindo gravação, jateamento de areia e outros. Entre os vários tratamentos de biomateriais destinados a melhorar a osseointegração, o tratamento a plasma demonstrou melhorias significativas na adesão celular ao modificar a rugosidade da superfície e a molhabilidade. A ativação a plasma modifica a superfície incorporando grupos funcionais, aumentando a energia da superfície e melhorando a hidrofobicidade. Isso leva a uma redução no ângulo de contato entre fluidos biológicos e a superfície do implante, facilitando a difusão de células osteoblásticas sem deixar resíduos após o tratamento. Além disso, o tratamento a plasma induz mudanças nas propriedades físico-químicas, incluindo a energia livre da superfície, o conteúdo de hidrocarbonetos e a presença de grupos hidroxila funcionais. Avanços recentes na tecnologia de plasma possibilitaram o desenvolvimento de sistemas de plasma de baixa pressão capazes de tratar uniformemente geometrias complexas de implantes. Esses sistemas oferecem controle preciso sobre os parâmetros de tratamento, como potência, composição do gás e tempo de exposição, permitindo modificações de superfície personalizadas para melhorar a biocompatibilidade. No entanto, apesar dos resultados promissores in vitro, as evidências clínicas sobre biomateriais tratados a plasma permanecem limitadas, necessitando de mais investigação. Apesar dos resultados promissores de estudos in vitro, as evidências clínicas sobre a eficácia de biomateriais tratados a plasma permanecem limitadas, exigindo mais investigação.
O objetivo deste auditoria clínica é avaliar os resultados clínicos e histológicos de pacientes que recebem coroas suportadas por implantes após VPST de biomateriais utilizados na preservação de alvéolos (SP) e regeneração óssea guiada (GBR). Os resultados desta pesquisa visam informar e potencialmente refinar os protocolos clínicos existentes, contribuindo para uma abordagem mais precisa e previsível na reabilitação oral. Assim, esta auditoria clínica pode servir como um estudo de prova de conceito.
Materiais e Métodos
Este estudo foi projetado como um estudo de série de casos de fase IV, com materiais e dispositivos aprovados pela CE utilizados como parte da prática profissional habitual e sem riscos adicionais. Todos os casos foram realizados em uma clínica privada em Roma, Itália, e os dados foram avaliados no Departamento de Medicina, Cirurgia e Farmácia da Universidade de Sassari, Itália. O estudo seguiu os princípios da Declaração de Helsinque de 2013 e os princípios de Boa Prática Médica. Os dados médicos foram anonimizados para que os pacientes não pudessem ser identificados, e a isenção do comitê de ética para consentimento para uma série de casos foi obtida (Número do relatório 41/1.6; liberado em 21 de maio de 2025).
Pacientes que necessitam de uma extração dentária atraumática de um dente irrecuperável e de um procedimento de preservação do alvéolo, bem como pacientes que necessitam de um procedimento de regeneração óssea guiada antes da colocação de implantes, foram incluídos nesta pesquisa.
Critérios de inclusão:
- Pacientes com pelo menos um dente irrecuperável na mandíbula ou maxila, com alvéolo pós-extrativo intacto, capazes de entender e fornecer consentimento informado foram considerados elegíveis para inclusão na preservação do alvéolo; ou qualquer paciente que necessitasse de restauração suportada por implante único e regeneração óssea guiada horizontal em etapas (defeito de classe IV de acordo com Cawed e Howell) tanto na mandíbula quanto na maxila. Um dente irrecuperável foi definido como um dente com danos estruturais, periodontais ou endodônticos severos que não poderiam ser tratados ou mantidos de forma previsível e foi recomendado para extração. Critérios comuns para classificar um dente como irrecuperável incluem: doença periodontal severa com perda óssea ≥75%, mobilidade (Grau III) ou envolvimento de furca de classe III; cáries extensas ou fraturas que tornam o dente não restaurável; tratamento endodôntico malsucedido com infecção persistente; e trauma levando a raízes não viáveis ou deslocamento severo.
- Idade de 18 anos ou mais e capaz de fornecer consentimento informado.
- Fumantes foram categorizados como: (1) não-fumantes; (2) fumantes moderados (fumando até 10 cigarros/dia); e (3) fumantes pesados (fumando mais de 11 cigarros/dia). Fumantes pesados foram excluídos, apenas as categorias 1 e 2 foram incluídas neste estudo.
- O biotipo foi categorizado como: fino (≤1 mm), médio (>1–<2 mm) ou grosso (≥2 mm). Critérios de exclusão:
- Contraindicações gerais à cirurgia de implante
- Pacientes irradiados na área da cabeça e pescoço.
- Pacientes imunossuprimidos ou imunocomprometidos.
- Pacientes tratados ou em tratamento com amino-bisfosfonatos intravenosos.
- Pacientes com periodontite não tratada.
- Pacientes com higiene bucal e motivação inadequadas.
- Diabetes não controlada.
- Fumantes pesados (mais de 11 cigarros/dia).
- Gravidez ou amamentação.
- Usuários de substâncias.
- Problemas psiquiátricos ou expectativas irreais.
- Falta de dentição antagonista ocluindo na área destinada à colocação do implante.
- Pacientes com infecção e/ou inflamação na área destinada à colocação do implante.
- Pacientes participando de outros estudos se o presente protocolo não puder ser devidamente seguido.
- Pacientes encaminhados apenas para colocação de implante e que não podem ser acompanhados no centro de tratamento.
- Pacientes incapazes de serem acompanhados por 5 anos.
2.1. Procedimento de Preservação do Alvéolo
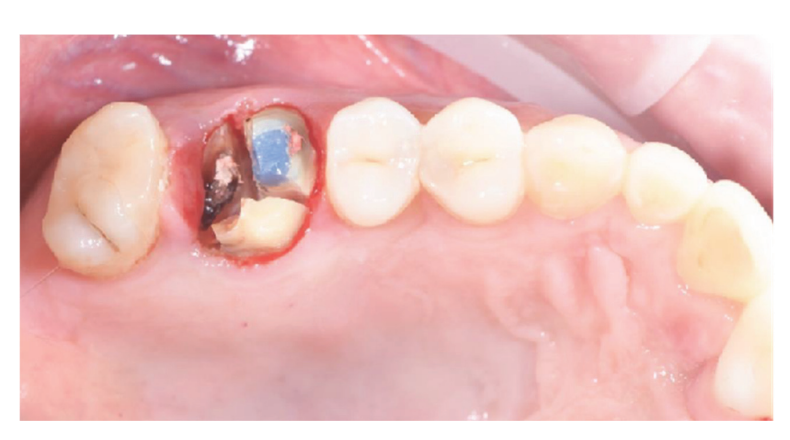
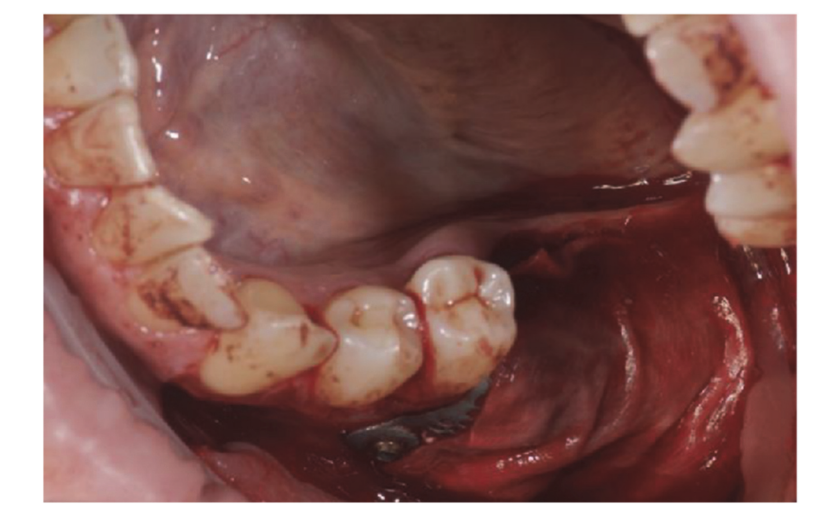
Os pacientes que atenderam aos critérios de inclusão/exclusão (Figura 1) foram minuciosamente examinados clinicamente para a avaliação de cáries dentárias e saúde periodontal. Antes do procedimento de preservação do alvéolo, os pacientes realizaram uma tomografia CBCT pré-operatória para quantificar o volume ósseo. Uma vez confirmada a elegibilidade e obtido o consentimento informado, foi realizada uma avaliação oral abrangente para avaliar a saúde bucal geral e identificar quaisquer patologias que necessitassem de tratamento antes da preservação do alvéolo e reabilitação com implante. Aproximadamente 10 dias antes da preservação do alvéolo e colocação do implante, todos os pacientes receberam higiene bucal profissional, incluindo desbridamento, conforme necessário. A administração de antibióticos profiláticos incluiu 2 g de amoxicilina uma hora antes da cirurgia, ou 600 mg de clindamicina em casos de alergia à penicilina. Os pacientes também enxaguaram com enxaguante bucal de clorexidina a 0,2% por um minuto antes de qualquer procedimento cirúrgico. Todas as intervenções cirúrgicas foram realizadas sob anestesia local com articaína e adrenalina (1:100.000). A sedação intravenosa foi opcional. A extração dental atraumática sem elevação de retalho foi realizada, seguida de curetagem do alvéolo, avaliação da integridade alveolar e preservação do alvéolo (Figura 2). Os alvéolos pós-extração foram preenchidos com substituto ósseo heterólogo utilizando grânulos de osso equino natural (Bioactiva, Arcugnano, Itália) e cobertos com XC Collagen Xenomatrix (Bioteck S.p.A, Vicenza, Itália). O tratamento de superfície com plasma a vácuo foi realizado utilizando a máquina ACTILINK reborn (Activelink reborn, Plasmapp Co., Ltd., Daejeon, República da Coreia) com um suporte personalizado (Figura 3), de acordo com um protocolo publicado. O tempo de ciclo do tratamento de superfície com plasma a vácuo, chamado modo Vortex Plasma, foi de 30 s.

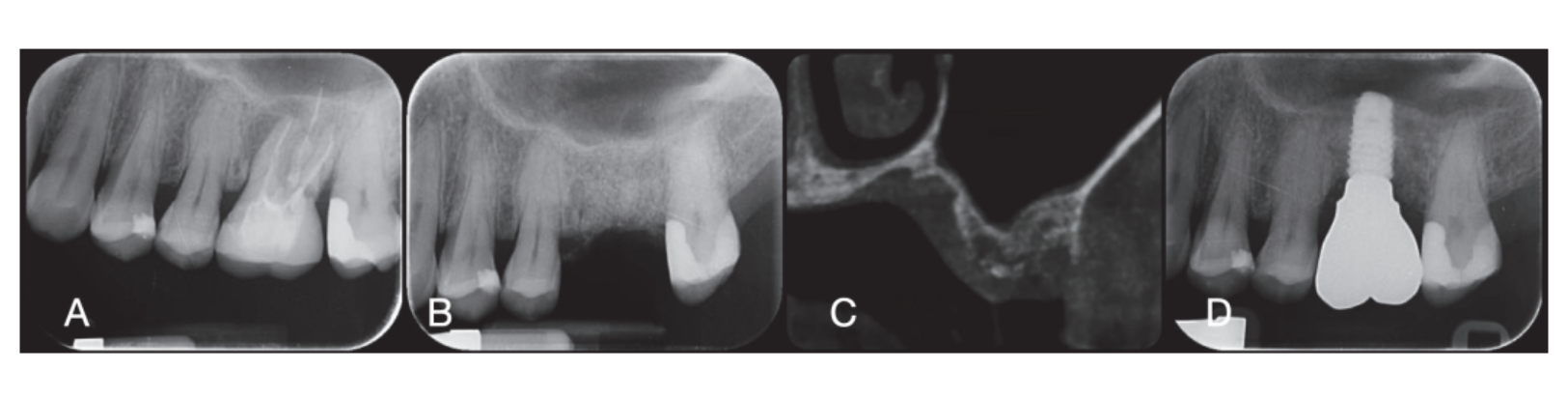
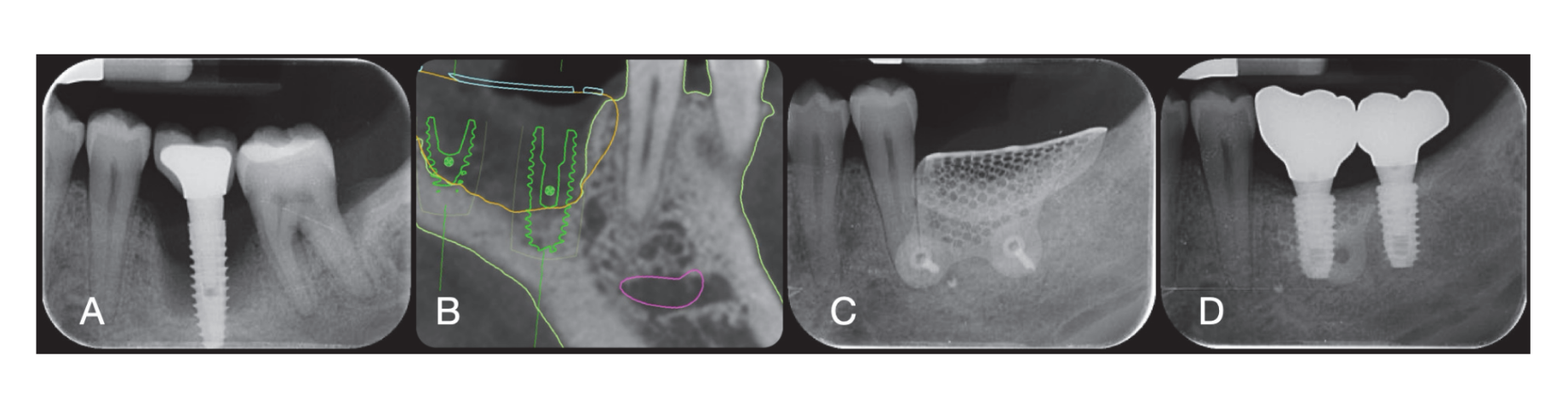
Os locais cirúrgicos foram então fechados com suturas simples de Vicryl 4.0 (Revello S.p.A, Verona, Itália) (Figura 4). Após um período de cicatrização de três meses, a colocação do implante (Osstem Implant, Seul, República da Coreia) foi realizada de acordo com as instruções do fabricante. Amostras de tecido histológico foram coletadas imediatamente antes da preparação do local do implante (veja as Seções 2.3 e 2.4). Os locais do implante foram preparados à mão livre, sem um template cirúrgico, utilizando brocas de diâmetro crescente. A qualidade do osso foi categorizada subjetivamente como dura, média ou macia. O torque do motor foi ajustado para 35 Ncm durante a inserção do implante. Os implantes foram colocados 1,5 mm abaixo do osso bucal intacto, e um protocolo de carga imediata foi adotado com um torque de inserção mínimo de 35 Ncm. O tratamento analgésico pós-cirúrgico com ibuprofeno 600 mg foi prescrito conforme necessário. Todos os pacientes foram rigorosamente acompanhados para avaliar a cicatrização completa. Três a quatro meses após a carga imediata, impressões definitivas foram feitas, e dentro de um mês, uma coroa metálica livre suportada por implante, retida por parafuso, foi entregue. Radiografias periapicais foram obtidas no momento da colocação do implante (Figura 5).
2.2. Instruções Pós-Cirúrgicas e Fase Protética Após a Preservação do Alvéolo
Uma dieta macia foi recomendada por 30 dias no caso de carga imediata. Ibuprofeno (400 mg) foi prescrito para ser tomado 2–4 vezes ao dia durante as refeições, mas os pacientes foram instruídos a não tomá-lo na ausência de dor (em casos de alergia ou problemas estomacais, 1 g de paracetamol foi prescrito em vez disso). Além disso, um enxaguante bucal de clorexidina a 0,2% foi recomendado por 1 min duas vezes ao dia durante 14 dias. Os pacientes não podiam usar nenhuma prótese removível que pudesse ter carregado os implantes do estudo. Os pontos foram removidos após 7 a 10 dias, e as instruções de higiene oral foram fornecidas.
No momento da inserção do implante, restaurações temporárias de carga imediata foram entregues. Após a osseointegração (8 semanas), as restaurações temporárias foram modificadas de acordo com o manejo dos tecidos moles. Após 3 a 4 meses, uma impressão definitiva, digital ou analógica, foi feita. Restaurações definitivas foram entregues dentro de um mês após ter testado a estabilidade dos implantes individuais. A superfície oclusal estava em leve contato com a dentição oposta. Radiografias periapicais e imagens clínicas dos implantes do estudo foram tiradas (Figura 5). Se os níveis de osso marginal peri-implantar não eram legíveis, uma nova radiografia foi feita, e as instruções de higiene oral foram fornecidas.
2.3. Coleta de Biópsia
Após três meses, a colocação do implante (Osstem Implant, Seul, República da Coreia) foi realizada de acordo com as instruções do fabricante. Durante a preparação do local do implante, biópsias de tecido mole e duro foram obtidas usando um mucotomo de 5 mm (diâmetro externo) para tecido mole e uma broca trephine de 3,0 mm (diâmetro externo) para amostras ósseas. Amostras de tecido duro foram fixadas em formalina tamponada neutra a 10% e tecidos moles em formalina tamponada neutra a 4% para exame histológico.
2.4. Processamento de Amostras e Análise Histológica
Amostras de tecido duro foram desidratadas usando uma série ascendente de etanol. Após a desidratação, as amostras foram infiltradas com resina metacrilática e, em seguida, incorporadas. Os blocos foram cortados usando uma lâmina de diamante e reduzidos a uma espessura de cerca de 100 µm. As seções foram montadas em lâminas de plástico, coladas e coradas com Azul de Toluidina e Pironina Amarela.
Amostras de tecido mole fixadas em formalina foram incorporadas em parafina. Lâminas histológicas foram obtidas e coradas com Hematoxilina e Eosina, tricrômico de Mallory e Sirius Red. As lâminas foram examinadas qualitativamente sob um microscópio óptico de campo claro (Nikon Eclipse 80i, Nikon, Tóquio, Japão) e um scanner de alta resolução em diferentes ampliações (Hamamatzu NanoZoomer Series S60, Hamamatzu Photonics, Hamamatsu, Japão). Além disso, amostras coradas com Sirius Red foram observadas sob luz polarizada para avaliar a organização das fibras de colágeno (Nikon Eclipse 80i, Nikon, Tóquio, Japão).
2.5. Procedimento GBR
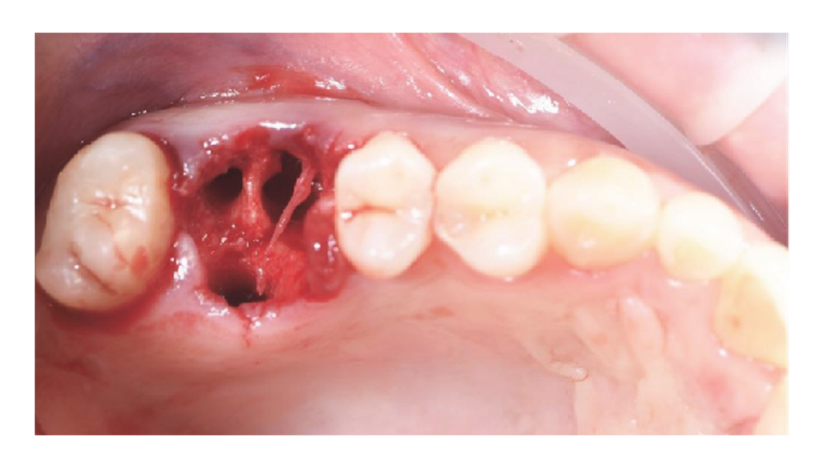
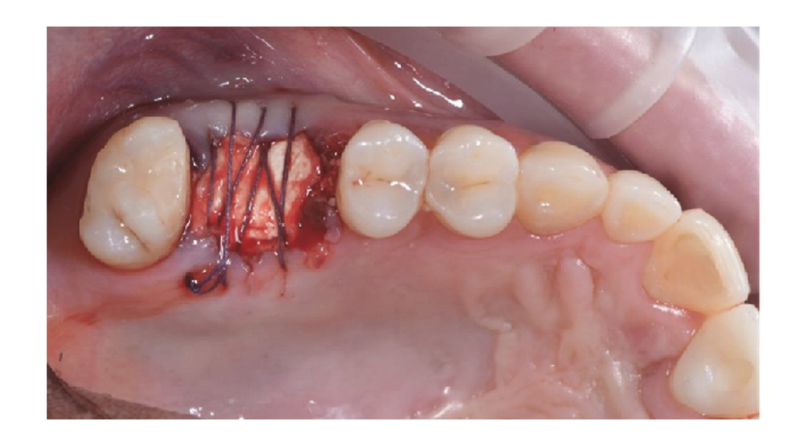
Os pacientes foram avaliados quanto à elegibilidade para o estudo. Uma tomografia computadorizada (CBCT) pré-operatória foi obtida para cada paciente para quantificar o volume ósseo. Pacientes com volume ósseo insuficiente para a colocação de implantes foram informados sobre os detalhes do estudo e assinaram o termo de consentimento informado para a pesquisa. Uma vez confirmada a elegibilidade e obtido o consentimento informado, um exame oral minucioso foi realizado para avaliar a saúde geral e identificar quaisquer patologias orais que exigissem tratamento antes da regeneração óssea guiada (GBR) e reabilitação com implantes. Dez dias antes da GBR e colocação do implante, todos os pacientes passaram por procedimentos profissionais de higiene oral, incluindo desbridamento, conforme necessário. Dentes comprometidos nos locais operativos foram extraídos oito semanas antes da GBR e colocação do implante. Os pacientes receberam 2 g de amoxicilina (Zimox, Pfizer, Roma, Itália) uma hora antes da cirurgia, seguidas de 1 g duas vezes ao dia durante duas semanas. Em casos de alergia à penicilina, 600 mg de clindamicina foram administrados com o mesmo regime pós-operatório. Imediatamente antes da cirurgia, os pacientes enxaguaram com uma solução de clorexidina a 0,2% (Curasept, Curaden Healthcare, Saronno, Itália) por um minuto. O procedimento cirúrgico foi realizado sob sedação consciente (Diazepam, Hoffmann-La Roche, Basileia, Suíça) e anestesia local (Septanest com adrenalina 1/100.000, Septodont, Saint-Maur-des-Fossés, França). Uma incisão mid-crestal (ligeiramente avançada bucalmente) foi feita no tecido residual queratinizado usando uma lâmina cirúrgica nº 15, seguida de duas incisões verticais bilaterais a uma ou duas dentes de distância. Um retalho de espessura total foi elevado além da junção mucogengival, pelo menos 5 mm além do defeito ósseo, e o local receptor foi cuidadosamente limpo de restos de tecido mole. Osso autógeno foi coletado do local planejado para o implante ou da região retro-molar mandibular usando um coletor de osso cortical minimamente invasivo (Micross, Meta, Reggio Emilia, Itália). O defeito ósseo foi então preenchido com uma mistura 50:50 de osso autógeno e substituto ósseo heterólogo (grânulos de osso equino natural, Bioactiva, Arcugnano, Itália), pré-tratados com Plasma Vortex usando o suporte de material. Uma malha de titânio projetada por CAD/CAM, tratada com plasma (Exocad DentalCAD, Exocad, Darmstadt, Alemanha), personalizada com base no contorno e forma da região contralateral (New Ancorvis Srl, Bargellino, Calderara di Reno, Itália), foi então colocada para cobrir e proteger o local enxertado. A malha de titânio personalizada foi fixada com dois a três parafusos ósseos pré-planejados e coberta com uma membrana de pericárdio tratada com plasma (Bioactiva, Arcugnano, Itália) (Figuras 6 e 7). O fechamento do retalho sem tensão foi alcançado usando suturas Vicryl 4.0. No pós-operatório, os pacientes receberam 80 mg de cetoprofeno (Oki, Dompé, Milão, Itália) e 4 mg/dia de betametasona (Bentelan, Glaxo, Verona, Itália) por dois dias. Eles foram instruídos a enxaguar com clorexidina a 0,2% (Curasept) três vezes ao dia durante duas semanas e consumir apenas alimentos macios por 30 dias. As suturas foram removidas após 14 a 21 dias. Radiografias periapicais de base foram tiradas ao final do procedimento, durante a reabertura, na entrega da prótese e anualmente a partir de então. O ACTILINK Reborn com Universal Vortex Holder (Plasmapp Co., Ltd., República da Coreia) foi utilizado para tratar todos os biomateriais, conforme relatado anteriormente.

Seis meses após a GBR, os implantes foram colocados seguindo o protocolo padrão do fabricante. Após a elevação do retalho, os locais dos implantes foram preparados usando brocas de diâmetro crescente, com a qualidade do osso categorizada subjetivamente como dura, média ou macia. O torque do motor foi ajustado para 25 Ncm durante a inserção do implante. Os implantes (Osstem TSIII SOI, Osstem Implant CO., LTD., Seul, República da Coreia) foram colocados em posições planejadas prosteticamente. Como os implantes tinham uma superfície ativada, nenhum tratamento adicional de Plasma Vortex foi realizado. Os implantes foram colocados ao nível da crista ou ligeiramente abaixo, seja à mão livre ou usando um template cirúrgico CAD/CAM. Quatro meses após a colocação do implante, os implantes foram expostos, e o tecido mole foi gerenciado conforme necessário. Impressões digitais ou analógicas foram então feitas, e restaurações temporárias foram entregues de acordo com os requisitos de manejo do tecido mole. De dois a quatro meses depois, coroas definitivas de zircônia monolítica unidas a Ti-link foram entregues após a confirmação da estabilidade individual dos implantes. As superfícies oclusais foram projetadas para estar em leve contato com a dentição oposta. Radiografias periapicais e imagens clínicas foram tiradas durante o procedimento de GBR, colocação do implante, estágios de restauração temporária e definitiva (Figura 8). Instruções de higiene oral foram fornecidas em cada visita de acompanhamento. A manutenção profissional de higiene foi agendada a cada seis meses após a carga definitiva e conforme necessário durante as fases protéticas. A oclusão dental foi avaliada em cada consulta de acompanhamento.
2.6. Medidas de Resultado
Os resultados primários foram:
- Falha do implante definida como mobilidade, infecção, fratura e/ou qualquer outro problema mecânico ou biológico que determinasse sua remoção.
- A falha da prótese foi considerada sempre que tivesse que ser substituída.
- Quaisquer complicações biológicas (por exemplo, dor resistente a medicamentos, inchaço, MBL excessivo, supuração, etc.) e/ou técnicas (por exemplo, fratura do material de revestimento e/ou estrutura, afrouxamento do parafuso, etc.) foram registradas durante o acompanhamento.
O resultado secundário foi avaliar a regeneração óssea por meio de análise histológica qualitativa, avaliando o grau de mineralização óssea.
Resultados
3.1. Resultados Clínicos
Um total de seis pacientes foi tratado. Três pacientes com dentes irrecuperáveis e alvéolos intactos após a extração dental receberam o procedimento de preservação do alvéolo e colocação de implante atrasada (três meses), enquanto os outros três pacientes com defeitos horizontais de classe IV receberam colocação de implante em combinação com regeneração óssea guiada. Seis amostras histológicas em três pacientes foram coletadas no momento da colocação do implante no grupo de preservação do alvéolo. De cada paciente, tecidos moles e duros foram coletados três meses após o procedimento de preservação do alvéolo, ao mesmo tempo da cirurgia do implante, conforme descrito. Um total de seis amostras foi coletado e enviado para análise histológica (três amostras de tecido mole e três amostras ósseas).
Um total de seis pacientes foi tratado. Todos os pacientes eram do sexo feminino, com uma idade média de 50 anos (variando de 37 a 63). Nenhum dos pacientes era fumante e todos estavam em boa saúde (ASA 1). Todos os pacientes foram acompanhados por pelo menos 1 ano após a entrega da prótese, sem desistências.
Nenhum implante ou prótese falhou até um ano após a colocação do implante. Em um paciente que passou por regeneração óssea guiada, a malha de titânio quebrou após o tratamento com plasma. Neste paciente, uma membrana de pericárdio foi utilizada e fixada com tags. Nenhuma outra complicação biológica ou técnica ocorreu.
Em um paciente do grupo de preservação do alvéolo, no momento da colocação do implante, a estabilidade primária estava em torno de 15–20 Ncm. No entanto, o implante osseointegrou e a coroa final foi entregue.
3.2. Avaliação Histológica
Três meses após a cirurgia de preservação do alvéolo, nenhuma amostra histológica mostrou sinais de inflamação ou necrose.
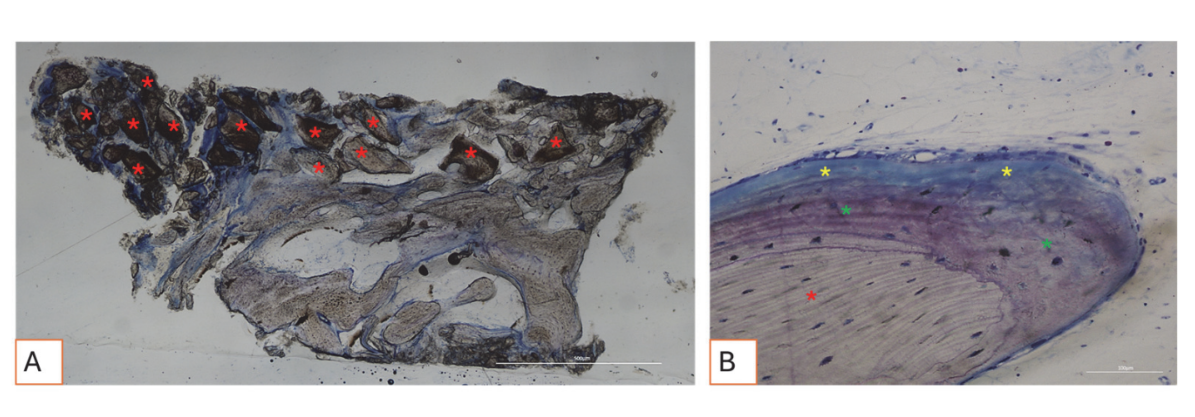
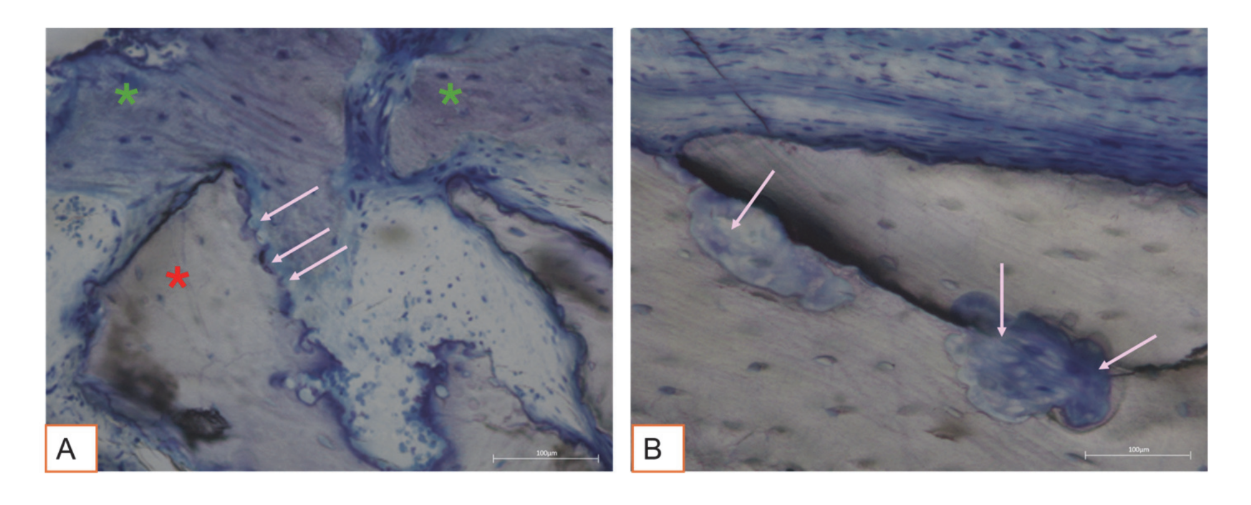
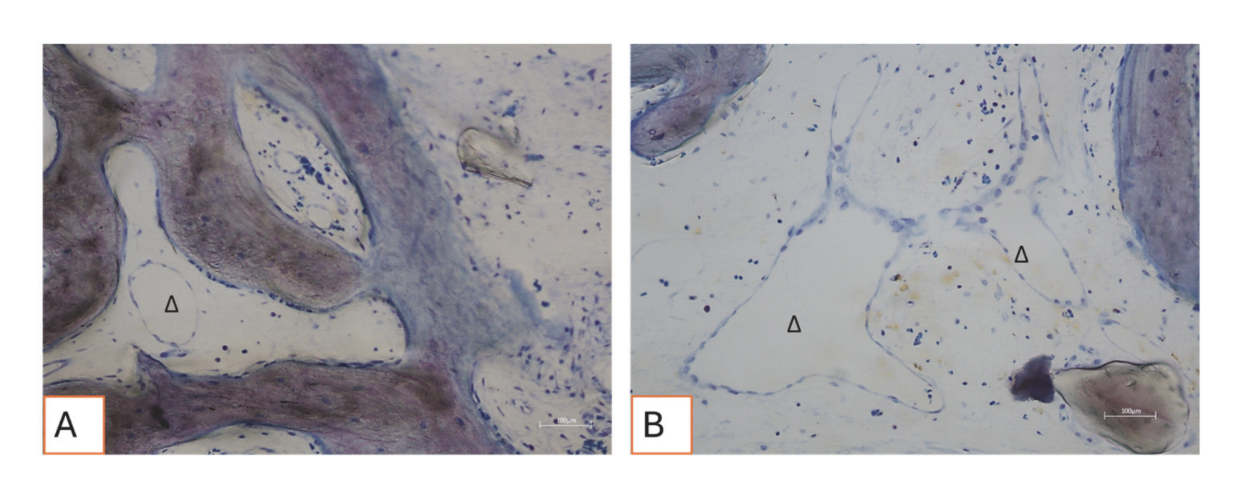
Todas as amostras de tecido duro evidenciaram osso recém-formado passando por mineralização em diferentes estágios (Figura 9) que cercava várias partículas de enxerto ósseo, caracterizadas por numerosas lacunas de superfície consistentes com lacunas de reabsorção osteoclástica (Figura 10). O osso recém-formado parecia ser rico em células ósseas ativas, nomeadamente células semelhantes a osteoblastos, alinhadas em linhas de deposição e secretando matriz osteoide, e células semelhantes a osteócitos imaturos habitando lacunas de osso entrelaçado (Figura 9). Tecido conjuntivo frouxo foi observado ao redor das áreas de tecido duro e parecia ser rico em células e vasos sanguíneos (Figura 11).
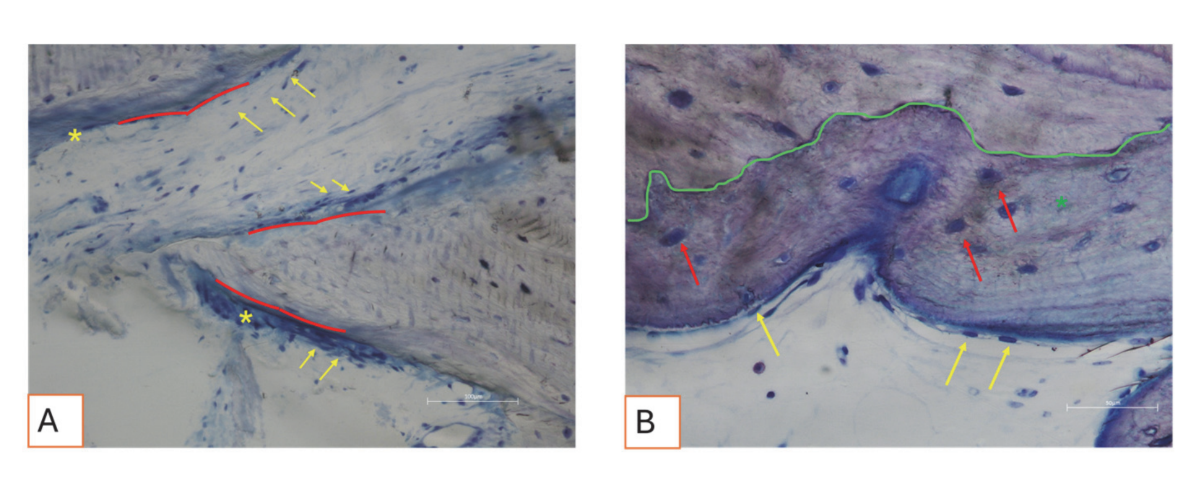
Os tecidos moles exibiram uma morfologia fisiológica. O componente conjuntivo estava levemente fibroso, consistente com a cicatrização pós-cirúrgica (Figuras 12 e 13).

Discussão
Este estudo investigou o impacto do VPST em biomateriais utilizados em procedimentos de SP e GBR, avaliando sua influência na hidrofobicidade da superfície e nos resultados de cicatrização. Os resultados indicam que o tratamento com plasma melhora a compatibilidade biológica dos biomateriais, promovendo uma osseointegração eficaz e respostas de cicatrização favoráveis.
A análise histológica aos três meses não exibiu sinais de necrose, inflamação ou cicatrização. Tanto os tecidos moles quanto os duros mostraram arquiteturas fisiológicas com boa vascularização. Os tecidos duros regenerados pós-cirurgia revelaram a presença de células ósseas ativas secretando matriz osteoide e tecido ósseo recém-formado, consistente com o tempo de cicatrização esperado. Esses achados estão alinhados com estudos anteriores que relatam que a formação óssea precoce é caracterizada pela deposição de uma matriz osteoide, que se mineraliza progressivamente ao longo do tempo. Partículas de enxerto ósseo foram bem integradas ao osso recém-formado. Curiosamente, muitas dessas partículas exibiram lacunas superficiais compatíveis com a reabsorção osteoclástica. Osteoclastos humanos cultivados por 21 dias na superfície de grânulos de osso equino desproteinizado (DEBGs) e grânulos de osso bovino desproteinizado (DBBGs) reabsorveram os biomateriais, exibindo marcadores osteoclásticos típicos e características morfológicas mais ativas em DEBGs do que em DBBGs. Esses achados sugeriram que DEBGs suportam a diferenciação de osteoclastos e a atividade reabsorptiva. Além disso, Di Stefano et al., em um estudo clínico e histomorfométrico realizado seis meses após o enxerto de alvéolo, relataram que DEBGs estavam associados a uma quantidade significativamente maior de osso recém-formado e a uma porcentagem menor de biomaterial residual em comparação com DBBGs. À luz de nossas descobertas, a presença de lacunas de reabsorção observadas na superfície de DEBGs pode ser atribuída às propriedades intrínsecas do próprio material, que parecem ser ainda mais aprimoradas pelo tratamento VPST. Além disso, o VPST melhora a rugosidade da superfície e a molhabilidade, promovendo uma melhor diferenciação celular e formação de apatita, que são cruciais para a regeneração óssea bem-sucedida. A análise do tecido duro, de fato, revelou numerosas linhas de deposição óssea, caracterizadas pela presença de células semelhantes a osteoblastos secretando ativamente matriz osteoide. A atividade secretora dos osteoblastos desempenha um papel crítico na formação de novo osso e na integração bem-sucedida do biomaterial dentro do tecido hospedeiro. Esses achados confirmaram que o tratamento VPST não prejudicou as propriedades osteocondutivas do enxerto DEBG, apoiando assim sua compatibilidade com os processos fisiológicos de regeneração óssea. Além disso, a ação simultânea da deposição de matriz mediada por osteoblastos e da reabsorção mediada por osteoclastos forma a base do remodelamento ósseo fisiológico.
Este processo dinâmico é rigidamente regulado através de uma complexa comunicação celular entre esses dois tipos de células.
Em relação ao tecido mole, a análise histológica evidenciou uma arquitetura fisiológica com um componente conectivo levemente fibroso, consistente com a cicatrização pós-cirúrgica. Esses resultados estão alinhados com os de Pellegrini et al. que descreveram a progressão da cicatrização do tecido mole após procedimentos de enxerto ósseo em técnicas de preservação de alvéolos. A presença de leve fibrose no tecido conectivo pode ser interpretada como parte da fase normal de remodelação, onde os fibroblastos contribuem para a deposição da matriz extracelular e maturação do tecido.
Clinicamente, nenhuma falha de implante ou prótese foi registrada até um ano após a colocação do implante, sublinhando a confiabilidade clínica dos biomateriais tratados com plasma. Isso é consistente com estudos anteriores que relataram melhorias na estabilidade do implante e taxas de sobrevivência associadas a superfícies ativadas por plasma. A ausência de complicações biológicas ou técnicas, exceto pela quebra isolada da malha de titânio, apoia ainda mais a segurança clínica e a eficácia do protocolo de tratamento proposto. A interação do plasma a vácuo com objetos biológicos também pode ter efeitos adversos que devem ser considerados. Uma possível explicação para a quebra da malha de titânio foi que a malha de titânio foi tratada imediatamente após ser testada na lesão óssea. A presença de fluidos biológicos pode ter causado uma hiperativação da superfície.
Na melhor das hipóteses, este é o primeiro estudo a avaliar o VPST em biomateriais. Apesar desses resultados promissores, este estudo tem algumas limitações. O pequeno tamanho da amostra e a natureza de uma auditoria clínica limitam a generalização dos achados. Além disso, a falta de um grupo de controle impede uma comparação direta entre biomateriais tratados com plasma e não tratados. Estudos futuros devem incluir ensaios controlados randomizados maiores, com acompanhamento a longo prazo, para validar esses achados preliminares e estabelecer diretrizes clínicas robustas.
Conclusões
Considerando o tamanho limitado da amostra, esta série de casos preliminares demonstra que o VPST pode melhorar a compatibilidade biológica dos biomateriais utilizados em procedimentos de SP e GBR. Esses achados preliminares podem sugerir que o tratamento com plasma poderia ser integrado de forma segura aos protocolos clínicos para potencialmente melhorar os resultados da reabilitação oral. Mais ensaios controlados randomizados com cálculo do tamanho da amostra são necessários para confirmar esses resultados preliminares e explorar o impacto a longo prazo na sobrevivência de implantes e na satisfação do paciente.
Marco Tallarico, Michele Troia, Milena Pisano, Silvio Mario Meloni, Dario Melodia, Claudia Della Via, Dolaji Henin, Francesco Mattia Ceruso, Carlotta Cacciò e Aurea Immacolata Lumbau
Referências
- Busenlechner, D.; Fürhauser, R.; Haas, R.; Watzek, G.; Mailath, G.; Pommer, B. Sucesso de implante a longo prazo na Academia de Implantologia Oral: acompanhamento de 8 anos e análise de fatores de risco. J. Periodontal Implant. Sci. 2014, 44, 102–108. [CrossRef] [PubMed]
- Kim, T.I. Uma homenagem ao Dr. Per-Ingvar Brånemark. J. Periodontal Implant. Sci. 2014, 44, 265. [CrossRef] [PubMed]
- Mavrogenis, A.F.; Dimitriou, R.; Parvizi, J.; Babis, G.C. Biologia da osseointegração do implante. J. Musculoskelet. Neuronal Interact. 2009, 9, 61–71.
- Gallucci, G.O.; Hamilton, A.; Zhou, W.; Buser, D.; Chen, S. Protocolos de colocação e carga de implantes em pacientes parcialmente edêntulos: uma revisão sistemática. Clin. Oral Implant. Res. 2018, 29 (Suppl. S16), 106–134. [CrossRef]
- Wong, M.; Eulenberger, J.; Schenk, R.; Hunziker, E. Efeito da topologia da superfície na osseointegração de materiais de implante em osso trabecular. J. Biomed. Mater. Res. 1995, 29, 1567–1575. [CrossRef]
- Wennerberg, A.; Albrektsson, T. Sobre superfícies de implantes: uma revisão do conhecimento e opiniões atuais. Int. J. Oral Maxillofac. Implant. 2010, 25, 63–74.
- Wennerberg, A.; Albrektsson, T. Efeitos da topografia da superfície de titânio na integração óssea: uma revisão sistemática. Clin. Oral Implant. Res. 2009, 20 (Suppl. S4), 172–184. [CrossRef]
- Kazimierczak, P.; Przekora, A. Modificações de superfície osteocondutivas e osteoindutivas de biomateriais para regeneração óssea: uma revisão concisa. Coatings 2020, 10, 971. [CrossRef]
- Canullo, L.; Genova, T.; Chinigò, G.; Iacono, R.; Pesce, P.; Menini, M.; Mussano, F. Dispositivo de Tratamento a Plasma a Vácuo para Aumentar a Atividade de Fibroblastos em Superfícies de Titânio Maquinadas e Rugosas. Dent. J. 2024, 12, 71. [CrossRef] [PubMed]
- Shibata, Y.; Hosaka, M.; Kawai, H.; Miyazaki, T. Tratamento de plasma de descarga luminosa de placas de titânio melhora a adesão de células semelhantes a osteoblastos às placas através do mecanismo mediado por integrina. Int. J. Oral Maxillofac. Implant. 2002, 17, 771–777.
- Noro, A.; Kaneko, M.; Murata, I.; Yoshinari, M. Influência da topografia da superfície e da físico-química da superfície na molhabilidade da zircônia (zircônia tetragonal policristalina). J. Biomed. Mater. Res. Part B Appl. Biomater. 2013, 101, 355–363. [CrossRef] [PubMed]
- Tallarico, M.; Meloni, S.M.; Troia, M.; Cacciò, C.; Lumbau, A.I.; Gendviliene, I.; Ceruso, F.M.; Pisano, M. O Uso do Tratamento de Superfície a Plasma a Vácuo para Melhorar a Hidrofobicidade e Molhabilidade de Biomateriais: Um Estudo In-Vitro. Dent. J. 2025, 13, 141. [CrossRef] [PubMed]
- Canullo, L.; Pellegrini, G.; Canciani, E.; Heinemann, F.; Galliera, E.; Dellavia, C. Técnica de preservação do alvéolo: Efeito do biomaterial no padrão regenerativo ósseo. Ann. Anat. Anat. Anz. 2016, 206, 73–79. [CrossRef] [PubMed]
- Lorusso, F.; Alla, I.; Gehrke, S.A.; Carmine, M.D.; Tari, S.R.; Scarano, A. Efeito de Diferentes Juntas Protéticas de Implantes Dentários na Perda Óssea Marginal: Descobertas Emergentes de uma Meta-Análise de Rede Bayesiana (NMA) e Revisão Sistemática. Prosthesis 2024, 6, 186–205. [CrossRef]
- Udeabor, S.E.; Heselich, A.; Al-Maawi, S.; Alqahtani, A.F.; Sader, R.; Ghanaati, S. Conhecimento Atual sobre a Cicatrização do Alvéolo de Extração: Uma Revisão Narrativa. Bioengineering 2023, 10, 1145. [CrossRef]
- Perrotti, V.; Nicholls, B.M.; Piattelli, A. Formação e atividade de osteoclastos humanos em um substituto ósseo esponjoso equino. Clin. Oral Implant. Res. 2009, 20, 17–23. [CrossRef]
- Di Stefano, D.A.; Zaniol, T.; Cinci, L.; Pieri, L. Comparação Química, Clínica e Histomorfométrica entre Osso Equino Fabricado através da Eliminação Enzimática de Antígenos e Osso Bovino Tornado Não Antigênico Usando um Processo de Alta Temperatura em Enxertos de Alvéolo Pós-Extração. Um Estudo Clínico Retrospectivo Comparativo. Dent. J. 2019, 7, 70. [CrossRef]
- Le, P.T.M.; Shintani, S.A.; Takadama, H.; Ito, M.; Kakutani, T.; Kitagaki, H.; Terauchi, S.; Ueno, T.; Nakano, H.; Nakajima, Y.; et al. Tratamento de Bioativação com Ácido Misturado e Calor em Implantes de Titânio Fabricados por Fusão a Laser Seletiva Aumenta a Diferenciação de Células Pré-Osteoblastos. Nanomaterials 2021, 11, 987. [CrossRef]
- Pellegrini, G.; Rasperini, G.; Obot, G.; Farronato, D.; Dellavia, C. Cicatrização de tecidos moles na técnica de preservação do alvéolo: avaliações histológicas. Int. J. Periodontics Restor. Dent. 2014, 34, 531–539. [CrossRef]
- Kahm, S.H.; Lee, S.H.; Lim, Y.; Jeon, H.J.; Yun, K.I. Osseointegração de Implantes Dentários após Tratamento de Superfície a Plasma a Vácuo In Vivo. J. Funct. Biomater. 2024, 15, 278. [CrossRef]
- Pesce, P.; Menini, M.; Santori, G.; Giovanni, E.; Bagnasco, F.; Canullo, L. Ativação Foto e Plasma das Superfícies de Titânio de Implantes Dentários. Uma Revisão Sistemática com Meta-Análise de Estudos Pré-Clínicos. J. Clin. Med. 2020, 9, 2817. [CrossRef] [PubMed]
- Scribante, A.; Ghizzoni, M.; Pellegrini, M.; Pulicari, F.; Manfredini, M.; Poli, P.P.; Maiorana, C.; Spadari, F. Malhas Personalizadas Completamente Digitais em Procedimentos de Regeneração Óssea Guiada: Uma Revisão Abrangente. Prosthesis 2023, 5, 480–495. [CrossRef]
- Berger, M.B.; Bosh, K.B.; Cohen, D.J.; Boyan, B.D.; Schwartz, Z. Tratamento de plasma em bancada de superfícies de titânio melhora a resposta celular. Dent. Mater. 2021, 37, 690–700. [CrossRef] [PubMed]
