Análise Histológica da Largura Biológica e Orientação das Fibras de Colágeno em Abutments Hemisféricos Sem Parafuso, com Conexão Morse, 8 e 16 Semanas Após a Exposição do Implante: Um Estudo Clínico Observacional
Tradução automática
O artigo original está escrito em EN language (link para lê-lo) .
Resumo
Objetivos: Este estudo teve como objetivo avaliar histologicamente, em humanos, a orientação das fibras de colágeno ao redor de pilares de base hemisférica, sem parafusos, do tipo Morse taper.
Métodos: Este estudo foi projetado como um ensaio clínico observacional, caso-controle, para avaliar a orientação histológica das fibras de colágeno ao redor de implantes. Biópsias do tecido peri-implante foram realizadas 8 (grupo A, controle) ou 16 (grupo B, teste) semanas após a exposição do implante, e analisadas histologicamente sob microscópio óptico utilizando colorações histoquímicas de Hematoxilina e Eosina, Masson e Picro Sirius, além de um microscópio eletrônico de varredura.
Resultados: Oito pacientes foram incluídos neste estudo e 16 biópsias foram realizadas. Todas as biópsias foram corretamente analisadas. O exame histológico de porções transversais do tecido coletadas 8 semanas após a exposição do implante mostrou a quase completa ausência de revestimento epitelial, enquanto os feixes de tecido conjuntivo na porção superficial apresentaram um padrão circular mais baixo. O exame histoquímico da seção transversal do tecido coletado 16 semanas após a exposição do implante mostrou a presença parcial de revestimento epitelial não queratinizado no local do implante e os feixes de colágeno mostraram uma maior organização, com um curso circunferencial ao redor do pilar. Com 8 semanas, a análise histológica final mostrou uma altura média de 1,01 mm para o epitélio queratinizado, 0,83 mm para o epitélio não queratinizado e 1,39 mm para o tecido conjuntivo. Enquanto, com 16 semanas, os valores foram de 1,20 mm, 0,48 mm e 1,11 mm, respectivamente. Nenhuma diferença estatisticamente significativa foi encontrada entre os grupos (p > 0,05).
Conclusões: Histologicamente, não houve diferenças na altura e no perfil da gengiva entre 8 e 16 semanas de cicatrização após a entrega da prótese. Uma maior organização das fibras de colágeno com um curso circumferencial ao redor do pilar foi encontrada no grupo de teste (16 semanas) em comparação com o grupo controle (8 semanas).
Introdução
O sucesso de um tratamento com implantes é determinado, em primeiro lugar, pela osseointegração, mas é, acima de tudo, determinado pela manutenção da estabilidade tanto do osso marginal quanto dos tecidos moles peri-implantares ao longo do tempo. Um remodelamento ósseo marginal fisiológico estável pode ser esperado no acompanhamento de médio a longo prazo ao usar superfícies e conexões de implantes modernos. Na última década, o conceito de largura biológica tem sido amplamente discutido na implantação oral. As características da mucosa peri-implantar são determinadas durante o estabelecimento da largura biológica que ocorre após várias semanas de cicatrização após a conexão dos pilares de cicatrização ou componentes protéticos. A largura biológica ao redor de um implante é um sistema complexo de 3 a 4 mm de tamanho. Ela se estende do topo da mucosa peri-implantar até o primeiro contato osso-implante, consistindo em epitélio sulcular, epitélio de junção e tecido conjuntivo fibroso. No entanto, a disposição diferente das fibras do tecido conjuntivo foi demonstrada ao redor dos implantes quando comparada com dentes naturais, com arranjos circulares ou em forma de anel paralelos ao longo do eixo longo e inseridos no implante. O papel da largura biológica é criar uma barreira biológica contra os produtos tóxicos das bactérias, protegendo o osso subjacente. Nos últimos anos, esse conceito se tornou muito popular na implantologia dentária moderna, que está mais orientada para as necessidades de manejo dos tecidos moles. O manejo dos tecidos moles pode ser realizado com diferentes técnicas cirúrgicas e em diferentes momentos durante os tratamentos com implantes, com base no defeito inicial, na área anatômica e nas considerações estéticas. Resumidamente, a augmentação do tecido queratinizado pode ser realizada para obter uma faixa de tecido queratinizado ao redor dos implantes que melhora seus resultados estéticos e reduz o risco de acúmulo de placa. Por outro lado, a augmentação da espessura do tecido mole pode ser realizada para aumentar a espessura dos tecidos moles supracrestais peri-implantares que são cruciais para obter um perfil de emergência natural para a restauração protética e garantir um resultado estético satisfatório. Além disso, um biotipo ou fenótipo fino muitas vezes vai contra a reabsorção para restaurar a largura biológica correta. Microgaps e micro-movimentos na interface implante-pilar também desempenham um papel importante na estabilidade dos tecidos duros e moles peri-implantares. A microvazamento na interface implante-pilar pode determinar a passagem de bactérias e a liberação de pequenas partículas de titânio que induzem inflamação nos tecidos peri-implantares. Por essas razões, hoje, implantes com conexão em cone Morse e sem parafuso de conexão podem representar uma boa escolha.
O aparato de fibras supragengivais consiste em uma densa rede de feixes de fibras de colágeno
que ligam a gengiva aos dentes e ao osso, enquanto conectam as papilas interdentais vestibular e oral [9]. Essa rede de fibras fornece resistência mecânica, permitindo que a gengiva suporte forças de fricção da mastigação. O epitélio de junção forma a parte coronal da junção dentogengival, enquanto a porção apical consiste em fibras de tecido conjuntivo dentogengival que se estendem até o cimento radicular, garantindo a fixação do tecido conjuntivo. A mucosa peri-implante ao redor de implantes endosseos bem-sucedidos compartilha muitas semelhanças com os tecidos que cercam dentes naturais. A lâmina própria se estende coronariamente a partir do osso alveolar e é coberta por epitélio oral queratinizado. Em condições saudáveis, forma-se um sulco raso revestido por epitélio sulcular. Entre os tecidos em contato com o implante, o epitélio de junção se assemelha mais ao de um dente natural, formando uma fixação biológica através da lâmina basal e hemidesmosomos. No entanto, existem diferenças em como os tecidos conjuntivos se interfaceiam com os implantes devido à ausência de cimento radicular. Enquanto as fibras dentogengivais em dentes naturais se fixam perpendicular ou obliquamente ao cimento mineralizado, sua fixação direta aos implantes permanece debatida. A maioria das fibras de tecido conjuntivo corre paralela à superfície do implante, seja em direção coronal-apical ou circunferencialmente. Alguns estudos sugerem a presença de fibras orientadas perpendicular ou obliquamente à superfície do implante, particularmente em superfícies transmucosas microtexturizadas em vez de lisas.
O objetivo deste ensaio clínico foi avaliar preliminarmente, em humanos, a medida da largura biológica e a orientação das fibras de colágeno ao redor de bases hemisféricas sem parafuso, tipo Morse, 8 e 16 semanas após a descoberta do implante. O seguinte manuscrito foi escrito de acordo com as diretrizes STROBE para relato de ensaios clínicos observacionais.
Materiais e Métodos
Este estudo foi projetado como um ensaio clínico observacional, caso-controle, e teve como objetivo avaliar a altura e o perfil da largura biológica, bem como a orientação das fibras de colágeno ao redor das conexões implante-abutment sem parafuso, tipo Morse, entre os participantes 8 e 16 semanas após a descoberta do implante. Este estudo foi conduzido de acordo com os princípios descritos na Declaração de Helsinque para Pesquisa Biomédica Envolvendo Sujeitos Humanos, conforme emendada em 2018. O protocolo de pesquisa recebeu aprovação ética da Universidade de Bucareste na Romênia (número do protocolo 15/2024, 16 de dezembro de 2024) e foi registrado em um banco de dados online de estudos de pesquisa clínica (número de registro: NCT06862505; 5 de março de 2025). Qualquer paciente com 18 anos ou mais, afetado por edentulismo parcial de elementos posteriores (pré-molares e molares), necessitando de pelo menos duas reabilitações com implante único sem a necessidade de aumento de tecido mole e/ou ósseo, e capaz de entender e assinar um formulário de consentimento informado, foi considerado elegível para este estudo. Os pacientes foram excluídos se algum dos seguintes critérios de exclusão estivesse presente: contraindicações sistêmicas ou locais para a colocação de implantes; doença periodontal não tratada; tabagismo; osteoporose; diabetes não controlada; recusa de reabilitação com implante; recusa de coleta de biópsia; e patologias sistêmicas que poderiam comprometer a cicatrização dos tecidos peri-implantares. Todos os pacientes selecionados foram informados sobre todos os procedimentos cirúrgicos e protéticos, incluindo os benefícios e os potenciais riscos e complicações desta pesquisa, e o consentimento informado por escrito foi obtido antes da inscrição final.
2.1. Protocolo Pré-Cirúrgico e Cirúrgico
Os pacientes foram inicialmente submetidos a investigações clínicas e instrumentais para determinar seu estado de saúde geral e elegibilidade. Os testes instrumentais exigidos pelo departamento como parte do protocolo normal foram os seguintes: exames de sangue, ECG e exame cardiológico, e Tomografia Computadorizada de Feixe Cônico do arco dental. Cerca de 10 dias antes da colocação do implante, todos os pacientes passaram por sessões de higiene oral profissional. Todos os pacientes receberam terapia antibiótica profilática: 2 g de amoxicilina 1 h antes da intervenção ou clindamicina 600 mg 1 h antes da colocação do implante se alérgicos à penicilina. Todos os pacientes enxaguaram a boca com enxaguante bucal de clorexidina 0,2% por 1 min antes de qualquer procedimento cirúrgico. Anestesia local (Septanest com adrenalina, 1/100.000, Septodont, Mataró, Espanha) foi administrada com uma técnica infiltrativa. A incisão e elevação de um retalho mucoperiosteal trapezoidal foram realizadas no local escolhido para o implante. Uma vez exposto o osso, a osteotomia foi realizada com um guia piloto de 2,0 mm de diâmetro, a 1100 rpm, com irrigação fria externa. A osteotomia inicial foi ampliada de acordo com as instruções do fabricante. Implantes dentários curtos (sistema Bicon, Boston, MA, EUA) para substituições de dentes únicos e múltiplos foram inseridos 2 a 3 mm abaixo do nível da crista óssea marginal, e capsulas de cicatrização foram utilizadas. O retalho foi reposicionado e suturado passivamente para permitir a cicatrização por intenção primária. Um protocolo cirúrgico em duas etapas foi utilizado. Três meses após a colocação do implante, a anestesia local (Septanest com adrenalina, 1/100.000, Septodont, Mataró, Espanha) foi realizada com uma técnica infiltrativa com um vasoconstritor. Todos os implantes foram expostos fazendo incisões lineares minimamente invasivas na crista e removendo todos os tecidos de crescimento acima. Uma vez removida a cápsula de cicatrização, uma impressão snap-on foi feita.
Após isso, um pilar de cicatrização de policarbonato com diâmetro de 4 (pré-molares) ou 5 (molares) mm foi inserido e engajado nos implantes. Os pacientes foram randomizados em grupos que receberam suas restaurações definitivas 8 (controle) ou 16 (teste) semanas após a conexão do pilar de cicatrização, a fim de avaliar a cicatrização dos tecidos moles peri-implantares ao longo de diferentes intervalos de tempo. Um exame radiográfico intraoral do local do implante foi realizado para todos os pacientes, a fim de avaliar a fixação correta do pilar de cicatrização inicialmente e sua restauração definitiva posteriormente. O sistema de alinhamento Rinn foi utilizado.
2.2. Técnica de Coleta de Biópsia
Em ambos os grupos, em diferentes intervalos de tempo, uma biópsia do tecido mole peri-implantar foi coletada imediatamente antes da entrega da prótese definitiva. A anestesia foi realizada com uma técnica infiltrativa a 10 mm do local da amostra. Um mucótomo de 5 (pré-molares) ou 6,5 (molares) mm de diâmetro foi utilizado ao redor dos pilares de base hemisférica. Cada amostra incluía os tecidos moles formados ao redor dos pilares durante o período de cicatrização de 8 ou 16 semanas (Figura 1). As amostras foram seccionadas em duas partes idênticas. As primeiras partes do tecido coletado foram fixadas em formalina tamponada neutra a 10% para exame óptico. As segundas partes foram fixadas em glutaraldeído a 2,5% em PBS 0,1 M pH 7,4 por pelo menos 4 dias para observação em microscópio eletrônico de varredura. O tratamento analgésico pós-cirúrgico com ibuprofeno 600 mg foi prescrito conforme necessário. Todos os pacientes foram rigorosamente acompanhados ao longo dos seis meses seguintes para avaliar a cicatrização completa do tecido mole coletado.
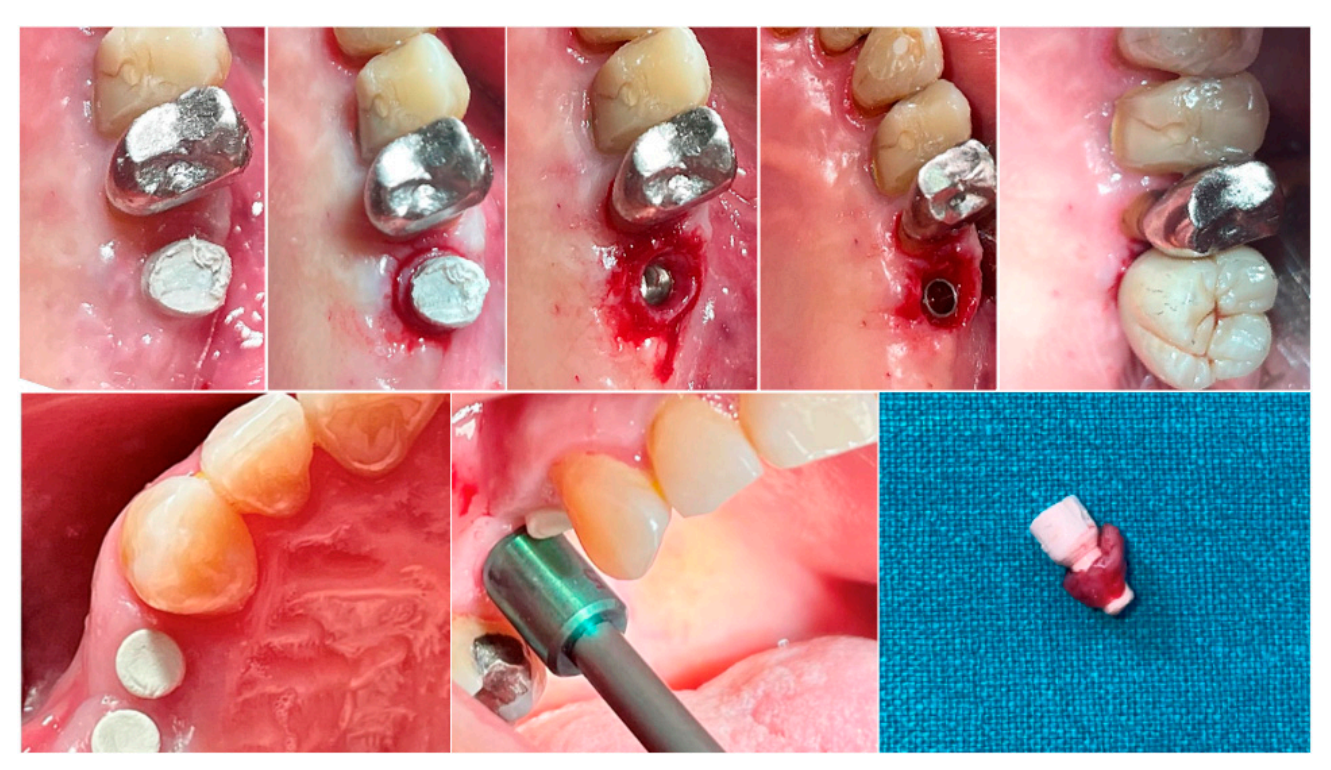
2.3. Medidas de Resultado
O resultado primário foi a falha do implante, definida como mobilidade, infecção, fratura e/ou qualquer outro problema mecânico ou biológico que determinasse sua remoção. Além disso, quaisquer complicações biológicas (por exemplo, dor resistente a medicamentos, inchaço, MBL excessiva, supuração, etc.) e/ou técnicas (por exemplo, fratura do material de revestimento e/ou estrutura, afrouxamento de parafusos, etc.) foram registradas durante o acompanhamento.
Os resultados secundários foram análise histológica com histomorfometria e análise por microscopia eletrônica de varredura (SEM).
Todas as amostras histológicas foram analisadas no Departamento de Ciências Radiológicas, Oncológicas e Patológicas, “La Sapienza”, Universidade de Roma, Itália. Para o diagnóstico histológico, dois grupos foram definidos: aqueles que passaram por 8 ou 16 semanas de cicatrização após a exposição do implante. Para a análise histológica, as amostras coletadas foram divididas em duas partes para exames transversais e longitudinais. Todas as amostras foram embebidas em parafina e cortadas usando um microtomo para obter seções transversais e longitudinais a serem usadas para as análises morfológicas. Para cada amostra fixada em formalina, duas partes foram embebidas em cera de parafina, a primeira cortada ao longo do eixo longitudinal para ver todos os eixos longos do espécime, e a segunda ao longo do eixo semi-circunferencial para ver o eixo curto do espécime. As seções histológicas foram coradas com Hematoxilina e Eosina, tricrômio de Masson e Picro Sirius, e observadas por um microscópio óptico Leica (Leitz Camera, Wetzlar, Alemanha).
A organização das fibras de colágeno foi avaliada através de exame histológico das seções transversais coradas com Hematoxilina e Eosina, tricrômico de Masson e Picro Sirius (com e sem luz polarizada) e observadas por um microscópio óptico Leica. A largura biológica foi medida como a altura e o perfil das seções histológicas longitudinais analisadas com análise microscópica de luz e coradas histquimicamente com Hematoxilina e Eosina e observadas por um microscópio óptico Leica. A organização das fibras de colágeno também foi avaliada com um microscópio eletrônico de varredura (ZEISS EVO 40, ZEISS, Oberkochen, Alemanha).
Medidas quantitativas e histomorfométricas foram avaliadas nas seções longitudinais usando o software ImageJ 1.54 (Instituto Nacional de Saúde, Bethesda, MD, EUA) com aumento de 1.6× . A padronização do microscópio foi garantida pelo uso do mesmo microscópio óptico Leica para as análises morfológicas, e dois pesquisadores especialistas (R.C., C.D.G.), cegos quanto ao tipo de amostra, realizaram as avaliações e as medidas histomorfométricas.
Para a análise por microscopia eletrônica de varredura, as amostras passaram por pós-fixação em solução de tetróxido de osmio a 2% em H2O por 2 h. As amostras foram então lavadas em H2O duas vezes por 20 min para remover a solução de pós-fixação. A desidratação em uma série ascendente de soluções alcoólicas (30–50–70–95–100%) foi então realizada. Para preservar os detalhes ultrestruturais de sua superfície, as amostras foram secas em um aparelho Emitech K850, de “secagem em ponto crítico” (Emitech Ltd., Ashford, Kent, Inglaterra). As amostras secas foram montadas com cola de prata em suportes de alumínio e, em seguida, revestidas com platina (2 min, 15 mA) usando um revestidor de pulverização Emitech K 550 (Emitech Ltd., Ashford, Kent, Inglaterra). As amostras foram observadas em condições de alto vácuo a 12 kV por um microscópio eletrônico de varredura Hitachi SU3500 (Hitachi Ltd., Hitachi, Japão).
2.4. Tamanho da Amostra e Randomização
O cálculo do tamanho da amostra não foi realizado devido ao fato de que o presente estudo foi considerado um ensaio clínico piloto e observacional. Uma lista de randomização gerada por computador foi criada. Apenas um dos investigadores, não envolvido na seleção e tratamento dos pacientes, estava ciente da sequência de randomização. Os códigos randomizados foram encerrados em envelopes idênticos, opacos, selados e numerados sequencialmente. Os envelopes foram abertos sequencialmente imediatamente após a tomada da impressão; portanto, a alocação do tratamento foi ocultada dos investigadores durante a inscrição e o tratamento dos pacientes.
2.5. Análise Estatística
Todas as análises foram realizadas de acordo com um plano de análise pré-estabelecido utilizando o software SPSS para Mac OS X (versão 22.0; SPSS, Chicago, IL, EUA). Um dentista (M.T.) analisou os dados. A análise descritiva foi realizada para parâmetros numéricos utilizando médias ± DP. Diferenças nas composições médias dos tecidos (altura e perfil) em 8 e 16 semanas foram comparadas usando testes t pareados. O paciente foi a unidade estatística das análises. Todas as comparações estatísticas foram conduzidas com um nível de significância de 0,05.
Resultados
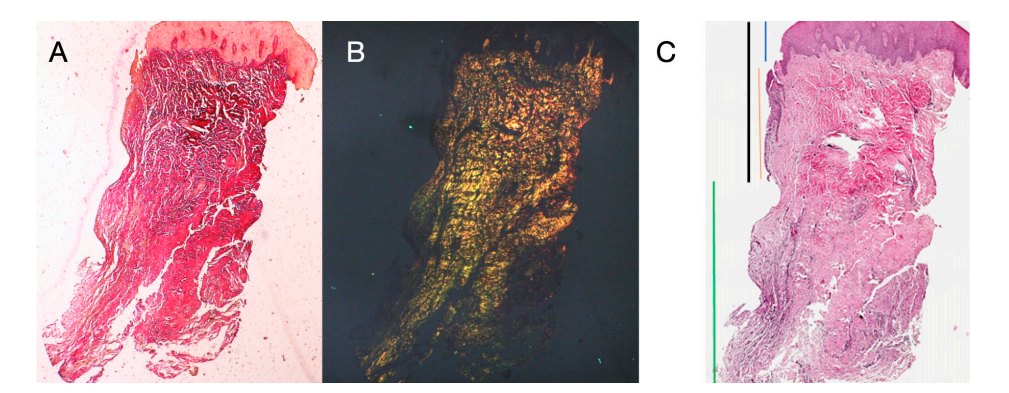
Oito pacientes com idades entre 38 e 63 anos foram selecionados, quatro mulheres e quatro homens (idade média 51,5 ± 9 anos). Cada paciente recebeu duas biópsias em dois locais diferentes de acordo com a randomização. Tanto em 8 quanto em 16 semanas após a exposição do implante, o exame clínico mostrou tecidos peri-implantares saudáveis. Nenhum paciente desistiu. Nenhum implante falhou durante a osseointegração e nenhuma complicação biológica ou técnica foi experienciada até seis meses após a entrega da prótese. Na análise microscópica de luz, os tecidos mostraram uma ausência total de inflamação e uma organização aumentada das fibras de colágeno dispostas circumferencialmente ao pilar. A quantidade de tecido incluída nas amostras permitiu a preparação de várias seções com diferentes colorações para microscopia de luz e eletrônica de varredura. O exame histológico das seções transversais realizadas 8 semanas após a exposição do implante mostrou a quase completa ausência de revestimento epitelial no local do implante, que era composto por tecido conjuntivo frouxo com pequenos vasos recém-formados na presença de extravasamentos hemorrágicos focais e infiltrado inflamatório linfocítico. O tecido conjuntivo adjacente parecia mais denso, com abundante infiltração inflamatória composta por linfócitos e células plasmáticas predominantemente dispostas ao redor de pequenas estruturas vasculares. Além disso, os feixes de tecido conjuntivo na porção superficial mostraram um padrão circular. Durante o exame com tricrômico de Masson e Picro Sirius, este último, observado sob um microscópio óptico com luz polarizada, demonstrou a quase exclusiva presença de colágeno tipo I (Figura 2).
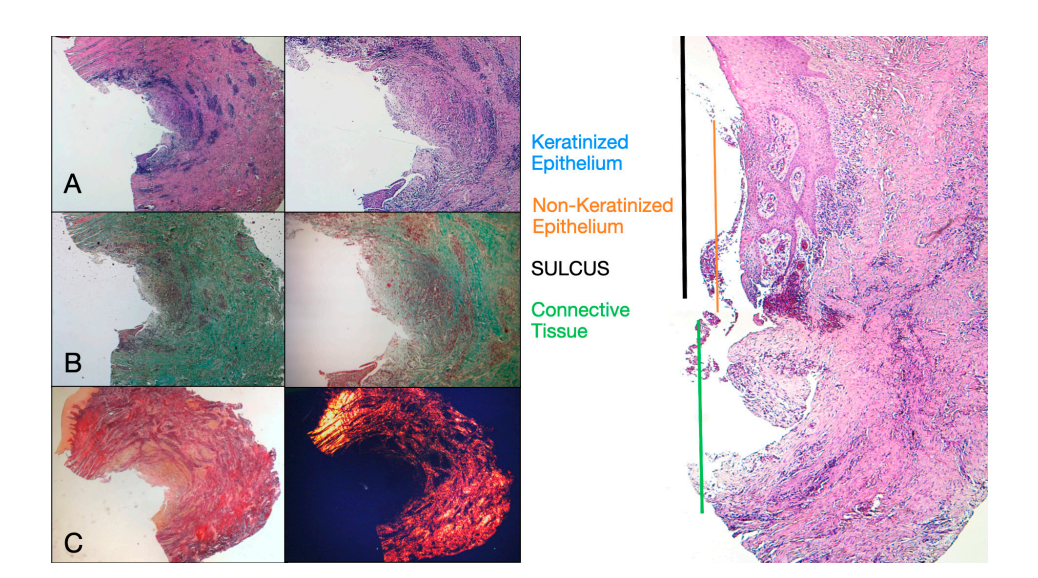
O tecido analisado nas seções longitudinais mostrou como a área do sulco é dividida em duas partes, caracterizadas por uma área que começa na margem gengival revestida por epitélio malpighiano queratinizado e uma área revestida por epitélio com queratinização menos evidente. Esta última é contínua com uma área desepitelializada composta exclusivamente por tecido conjuntivo frouxo com vasos recém-formados. No contexto do tecido conjuntivo, há um infiltrado inflamatório de linfócitos e células plasmáticas nas áreas subepiteliais e perivasculares (Figura 1). A coloração Picro Sirius da seção longitudinal realizada 8 semanas após a exposição do implante mostra a presença de alguns feixes de colágeno, originários da porção do tecido conjuntivo adjacente ao osso, que correm verticalmente em direção à margem livre da gengiva, juntamente com uma desorganização substancial das outras fibras de colágeno (Figura 3).
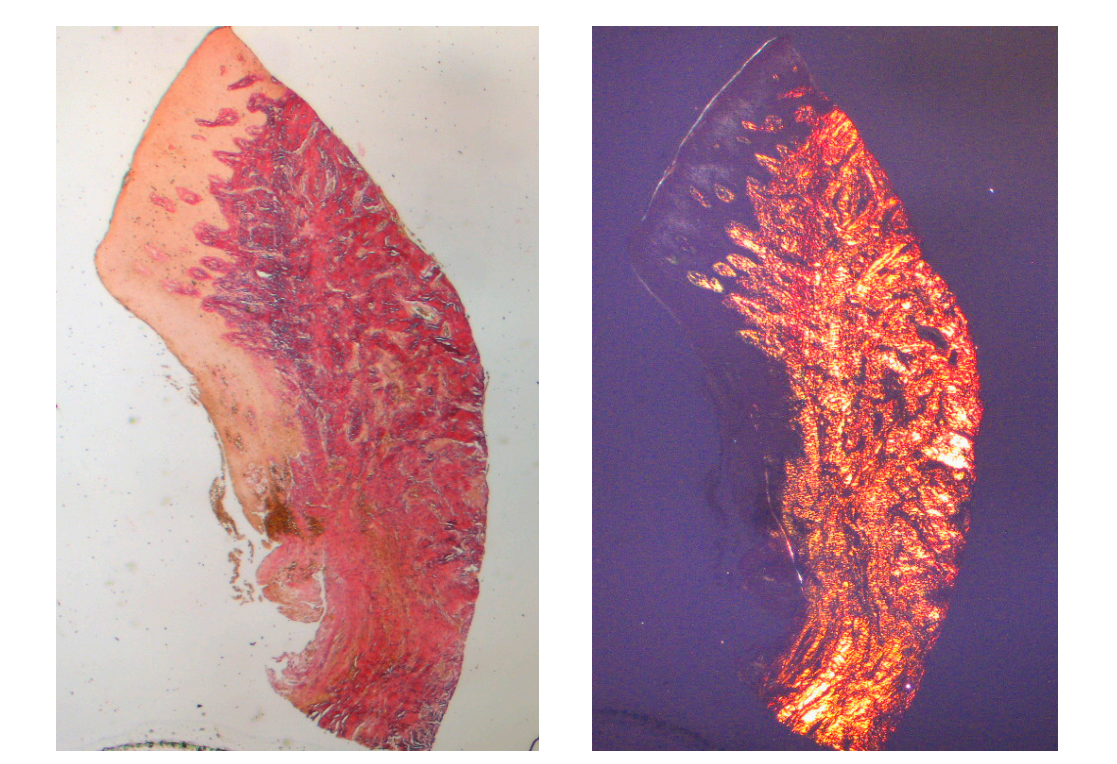
A análise histoquímica da seção transversal do tecido coletado 16 semanas após a exposição do implante mostra a presença parcial de revestimento epitelial não queratinizado no local do implante, que é composto por tecido conjuntivo frouxo maduro livre de infiltrado inflamatório. O tecido conjuntivo mais externo é mais organizado do que na amostragem anterior. Os feixes de colágeno mostraram uma maior organização com um curso circunferencial ao redor do pilar. A coloração com tricrômico de Masson e Picro Sirius, este último também observado com luz polarizada, demonstrou a presença quase exclusiva de colágeno tipo I. As imagens obtidas com essas colorações mostram mais claramente a organização e orientação das fibras circulares. A coloração da seção longitudinal com Picro Sirius mostra, apesar dos artefatos, a organização vertical das fibras de colágeno na porção inferior da peça (Figura 4).
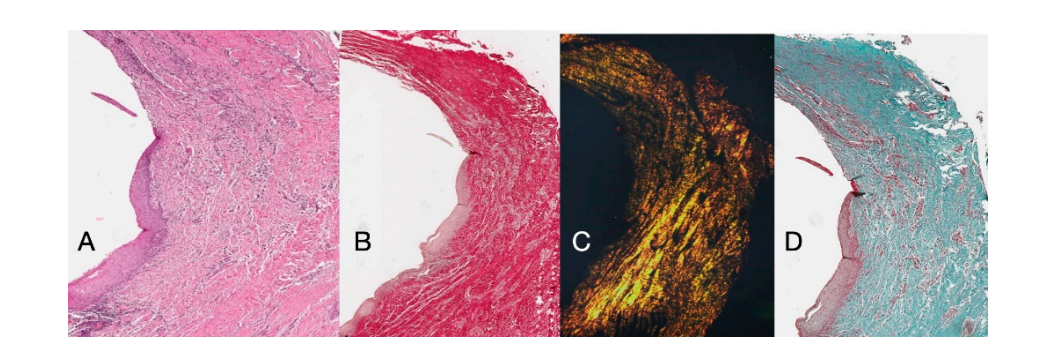
As seções longitudinais histoquímicas realizadas 16 semanas após a exposição do implante mostraram áreas do sulco divididas em uma área que começa na margem gengival, revestida por epitélio malpighiano queratinizado, e uma área revestida por epitélio não queratinizado. Esta última é contínua com uma área desepitelizada composta exclusivamente por tecido conjuntivo. O tecido conjuntivo foi mostrado ser composto por colágeno tipo I e livre de infiltrado inflamatório (Figura 5).
Finalmente, a análise histológica não mostrou diferenças estatisticamente significativas entre a composição do tecido mole em ambos os intervalos de tempo, tanto para altura quanto para perfil. As larguras biológicas médias medidas em 8 e 16 semanas foram de 3,2 e 3,1 mm, em altura, e 5,5 em perfil em ambos os acompanhamentos (Tabela 1).
A observação com microscópio eletrônico de baixa ampliação (Figura 6A) das amostras mostra que a mucosa peri-implante está livre de inflamação, edema ou extravasamento de sangue. Ao redor do pilar de cicatrização, observa-se a presença de tecido conjuntivo maduro, rico em fibras de colágeno organizadas de forma ordenada. Em ampliações maiores (Figura 6B,C) fibras de colágeno onduladas são visíveis, organizadas de maneira ordenada e paralela; elas têm uma organização predominantemente circular ao redor do pilar.
Para analisar essa matriz densa em mais detalhes, imagens com ampliação de 300× e 500× foram capturadas com um microscópio eletrônico de varredura. Nessas ampliações, fibras de colágeno finas podem ser facilmente observadas, que surgem da membrana basal (Figura 6D,E) e que se projetam como fibras únicas não organizadas em feixes.

Discussão
Hoje, os implantes dentários são um procedimento comum e extremamente eficaz para restaurar dentes ausentes. A investigação sobre os fatores que mantêm os tecidos peri-implantares em um estado saudável e estável a longo prazo tem sido o foco principal da pesquisa sobre implantes. Para reduzir a perda óssea marginal e manter os níveis de tecido mole peri-implantado, diferentes abordagens foram estabelecidas, incluindo designs de micro e macro-implantes, procedimentos cirúrgicos e prostodonticos, troca de plataforma e conexões implante-abutment.
A função primária dos tecidos periodontais, além de anexar o dente à mandíbula, é a proteção gengival; ou seja, sua função é fornecer um selo contra o ambiente contaminado da cavidade oral, suportar as forças de fricção da mastigação e defender a interface entre os dentes e o tecido mole contra invasores estrangeiros. A largura biológica ao redor do implante é diferente daquela ao redor dos dentes naturais em muitos aspectos, incluindo conceito, formação, remodelação, tamanho e estrutura, e desempenha um papel importante na remodelação dos tecidos moles e duros peri-implantares. No presente estudo, colheitas de tecido mole peri-implantado foram realizadas em 8 e 16 semanas após a descoberta do implante e a colocação de um abutment de cicatrização hemisférico de policarbonato. Oito semanas de cicatrização foram escolhidas como condição de controle. A presença de uma barreira natural de tecido conjuntivo e epitélio em 8 semanas está de acordo com vários estudos que realizaram experimentos em animais. No entanto, as colheitas feitas em 8 semanas mostraram uma remodelação modesta, com infiltração de linfócitos e células plasmáticas perivascular e os tecidos peri-implantares apresentando características morfoestruturais sobrepostas a tecidos saudáveis. Amostras em 16 semanas mostraram uma ausência total de inflamação e uma organização aumentada das fibras de colágeno dispostas de forma circunferencial ao abutment. Além disso, nas seções histológicas longitudinais havia um padrão morfoestrutural onde a área do sulco estava dividida em duas partes, com uma área começando a partir da margem gengival revestida por epitélio Malpighiano queratinizado e uma área revestida por epitélio com queratinização menos óbvia (JE). O principal arranjo das fibras era paralelo nos cortes longitudinais (Figura 4), em relação ao eixo do implante, e circular nas seções transversais (Figura 3). Em ampliações maiores, 300× e 500× (Figura 6B,C) fibras de colágeno onduladas dispostas de maneira ordenada e paralela puderam ser observadas. Essas fibras exibiram principalmente uma organização circular ao redor do abutment. Fibras de colágeno finas que surgem da membrana basal e projetam-se como fibras únicas não organizadas em feixes puderam ser facilmente observadas nas imagens SEM de 3000× e 5000× (Figura 6D,E).
O presente estudo mostrou que um design de pilar hemisférico facilita a formação de um colar de tecido conjuntivo estruturado com fibras altamente alinhadas, em comparação com a distribuição aleatória observada em pilares de paredes paralelas. Isso sugere que a organização da MEC pode ser influenciada pela geometria do tecido em macroescala, orientando o arranjo das fibras e a morfogênese. Estudos semelhantes descreveram esse efeito em implantes de troca de plataforma, onde a orientação do colágeno fornece retenção mecânica para as fibras periodontais. Modelos animais também relataram redes de fibras colágenas circulares supracrestais comparáveis a ligamentos gengivais.
Um estudo pré-clínico recente demonstrou que um design transmucoso côncavo poderia promover uma maior deposição e crescimento de tecido conjuntivo em comparação com um design reto. Os resultados indicaram um aumento na espessura do tecido conjuntivo, uma rede peri-implantar mais densa e o alinhamento das fibras de colágeno em direção ao colar do pilar, formando uma ampla estrutura circular de colágeno ao redor da plataforma do implante. O presente estudo apoia essas observações, uma vez que a introdução de um perfil hemisférico facilitou o arranjo das fibras de colágeno em feixes paralelos bem organizados.
A orientação das fibras de colágeno é um fator biomecânico chave, refletindo as forças que atuam sobre o tecido conjuntivo, particularmente através dos feixes de colágeno. Pesquisas mostraram que um acúmulo excessivo de colágeno orientado aleatoriamente pode levar à formação de tecido fibroso disfuncional. A organização direcional das fibras de colágeno é crucial para a estabilidade do tecido mole peri-implante, como observado por Karjalainen et al.
No presente estudo, as larguras biológicas médias foram de 3,2 e 3,1 mm em 8 e 16 semanas, respectivamente. Comparando os resultados atuais com outros estudos semelhantes, em um estudo de Tommasi et al., em 8 semanas após a exposição, o valor médio foi de 2,7 mm, incluindo 1,5 mm de epitélio e 1,2 mm de tecido conjuntivo, enquanto a dimensão do perfil foi de 3,6 mm. No presente estudo, as larguras biológicas médias foram um pouco mais altas tanto no epitélio quanto no tecido conjuntivo. No entanto, um grande aumento foi encontrado para o perfil geral. A principal diferença é que, no estudo de Tommasi, o segundo acompanhamento foi em 12 semanas em vez de 16 semanas. Uma possível explicação para essa diferença é que os tecidos continuam a crescer por pelo menos 4 meses após a reabertura.
Através da SEM, também é possível encontrar fibras de colágeno onduladas organizadas de maneira ordenada e paralela, com uma organização predominantemente circular em torno do pilar.
Em relação a isso, pode-se supor que as organizações predominantes das faixas de colágeno circulares e das faixas de colágeno verticais foram organizadas em relação ao design do pilar. Sob esse ponto de vista, a possibilidade de usar implantes ou sistemas de implante–coroa que favoreçam a estabilidade do selamento mucoso representa uma área importante de pesquisa. Essa solução desloca o selamento conectivo apicalmente em relação aos componentes protéticos, cujos micro-movimentos—frequentemente impedindo a formação estável de tecido conectivo—não comprometem a estabilização final do selamento. A principal limitação da presente pesquisa foi o pequeno tamanho da amostra, devido ao fato de que um cálculo do tamanho da amostra não foi realizado. Mais ensaios clínicos com amostras maiores são necessários para confirmar esses resultados preliminares.
Conclusões
Histologicamente, não houve diferenças na altura e no perfil da gengiva entre 8 e 16 semanas de cicatrização após a exposição do implante. Com 16 semanas, mais tecido foi encontrado em ambos os grupos. Uma maior organização das fibras de colágeno em cursos circunferenciais ao redor dos pilares foi encontrada no grupo de teste (16 semanas) em comparação com o grupo controle (8 semanas).
Fabrizio Zaccheo, Giulia Petroni, Marco Tallarico, Cherana Gioga, Raffaella Carletti, Cira Rosaria Tiziana Di Gioia, Vincenzo Petrozza, Silvio Mario Meloni, Dario Melodia, Milena Pisano e Andrea Cicconetti
Referências:
- Tallarico, M.; Lumbau, A.M.I.; Meloni, S.M.; Ieria, I.; Park, C.-J.; Zadroz˙ny, L.; Xhanari, E.; Pisano, M. Estudo prospectivo de cinco anos sobre falha de implante e remodelação óssea marginal esperada usando implantes de nível ósseo com superfície jateada/ácido-etchada e conexão cônica. Eur. J. Dent. 2022, 16, 787–795. [CrossRef]
- Zheng, Z.; Ao, X.; Xie, P.; Jiang, F.; Chen, W. A largura biológica ao redor do implante. J. Prosthodont. Res. 2021, 65, 11–18. [CrossRef]
- Berglundh, T.; Lindhe, J. Dimensão da mucosa peri-implantar. Largura biológica revisitada. J. Clin. Periodontol. 1996, 23, 971–973. [CrossRef]
- Schierano, G.; Ramieri, G.; Cortese, M.; Aimetti, M.; Preti, G. Organização da barreira de tecido conjuntivo ao redor de pilares de implante carregados a longo prazo em humanos. Clin. Oral Implant. Res. 2002, 13, 460–464. [CrossRef]
- Rodríguez, X.; Navajas, A.; Vela, X.; Fortuño, A.; Jimenez, J.; Nevins, M. Arranjo das fibras de tecido conjuntivo peri-implantar ao redor de implantes com troca de plataforma e pilares cônicos e sua relação com o osso subjacente: Um estudo histológico humano. Int. J. Periodontics Restor. Dent. 2016, 36, 533–540. [CrossRef]
- van Eekeren, P.; van Elsas, P.; Tahmaseb, A.; Wismeijer, D. A influência da espessura mucosa inicial na mudança do osso crestal em implantes de macrogeometria semelhante: Um ensaio clínico randomizado prospectivo. Clin. Oral Implant. Res. 2017, 28, 214–218. [CrossRef]
- Mishra, S.K.; Chowdhary, R.; Kumari, S. Microvazamento na interface de diferentes pilares de implante: Uma revisão sistemática. J. Clin. Diagn. Res. 2017, 11, ZE10–ZE15. [CrossRef]
- Tallarico, M.; Canullo, L.; Caneva, M.; Özcan, M. Colonização microbiana na interface implante-pilar e sua possível influência na peri-implantite: Uma revisão sistemática e meta-análise. J. Prosthodont. Res. 2017, 61, 233–241. [CrossRef]
- Schroeder, H.E.; Listgarten, M.A. Os tecidos gengivais: A arquitetura da proteção periodontal. Periodontology 2000 1997, 13, 91–120. [CrossRef]
- Schupbach, P.; Glauser, R. A arquitetura de defesa da mucosa peri-implantar humana: Um estudo histológico. J. Prosthet. Dent. 2007, 97 (Suppl. S6), S15–S25, Errata em J. Prosthet. Dent. 2008, 99, 167. [CrossRef]
- James, R.A.; Schultz, R.L. Hemidesmosomos e a adesão de células epiteliais junctivas a implantes metálicos—Um relatório preliminar. J. Oral Implantol. 1974, 4, 294–302.
- Atsuta, I.; Ayukawa, Y.; Kondo, R.; Oshiro, W.; Matsuura, Y.; Furuhashi, A.; Tsukiyama, Y.; Koyano, K. Selamento de tecido mole ao redor de implantes dentários com base na interpretação histológica. J. Prosthodont. Res. 2016, 60, 3–11. [CrossRef]
- Berglundh, T.; Abrahamsson, I.; Welander, M.; Lang, N.P.; Lindhe, J. Morfogênese da mucosa peri-implantar: Um estudo experimental em cães. Clin. Oral Implant. Res. 2007, 18, 1–8. [CrossRef] [PubMed]
- Moraschini, V.; Poubel, L.d.C.; Ferreira, V.; Barboza, E.d.S. Avaliação das taxas de sobrevivência e sucesso de implantes dentários relatadas em estudos longitudinais com um período de acompanhamento de pelo menos 10 anos: Uma revisão sistemática. Int. J. Oral Maxillofac. Surg. 2015, 44, 377–388. [CrossRef]
- Atieh, M.A.; Ibrahlm, H.M.; Atieh, H.A. Troca de plataforma para preservação do osso marginal ao redor de implantes dentários: Uma revisão sistemática e meta-análise. J. Periodontol. 2010, 81, 1350–1366.
- Bateli, M.; Att, W.; Strub, J.R. Configurações do pescoço do implante para preservação do nível ósseo marginal: Uma revisão sistemática. Int. J. Oral Maxillofac. Implant. 2011, 26, 290–303.
- Schwarz, F.; Hegewald, A.; Becker, J. Impacto da conexão implante-pilar e posicionamento do colar/microgap usinado nas mudanças do nível ósseo crestal: Uma revisão sistemática. Clin. Oral Implant. Res. 2014, 25, 417–425. [CrossRef]
- Tetè, S.; Mastrangelo, F.; Bianchi, A.; Zizzari, V.; Scarano, A. Orientação das fibras de colágeno ao redor de pescoços de implantes dentários de titânio e zircônia usinados: Um estudo animal. Int. J. Oral Maxillofac. Implant. 2009, 24, 52–58.
- Schwarz, F.; Herten, M.; Sager, M.; Bieling, K.; Sculean, A.; Becker, J. Comparação de defeitos ósseos peri-implantares naturalmente ocorrentes e induzidos por ligadura em humanos e cães. Clin. Oral Implant. Res. 2007, 18, 161–170, Errata em Clin. Oral Implant. Res. 2007, 18, 397. [CrossRef] [PubMed]
- Vignoletti, F.; Johansson, C.; Albrektsson, T.; De Sanctis, M.; Roman, F.S.; Sanz, M. Cicatrização precoce de implantes colocados em alvéolos de extração frescos: Um estudo experimental em cães beagle. Formação de novo osso. J. Clin. Periodontol. 2009, 36, 265–277. [CrossRef] [PubMed]
- Liu, Y.; Wang, J. Influências do microgap e micromovimento da interface implante-pilar na perda óssea marginal ao redor do pescoço do implante. Arch. Oral Biol. 2017, 83, 153–160. [CrossRef] [PubMed]
- Rodríguez, X.; Vela, X.; Calvo-Guirado, J.L.; Nart, J.; Stappert, C.F.J. Efeito da troca de plataforma na orientação das fibras de colágeno e reabsorção óssea ao redor de implantes dentários: Um estudo histológico animal preliminar. Int. J. Oral Maxillofac. Implant. 2012, 27, 1116–1122.
- Nelson, C.M. Controle geométrico da morfogênese do tecido. Biochim. Biophys. Acta BBA Mol. Cell Res. 2009, 1793, 903–910. [CrossRef] [PubMed]
- López-López, P.J.; Mareque-Bueno, J.; Boquete-Castro, A.; Aguilar-Salvatierra Raya, A.; Martínez-González, J.M.; Calvo-Guirado, J.L. Os efeitos de pilares de cicatrização de diferentes tamanhos e formas anatômicas colocados imediatamente em alvéolos de extração sobre os tecidos duros e moles peri-implantares. Um estudo piloto em cães foxhound. Clin. Oral Implant. Res. 2016, 27, 90–96. [CrossRef]
- Covani, U.; Giammarinaro, E.; Di Pietro, N.; Boncompagni, S.; Rastelli, G.; Romasco, T.; Velasco-Ortega, E.; Jimenez-Guerra, A.; Iezzi, G.; Piattelli, A.; et al. Análise de microscopia eletrônica (ME) das fibras de colágeno nos tecidos moles peri-implantares ao redor de dois pilares diferentes. J. Funct. Biomater. 2023, 14, 445. [CrossRef]
- Belloni, A.; Belloni, A.; Furlani, M.; Furlani, M.; Greco, S.; Greco, S.; Notarstefano, V.; Notarstefano, V.; Pro, C.; Pro, C.; et al. Leiomioma uterino como modelo útil para revelar o estado morfométrico e macromolecular do colágeno e comprometimento em doenças fibrosas: Um estudo humano ex-vivo. Biochim. Biophys. Acta BBA Mol. Basis Dis. 2022, 1868, 166494. [CrossRef]
- Karjalainen, V.-P.; Kestilä, I.; Finnilä, M.; Folkesson, E.; Turkiewicz, A.; Önnerfjord, P.; Hughes, V.; Tjörnstrand, J.; Englund, M.; Saarakkala, S. Análise quantitativa da orientação tridimensional do colágeno do corno posterior do menisco humano em saúde e osteoartrite usando micro-tomografia computadorizada. Osteoarthr. Cartil. 2021, 29, 762–772. [CrossRef]
- Tomasi, C.; Tessarolo, F.; Caola, I.; Wennström, J.; Nollo, G.; Berglundh, T. Morfogênese da mucosa peri-implantar revisitada: Um estudo experimental em humanos. Clin. Oral Implant. Res. 2014, 25, 997–1003. [CrossRef]