Caracterização dos sons de cortejo de espécies do subgrupo fasciola (Diptera, Drosophilidae, grupo Drosophila repleta): análises interspecíficas e interpoblacionais
Tradução automática
O artigo original está escrito em EN language (link para lê-lo) .
Resumo
O objetivo deste trabalho foi caracterizar o padrão da canção de cortejo masculino de várias espécies do subgrupo fasciola e determinar o nível de variação tanto dentro quanto entre as espécies. Os parâmetros analisados foram intervalo intrapulso (PI), intervalo interpulso (IPI) e frequência intrapulso (IF). Seis espécies diferentes foram analisadas: D. coroica (três populações), D. ellisoni, D. fascioloides, D. moju, D. onca e D. rosinae (uma população cada). Houve diferenças significativas entre as seis espécies para esses três parâmetros da canção de cortejo. O IPI foi o parâmetro mais variável entre essas espécies, sugerindo que este parâmetro é importante para a discriminação feminina. Quatro hipóteses diferentes poderiam explicar essa variação: 1. diferentes pressões de seleção com ausência de fluxo gênico; 2. seleção sexual intraespecífica; 3. efeitos simpátricos na evolução da canção; e 4. deriva genética. O PI foi o único parâmetro que foi significativamente diferente entre as três populações de D. coroica. Baixa variabilidade entre populações dentro da mesma espécie já foi observada para outros subgrupos e poderia ser explicada pelas seguintes hipóteses: forte seleção atuando sobre os parâmetros da canção, fluxo gênico ou colonização recente a partir de uma fonte comum. Estudos adicionais da canção de cortejo de outras espécies do subgrupo fasciola, bem como de outros subgrupos do grupo repleta, e estudos, utilizando marcadores moleculares, que se concentram na base genética das diferenças entre essas espécies na canção de cortejo nos permitiriam avaliar a associação da canção de cortejo e isolamento sexual nessas espécies, e também nos ajudariam a entender a evolução dessas diferenças comportamentais.
Introdução
Sonoros de cortejo
O comportamento de cortejo das moscas do gênero Drosophila é importante para o reconhecimento de espécies. Depois que Shorey (1962) mostrou que os machos de D. melanogaster emitiam sons durante o cortejo sexual, muitos estudos foram realizados com os vários grupos e subgrupos do gênero Drosophila, descrevendo a natureza específica dos tipos de som. Esses estudos forneceram evidências de que o som tem uma função tanto como estimulante sexual quanto na isolação sexual. Esses sons variam significativamente entre as várias espécies dos grupos affinis (Chang & Miller, 1978), melanogaster (Cowling & Burnet, 1981), virilis (Hoikkala et al., 1982; Hoikkala & Isoherranen, 1997), mercatorum (Ikeda & Maruo, 1982), repleta (Ewing & Miyan, 1986), auraria (Tomaru & Oguma, 1994), planitibia (Hoikkala et al., 1994), willistoni (Ritchie & Gleason, 1995), quinaria (Neems et al., 1997) e obscura (Noor & Aquadro, 1998).
As diferenças interespecíficas nos sons de cortejo de Drosophila são caracterizadas por um ou mais parâmetros sonoros, como: intervalo entre pulsos (IPI), que é o tempo desde o início de um pulso até o início do próximo; intervalo intrapulso (PI), que é a duração do pulso; frequência intrapulso (IF), que é acusticamente a frequência mais forte dentro do pulso; número de pulsos por série; e duração de cada intervalo dentro de uma série (Hoikkala & Lumme, 1987; Wheeler et al., 1988). Embora não tenha sido firmemente estabelecido quais parâmetros sonoros conferem especificidade, há evidências de que o IPI é importante. De acordo com Ritchie & Kyriacou (1996), o IPI dos sons de cortejo de Drosophila varia muito pouco dentro de populações naturais e é importante para o sucesso reprodutivo dos machos.
No entanto, é claro que muitas espécies de Drosophila produzem sons complexos com várias características, uma ou mais das quais podem ser valiosas na identificação de espécies. Essa especificidade nos sons de cortejo de Drosophila pode ser explicada pela seleção para discriminação entre espécies (Tomaru & Oguma, 1994) dos diferentes tipos de sons, que poderiam ter evoluído através da seleção sexual intraespecífica (Ritchie & Gleason, 1995). Além disso, os diferentes tipos de sons encontrados nas várias espécies de Drosophila poderiam simplesmente refletir divergências filogenéticas.
O subgrupo fasciola
As espécies do subgrupo fasciola são encontradas em florestas úmidas, principalmente nas da América Central e do Sul e nas ilhas do Caribe. No Brasil, foram coletadas da mata atlântica, bem como de florestas nos estados de São Paulo, Paraná, Mato Grosso do Sul e Bahia (Vilela, 1983; Vilela et al., 1983; Tidon-Sklorz & Sene, 1992).
A maior parte do trabalho sobre este subgrupo foi citológica e foi realizada no início dos anos 60, mostrando que as espécies deste grupo diferem de todas as outras do grupo repleta por possuírem as inversões homozigóticas: 2o2, 2e3 e 2l3. Wasserman (1982) propôs uma ancestralidade comum para os subgrupos fasciola e mulleri, porque eles possuem a inversão 3c em comum. Recentemente, no entanto, Diniz (1998) mostrou que a inversão 3c do subgrupo fasciola é diferente daquela encontrada no subgrupo mulleri e propôs que o subgrupo fasciola foi derivado diretamente do primitivo I, e não pode mais ser considerado ligado ao subgrupo mulleri. Kuhn et al. (1995) fez um estudo cariotípico de algumas espécies do subgrupo fasciola e encontrou variação interespecífica no tamanho do microcromossomo e no número de cromossomos.
De acordo com Wasserman (1992), o subgrupo fasciola consiste em nove espécies: D. pictilis e D. pictura, formando o complexo pictilis; D. paraguttata; D. mojuoides e D. moju, formando o complexo moju; e D. fulvalineata, D. fasciola, D. coroica e D. fascioloides, que não estão em nenhum complexo. Vilela (1983), estudando a morfologia dos genitais masculinos, determinou que a espécie D. fascioloides estudada por Wasserman (1962) na verdade não pertencia a essa espécie, e a renomeou como D. ellisoni. Ele também adicionou as espécies D. linearepleta e D. onca ao subgrupo fasciola e descreveu D. carolinae, D. hermionae, D. ivai, D. querubimae, D. rosinae e D. senei como novas espécies, aumentando para 18 o número de espécies neste subgrupo.
Neste trabalho, descrevemos os padrões sonoros de cortejo de seis espécies do subgrupo fasciola: D. ellisoni, D. fascioloides, D. moju, D. onca, D. rosinae e D. coroica. Além das análises interespecíficas, também examinamos as diferenças nos padrões sonoros de três populações diferentes de D. coroica.
Materiais e métodos
Estabelecimento e manutenção de isolinas
Isolinas foram produzidas a partir de fêmeas individuais já acasaladas na natureza. Essas isolinas foram identificadas através da análise morfológica dos genitais de machos F1 (Vilela, 1983). Larvas de terceiro instar do subgrupo fasciola normalmente tentam sair do frasco de cultura. Para evitar esse problema, os frascos de cultura foram abertos e colocados em areia úmida dentro de garrafas plásticas para que as larvas pudessem se transformar em pupas na areia. As moscas eclodidas foram removidas com um aspirador e transferidas para frascos preenchidos com meio de cultura, onde amadureceram, acasalaram e puseram ovos, reiniciando o ciclo.
Gravações de som
Moscas virgens recentemente eclodidas foram isoladas em frascos de cultura de 35 ml e deixadas por 7-10 dias para permitir tempo para a maturação sexual. Subsequentemente, um macho e uma fêmea da mesma linhagem foram introduzidos em uma câmara de gravação de som descrita por Sene & Manfrin (1998). Para gravar o som, a câmara contendo o par de moscas foi colocada sobre o diafragma de um microfone ultrasensível, conforme descrito por Manfrin et al. (1997). As moscas foram observadas por um máximo de 10 minutos, ou até o acasalamento. Todas as gravações foram feitas a 25 ± 1ºC.
Análise sonora
Os sinais eletromagnéticos das gravações analógicas foram convertidos em sinais digitais a uma frequência de 5 KHz, com um circuito conversor analógico-digital CAD 12/36-60 k (Lynx) e o programa AqDADOS 4 (Lynx).
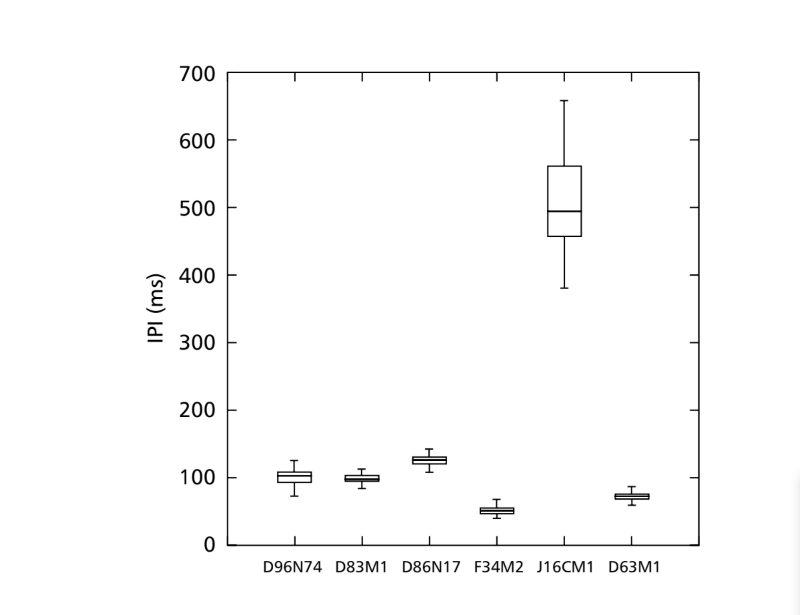
Os padrões sonoros de cortejo de seis espécies diferentes do subgrupo fasciola estão descritos na Tabela 1. Os padrões sonoros dos machos de D. coroica de três locais diferentes também foram analisados para estudar as diferenças interpopulacionais.
Os parâmetros utilizados para estudos comparativos dos padrões sonoros foram o intervalo intrapulso (PI), intervalo interpulso (IPI) e frequência intrapulso (IF). Os valores de PI e IPI foram obtidos diretamente das figuras. As IFs foram obtidas com a ajuda do software MATLAB (MathWorks, Inc.) utilizando Transformadas Rápidas de Fourier (FFT). Esta análise decompõe o sinal sonoro em uma série de ondas (senoides e cossenoides) de diferentes frequências e amplitudes. A IF de um som é definida como a frequência da onda de maior amplitude no sinal sonoro.
A FFT pode analisar sons contendo milhares de pontos por milissegundo, mas a eficiência máxima da análise é obtida restringindo o número de pontos a potências de base dois. Por esta razão, todos os intervalos utilizados para a análise de IF foram selecionados para que tivessem um número de pontos igual a potências de base dois. Portanto, intervalos de 64 pontos foram utilizados para D. moju; 128 pontos para D. rosinae e D. coroica; 256 pontos para D. ellissoni; e 512 pontos para D. onca e D. fascioloides. Dez medidas foram feitas dos parâmetros PI, IPI e IF para cada um dos 10 machos de cada uma das isolinas.
Análise estatística
As linhagens descritas na Tabela 1 foram analisadas com o objetivo de investigar diferenças interespecíficas. A isolina D96N74 foi escolhida como representante de D. coroica. As três linhagens (D96N74, D88M1 e J7C1) de D. coroica foram testadas separadamente para diferenças interpoblacionais. Os valores dos parâmetros intervalo intrapulso (PI), intervalo interpulso (IPI) e frequência intrapulso (IF) foram analisados separadamente por análise de variância (ANOVA UNIDIMENSIONAL) a um nível de significância de 0,05.
Resultados
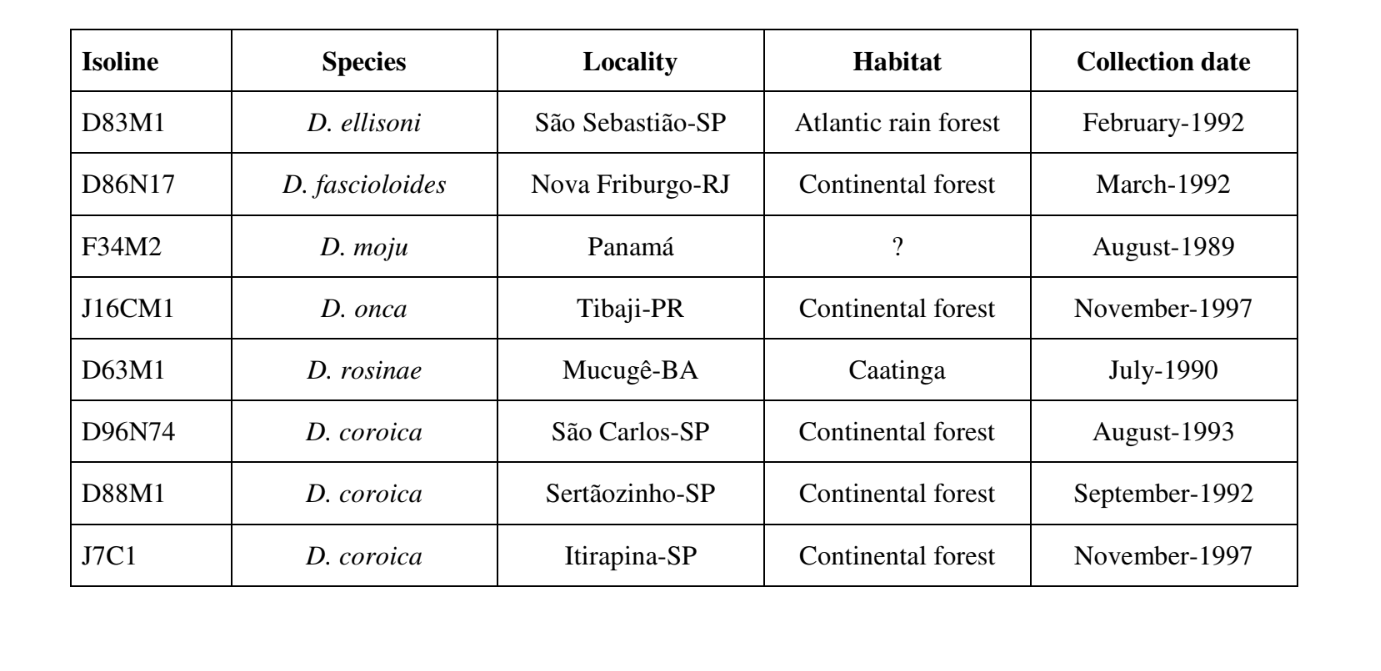
As Figs. 1 a 6 mostram os sonogramas básicos das várias espécies analisadas. A isolina D96N74 foi escolhida para representar a espécie D. coroica. Esses sonogramas e a análise dos pulsos sonoros permitem uma divisão dos sons de cortejo em três grupos distintos: 1. sons de cortejo das espécies D. onca, D. fascioloides e D. ellisoni, em que cada sequência sonora é composta por uma sequência de pulsos curtos, seguida por um trinado, semelhante ao encontrado em algumas espécies do subgrupo planitibia, denominado por Hoikkala et al. (1994) como canção de frase. Nas espécies D. fascioloides e D. onca, a sequência de pulsos é composta por quatro pulsos, seguida por um trinado relativamente longo, enquanto em D. ellisoni, há apenas dois pulsos, seguidos por um trinado mais curto; 2. o tipo típico do sonograma de D. rosinae, com um som de cortejo formado por pulsos simples, mas duplicados, um padrão também observado por Ewing & Miyan (1986) em algumas espécies do grupo repleta; 3. um tipo baseado nos sons de cortejo das espécies D. moju e D. coroica, com pulsos curtos em sequência, semelhante à canção de pulso de D. melanogaster (Schilcher, 1976) e som A de D. mercatorum (Ikeda & Maruo, 1982; Manfrin et al, 1997).
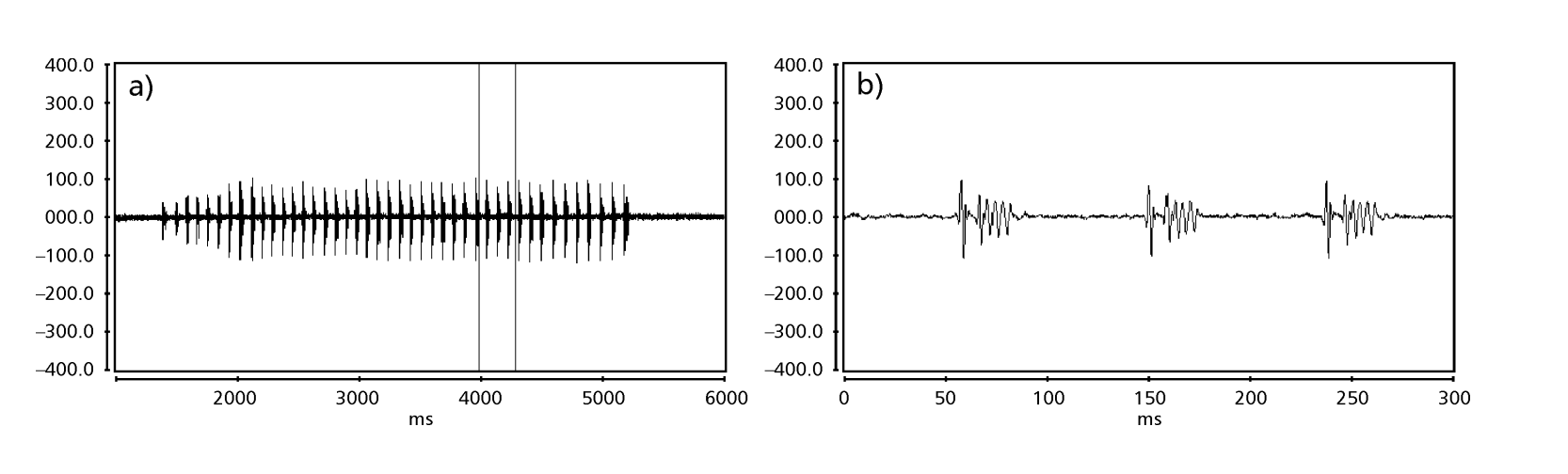
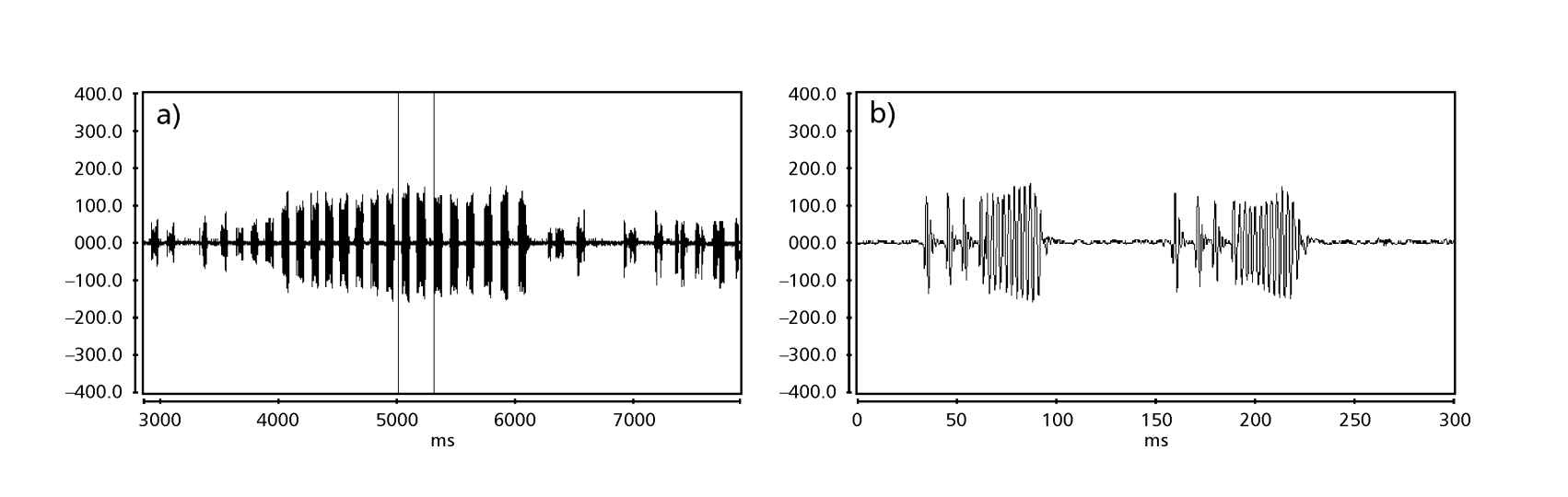
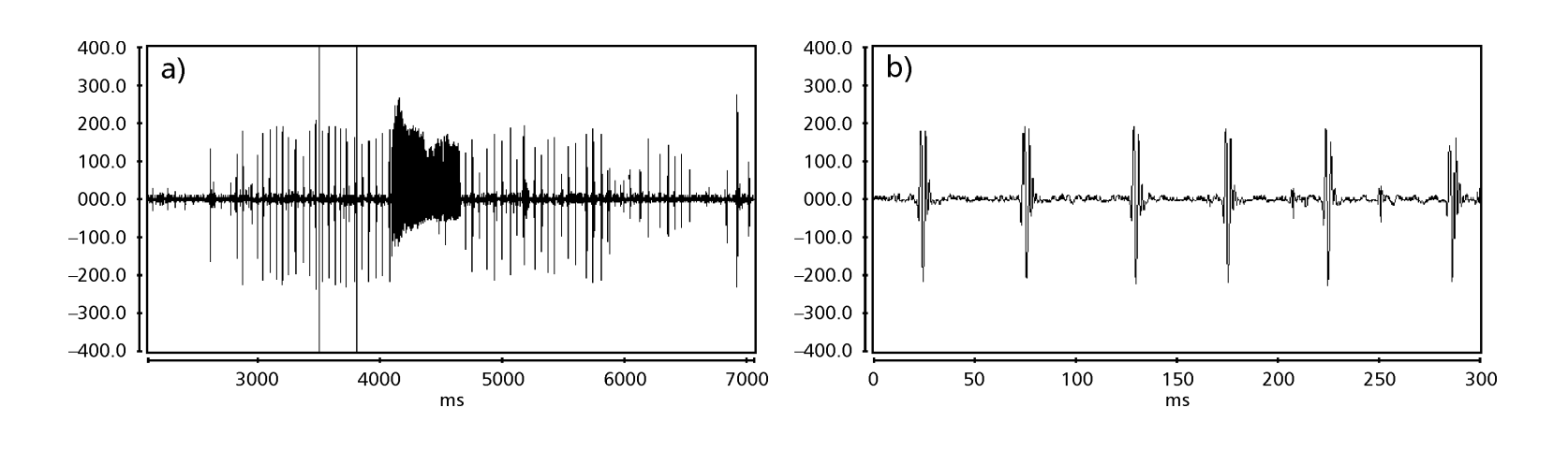
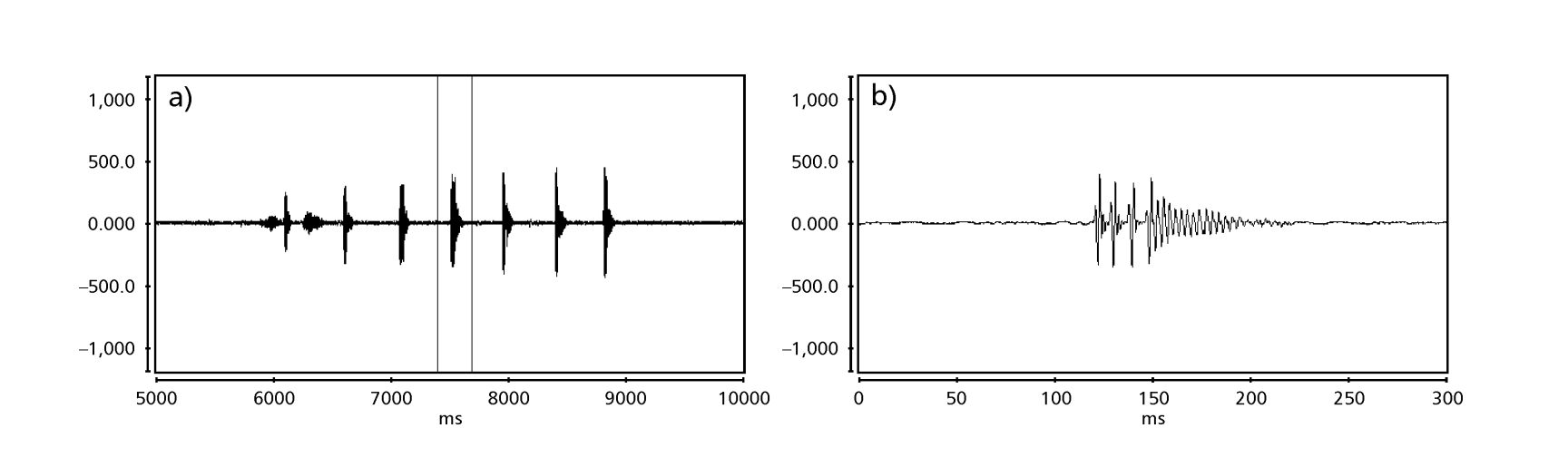
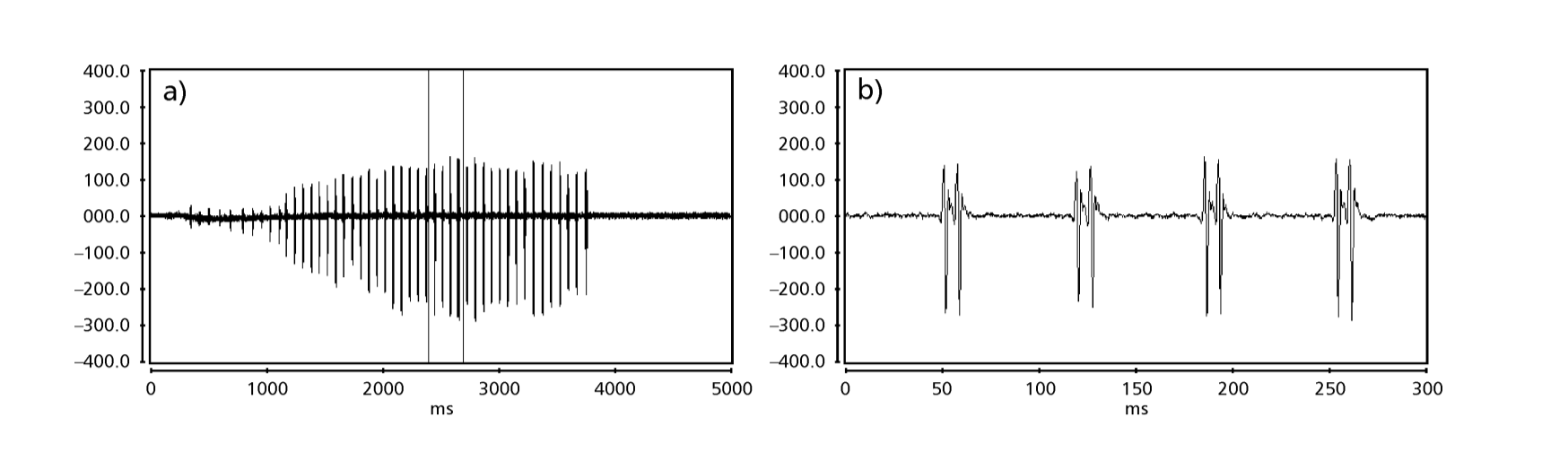
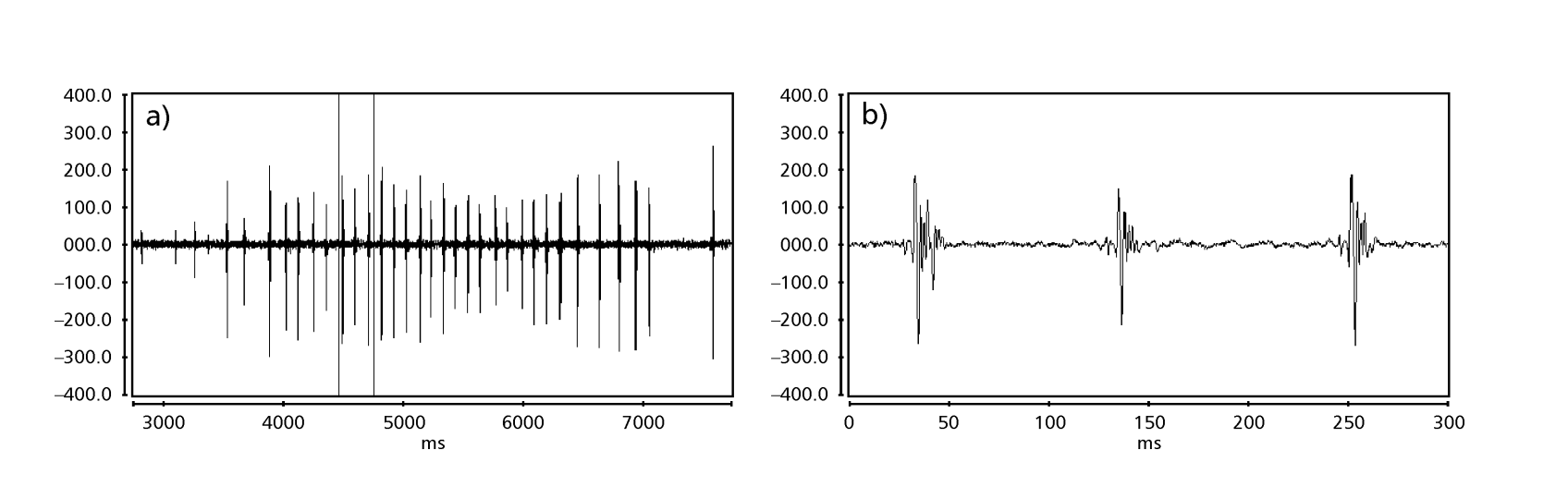
Os sonogramas de cada uma das espécies analisadas foram uma sequência de um tipo de pulso sonoro. Esta descoberta é diferente daquelas de estudos feitos nas espécies D. melanogaster (Schilcher, 1976), D. mercatorum (Ikeda & Maruo, 1982; Manfrin et al., 1997), e algumas espécies do subgrupo repleta (Ewing & Miyan, 1986), nas quais foram encontrados dois tipos diferentes de sons.
A Tabela 2 mostra os valores médios para PI (intervalo intrapulso), IPI (intervalo interpulso) e IF (frequência intrapulso) das isolinhas descritas na Tabela 1. Uma comparação das desvios padrão (± dp) entre as várias espécies mostra que D. ellisoni e D. fascioloides têm a menor variação para os três parâmetros: PI (27.470 ± 2.73 e 69.859 ± 6.12), IPI (97.473 ± 5.76 e 125.757 ± 7.87), e IF (251.358 ± 19.36 e 362.901 ± 17.04), indicando que os sons de cortejo dessas espécies são uniformes com pouca variação intraespecífica. Por outro lado, D. onca teve variação considerável em PI (93.662 ± 31.44) e IPI (508.091 ± 73.06) e variação moderadamente alta em IF (289.260 ± 32.71) quando comparado às outras espécies, indicando que as diferenças em PI e IPI, embora grandes, não foram suficientes para alterar significativamente a forma de onda do pulso. Os desvios padrão foram relativamente baixos para PI (7.363 ± 7.36 e 14.673 ± 1.98) e IPI (50.859 ± 5.47 e 72.340 ± 5.68) em D. moju e D. rosinae, mas os valores de IF foram relativamente altos (412.501 ± 55.63 e 306.624 ± 57.80). Neste caso, embora a duração do pulso e o tempo de um pulso para o próximo fossem relativamente uniformes dentro de cada uma dessas espécies, a forma de onda do pulso sonoro variou consideravelmente.
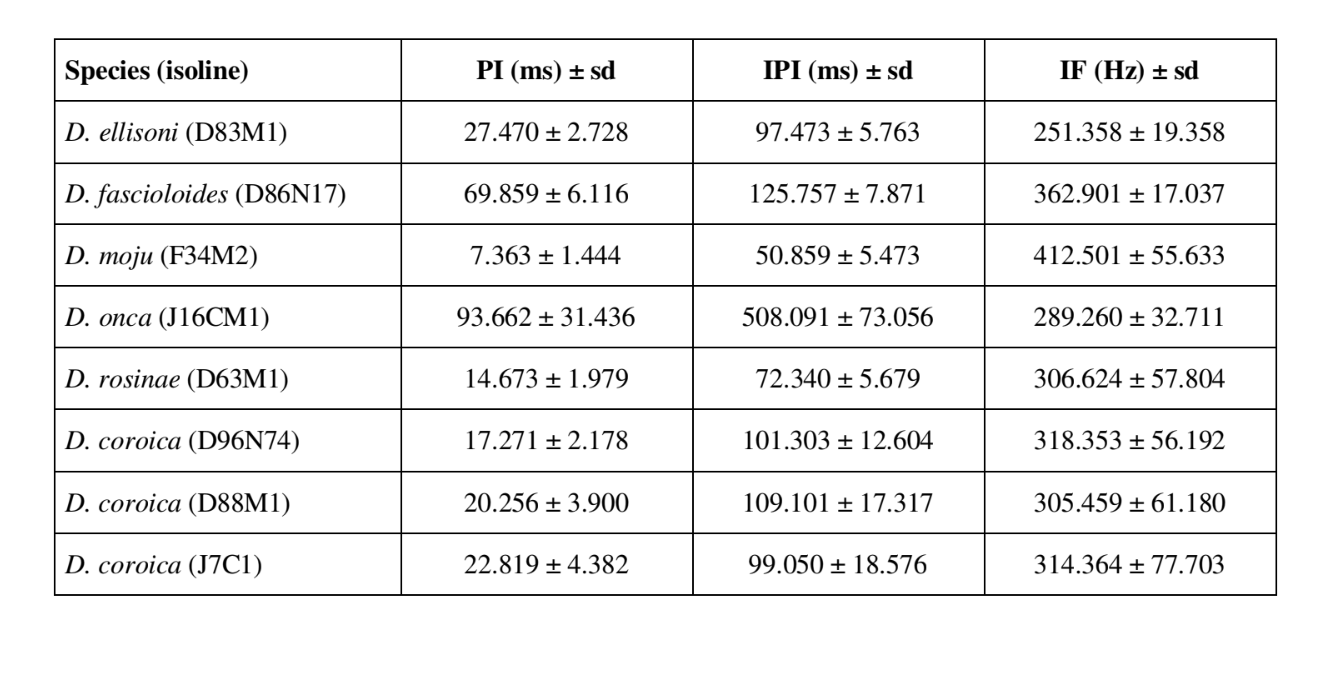
Houve relativamente pouca variação intrapopulacional nos PIs das linhas D. coroica D96N74, D88M1 e J7C1 (17.271 ± 2.18, 20.256 ± 3.90 e 22.819 ± 4.38, respectivamente), variabilidade intermediária em IPI (101.303 ± 12.60, 109.101 ± 17.32 e 99.050 ± 18.58), e alta variabilidade em IF (318.353 ± 56.19, 305.459 ± 61.18 e 314.364 ± 77.70), indicando que mesmo com baixa variação intrapopulacional no comprimento do pulso sonoro, houve considerável variação na forma de onda do pulso sonoro.
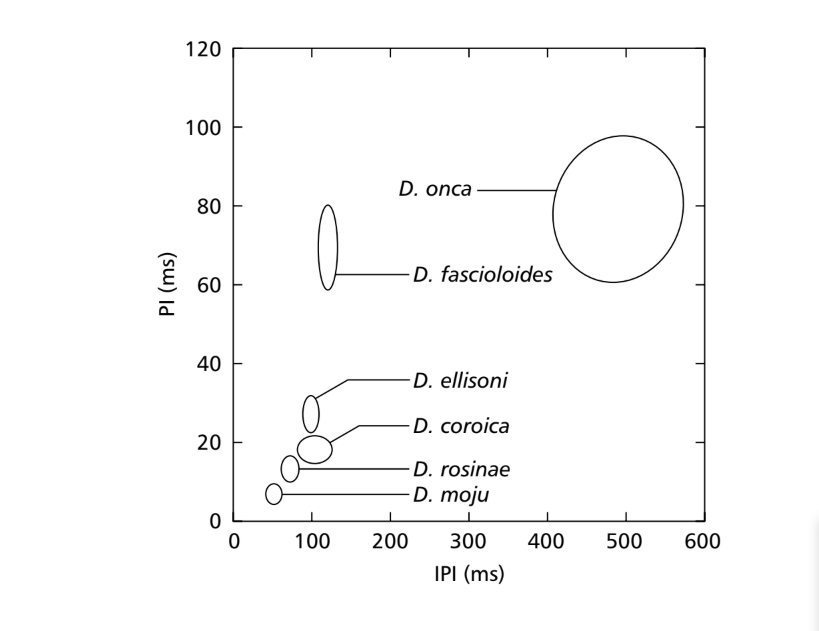
Quando os valores médios para os parâmetros PI e IPI foram comparados, diferenças entre as espécies do subgrupo fasciola puderam ser encontradas para pelo menos um desses parâmetros. Essas diferenças nos sons de cortejo podem ser vistas na Fig. 7, na qual os valores para esses dois parâmetros estão representados na forma de elipses, que incluem 75% dos valores para os parâmetros PI e IPI. Diferenças significativas foram encontradas nos valores de PI (ANOVA, F5,48 = 124.98, p < 0.001) e IPI (ANOVA, F5,48 = 949.35, p < 0.001) entre as espécies. As diferenças interespecíficas em IF são mostradas na Fig. 8. Diferenças significativas também foram encontradas nos valores de IF (ANOVA, F5,48 = 23.40, p < 0.001).
As três populações de D. coroica diferiram significativamente no PI (ANOVA, F2,24 = 8.75, p < 0.05), mas não no IPI (ANOVA, F2,24 = 1.72, p > 0.10) e IF (ANOVA, F2,24 = 0.15, p > 0.25).
Discussão
Hoikkala et al. (1994) em sua análise do som de cortejo de várias espécies do subgrupo planitibia, descobriram que é comum encontrar os mesmos tipos de sons em espécies filogeneticamente próximas. Além disso, Hoikkala & Kaneshiro (1993) observaram que algumas espécies estreitamente relacionadas neste subgrupo, que são simpátricas, usam diferentes tipos de sons no cortejo.
Noor & Aquadro (1998) encontraram diferenças significativas nos sons de cortejo em duas espécies estreitamente relacionadas do subgrupo obscura: D. pseudoobscura e D. persimilis. Alguns experimentos envolvendo cruzamentos entre essas duas espécies indicaram que fêmeas de D. pseudoobscura provavelmente aumentaram sua discriminação contra machos de D. persimilis em populações simpátricas. Isso poderia ter ocorrido através da seleção contra a produção de híbridos mal adaptados, resultando em uma alteração do som de cortejo nessas populações simpátricas.
Ewing & Miyan (1986), trabalhando com espécies do grupo repleta , não encontraram relação entre uma filogenia baseada em dados citológicos e outra feita a partir de dados sonoros. No entanto, algumas das características que a maioria das espécies estudadas têm em comum e que também são encontradas em espécies de outros grupos nos permitem propor um som ancestral de cortejo para o grupo repleta . Esse som teria sido composto por dois componentes distintos: o som inicial A, consistindo de no máximo 10 pulsos monocíclicos curtos e regulares, com um intervalo interpulso de 8 a 15 ms; e o som B, composto por uma série de pulsos regulares e monocíclicos, mas com um número maior de pulsos e um intervalo interpulso mais longo no final do cortejo. Durante a evolução do grupo repleta , algumas espécies teriam perdido o som A, e outras, o som B, e, em muitas, o som B teria se tornado menos regular e mais complexo.
Com base nessas suposições e observando os sonogramas obtidos para as seis espécies do subgrupo fasciola neste estudo, podemos inferir que em todas essas espécies houve uma perda do som A, uma vez que os intervalos interpulso são sempre muito maiores que 15 ms. D. coroica tem pulsos irregulares, com um intervalo interpulso médio de 101,3 ms, enquanto os sons de cortejo de D. moju são compostos por pulsos mais regulares, com um intervalo interpulso médio de
50,9 ms. D. rosinae tem um sonograma composto por pulsos duplicados, um tipo de som também encontrado por Ewing & Miyan (1986), com um intervalo médio entre pulsos de 72,3 ms. D. ellisoni, D. fascioloides e D. onca têm sons de cortejo compostos por pulsos policíclicos, provavelmente resultado da fusão dos sons A e B, com intervalos médios entre pulsos de 97,4, 125,7 e 508,0 ms, respectivamente. Essas semelhanças nos tipos de sons nessas três espécies não estão intimamente correlacionadas aos dados citológicos, exceto para D. ellisoni e D. fascioloides, que foram colocadas próximas uma da outra em uma filogenia baseada em caracteres citológicos, tendo em comum duas fusões cromossômicas: 2-4F e 3-5F (Diniz, 1998). Assim como ocorre com os caracteres morfológicos, espera-se uma tendência de espécies estreitamente relacionadas compartilharem alguns parâmetros sonoros. No entanto, mesmo quando as relações filogenéticas entre as espécies são conhecidas, as tendências evolutivas baseadas em caracteres sonoros não foram bem estabelecidas.
Embora o som de cortejo não seja um exemplo de comportamento circadiano, pesquisas relacionaram esse comportamento à expressão do gene period (per) localizado no cromossomo X e bem caracterizado em nível molecular. Mut ações nesse gene podem alterar o ritmo circadiano de Drosophila. Uma análise genética feita por Konopka et al. (1996) mostrou que o ritmo sonoro do intervalo interpulso também é afetado por mutações no gene per. Kyriacou & Hall (1980) relataram uma modulação rítmica do intervalo interpulso com períodos específicos em D. melanogaster e D. simulans de 55 e 35 segundos, respectivamente. Essas diferenças foram mostradas como relacionadas a algumas variações no gene per. Mutações nesse gene, que foram inicialmente estudadas por Konopka & Benzer (1971) em uma análise de ritmos circadianos anormais, provocaram efeitos correspondentes nos ritmos dos intervalos interpulso dos sons de cortejo. A mutação perShort (perS), com um ritmo circadiano de cerca de 19-20 horas, teve um período médio de 41,5 segundos; a mutação perLong (perL) cujo ritmo circadiano de 28-30 horas teve um período médio de 82,1 segundos; e a mutação per0 não teve ritmo de intervalo interpulso.
Nesta pesquisa, encontramos diferenças significativas nos parâmetros intervalo intrapulso, intervalo interpulso e frequência intrapulso nas espécies de fasciola analisadas. Entre esses parâmetros, o intervalo interpulso foi o que mais se diferenciou, com pouca sobreposição e pouca variação intraespecífica, sugerindo que esse parâmetro poderia fazer parte de um sistema de reconhecimento de espécies. Este alto nível de diferenciação nos sons masculinos é consistente com o consenso geral de que o comportamento de cortejo pode diferir mais do que caracteres morfológicos ou outras características em espécies relacionadas. No entanto, é impossível, no momento, saber a direção da evolução desses diferentes tipos de sons no subgrupo fasciola. Estudos genéticos mostraram que as diferenças interespecíficas nos intervalos interpulso são frequentemente devidas a fatores aditivos e poligênicos. Essas diferenças também podem ser explicadas pela adaptação a diferentes ambientes na ausência de fluxo gênico. Sabe-se que houve ciclos alternados entre frio-seco e quente-húmido no período Quaternário. Em um ciclo climático frio-seco, a vegetação adaptada às condições secas se expandiu, enquanto a floresta se retraiu. Durante o ciclo quente-húmido subsequente, a situação se inverteu (Ab’ Saber, 1977; Vanzolini, 1981). Acredita-se que as moscas seguiram esses processos de redução e expansão da floresta, o que resultaria em longos períodos de isolamento geográfico durante os ciclos frio-seco e algumas áreas de simpatria durante os ciclos quente-húmido.
Embora o intervalo interpulso possa variar amplamente entre diferentes espécies do gênero Drosophila, geralmente isso não é observado quando populações da mesma espécie são analisadas (Costa et al., 2000; Ritchie et al., 1994). As três populações analisadas de D. coroica apresentaram diferenças significativas apenas no intervalo intrapulso, sem diferenças no intervalo interpulso e na frequência intrapulso. É possível que uma forte pressão de seleção esteja agindo sobre o intervalo interpulso e a frequência intrapulso. Essa baixa variabilidade também poderia ocorrer se populações geograficamente distintas fossem geneticamente homogêneas devido ao fluxo gênico constante, ou se um ancestral comum tivesse colonizado recentemente essas populações. No entanto, os dados do PI mostram que esse não é o caso.
Pouco se sabe sobre os mecanismos genéticos envolvidos nos processos de especiação, no entanto, é primeiro necessário entender a genética e a evolução dos mecanismos que impedem o fluxo gênico. Híbridos estéreis e instáveis são considerados barreiras fortes ao fluxo gênico, mas esses tipos de mecanismos pós-zigóticos podem resultar em altos custos na forma de gametas e energia. Portanto, diferenças nos sons de cortejo podem ser um importante mecanismo isolante, pois limitariam ou preveniriam tais perdas (Welbergen et al., 1992). A análise desses sinais, que são importantes para o sucesso da reprodução, é de considerável interesse para a biologia evolutiva e o conhecimento da arquitetura dos sons poderia ajudar a provar vários modelos de seleção sexual e especiação.
Autores: Costa, C. T. A. e Sene, F. M.
Referências:
- Ab’ Saber, A. N., 1977, Espaços ocupados pela expansão dos climas secos da América do Sul, por ocasião dos períodos glaciais quaternários. Paleoclimas, 3: 1-19.
- Chang, H. C. & Miller, D. D., 1978, Sons de corte e acasalamento em espécies do subgrupo Drosophila affinis . Evolution, 32: 540-550.
- Costa, C. T. A., Kuhn, G. C. S. & Sene, F. M., 2000, Baixa variação do canto de cortejo em populações do Brasil Sul e Sudeste de D. meridionalis (Diptera, Drosophilidae). Rev. Brasil. Biol., 60: 53-61.
- Cowling, D. E. & Burnet, B., 1981, Canções de cortejo e controle genético das características acústicas em espécies irmãs do subgrupo Drosophila melanogaster . Anim. Behav., 29: 924-935.
- Diniz, N. M., 1998, Filogenia cromossômica de espécies do subgrupo fasciola do grupo repleta gênero Drosophila. Tese de Doutorado, Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo.
- Ewing, A. W. & Miyan, J. A., 1986, Seleção sexual, isolamento sexual e a evolução do canto em espécies do grupo Drosophila repleta . Anim. Behav., 34: 421-429.
- Hoikkala, A. & Lumme, H., 1987, A base genética da evolução dos sons de cortejo masculinos do grupo Drosophila virilis . Evolution, 41: 827-845.
- Hoikkala, A. & Kaneshiro, K. Y., 1993, Mudança na sequência de sinal-resposta responsável pelo isolamento assimétrico entre Drosophila planitibia e D. silvestris. Proc. Natn,. Acad. Sci., 90: 5813-5817.
- Hoikkala, A. & Isoherranen, E., 1997, Variação e repetibilidade dos caracteres do canto de cortejo entre machos de Drosophila montana e D. littoralis capturados na natureza e criados em laboratório (Diptera-Drosophilidae). Jornal of Insect Behavior, 10: 193-202.
- Hoikkala, A., Lakovaara, S. & Romppainen, E., 1982, Comportamento de acasalamento e sons de cortejo masculinos no grupo Drosophila virilis . In: Lakovaara, S. (ed.), Avanços em genética, desenvolvimento e evolução de Drosophila. Plenum, Nova Iorque.
- Hoikkala, A., Kenneth, Y. & Hoy, R. H., 1994, Canções de cortejo das espécies do subgrupo de Drosophila planitibia com asas em forma de imagem. Anim. Behav., 47: 1363-1374.
- Ikeda, H. & Maruo, O., 1982, Seleção direcional para a taxa de repetição de pulso do som de cortejo e respostas correlacionadas ocorrendo em vários caracteres em Drosophila mercatorum. Jnp. J. Genet., 57: 241-258.
- Konopka, R. J. & Benzer, S., 1971, Mutantes de relógio de Drosophila melanogaster. Proc. Natl. Acad. Sci., 68: 2112-2116.
- Konopka, R. J., Kyriacou, C. P. & Hall, J. C., 1996, Análise mosaica no Drosophila CNS de ritmos de canto de cortejo circadianos afetados por uma mutação de relógio de período. J. Neurogenet., 11: 117-140.
- Kuhn, G. C. S., Diniz, N. M., Alves, M. A. R. & Sene, F. M., 1995, Constituição cariotípica de espécies do subgrupo fasciola do grupo repleta gênero Drosophila. Rev. Bras. Gen., 18 suplemento: 282.
- Kyriacou, C. P. & Hall, J. C., 1980, Mutantes de ritmo circadiano em Drosophila melanogaster afetam flutuações de curto prazo na canção de cortejo do macho. Proc. Natl. Acad. Sci., 77: 6729-6733.
- Manfrin, M. H., Prado, P. R. R. & SENE, F. M., 1997, Análise dos componentes sonoros do cortejo sexual de duas subespécies de Drosophila mercatorum (Diptera, Drosophilidae). Rev. Brasil. Biol., 57: 349-355.
- Neems, R. M., Dooher, K., Butlin, R. K. & Shorrocks, B., 1997, Diferenças na canção de cortejo masculino entre as espécies do grupo quinaria de Drosophila. Journal of Insect Behavior, 10: 237-246.
- Noor, M. A. & Aquadro, C. F., 1998, Canções de cortejo de Drosophila pseudoobscura e D. persimilis: análise de variação. Anim. Behav., 56: 115-125.
- Ritchie, M. G. & Gleason, J. M., 1995, Evolução rápida do padrão de canção de cortejo em espécies de Drosophila willistoni . J. Evol. Biol., 8: 463-479.
- Ritchie, M. G. & Kyriacou, C. P., 1996, Seleção artificial para um sinal de cortejo em Drosophila melanogaster. Anim. Behav., 52: 603-611.
- Ritchie, M. G., Yate, V. H. & Kyriacou, C. P., 1994, Variabilidade genética do intervalo interpulso da canção de cortejo entre algumas populações europeias de Drosophila melanogaster. Heredity, 72: 459-464.
- Schilcher, F. V., 1976, O papel dos estímulos auditivos no cortejo de Drosophila melanogaster. Anim. Behav., 24: 18-26.
- Sene, F. M. & Manfrin, M. H., 1998, Uma câmara para gravar o canto de cortejo em Drosophila. D. I. S., 81: 203-204.
- Shorey, H. H., 1962, A natureza do som produzido por Drosophila melanogaster d durante o cortejo. Science, 137: 677-678.
- Tidon-Sklorz, R. & Sene, F. M., 1992, Distribuição vertical e temporal de espécies de Drosophila (Diptera, Drosophilidae) em uma área florestal no estado de São Paulo, Brasil. Rev. Brasil. Biol., 52: 311-317.
- Tomaru, M. & Oguma, Y., 1994, Diferenças na canção de cortejo nas espécies do complexo Drosophila auraria . Anim. Behav., 47: 133-140.
- Vanzolini, P. E., 1981, Uma abordagem quase-histórica à história natural da diferenciação de répteis em isolados geográficos tropicais. Papeis Avulsos Zool., 34: 189.
- Vilela, C. R., 1983, Uma revisão do grupo de espécies Drosophila repleta (Diptera, Drosophilidae). Revta. Bras. Ent., 27: 1-114.
- Vilela, C. R., Pereira, M. A. Q. R. & Sene, F. M., 1983, Dados preliminares sobre a distribuição geográfica de espécies de Drosophila dentro de domínios morfoclimáticos do Brasil. II. O grupo repleta. Cienc. Cult., 35: 66-70.
- Wasserman, M., 1962, Estudos citológicos do grupo repleta do gênero Drosophila. VI. O subgrupo fasciola . Univ. Texas Public., 6205: 119-134.
- Wasserman, M., 1982, Evolução do grupo repleta. In: M. Ashburner, H. L. Carson & J. N. Thompson (eds.), A genética e biologia de Drosophila, vol. 3b. Academic Press, London, pp. 61-139.
- Wasserman, M., 1992, Evolução citológica do grupo de espécies Drosophila repleta : VI. O subgrupo fasciola . In: Estudos em Genética II. Relatórios de Pesquisa sobre genética de Drosophila, taxonomia e evolução. CRC Press, Inc., M. R. da Universidade do Texas, Austin.
- Welbergen, P., Van Duken, F. R., Scharloo, W. & Köhler, W., 1992, A base genética do isolamento sexual entre Drosophila melanogaster e D. simulans. Evolution, 46: 1385-1398.
- Wheeler, D. A., Fields, W. L. & Hall, J. C., 1988, Análise espectral das canções de cortejo de Drosophila : D. melanogaster, D. simulans, e seu híbrido interespecífico. Behav. Genet., 18: 675-703.
