Morfologia do Aedeago como marcador discriminante em duas espécies de Drosophila (Diptera; Drosophilidae) intimamente relacionadas, cactofílicas, na América do Sul
Tradução automática
O artigo original está escrito em EN language (link para lê-lo) .
Resumo
Drosophila serido e D. antonietae são espécies irmãs pertencentes ao grupo Drosophila buzzatii. Morfologicamente, elas só podem ser discriminadas por características quantitativas. Neste artigo, analisamos o comprimento e a curvatura média equalizada de quatro regiões do aedeago de D. antonietae e D. serido. Exemplares de D. serido e D. antonietae foram classificados corretamente 96,74% das vezes. Baseando-se apenas na variável que mais contribuiu para a discriminação dos grupos (curvatura média equalizada do arco IV do aedeago), observamos uma divergência morfológica intraespecífica significativa em D. serido em relação a D. antonietae, em concordância com outros marcadores. A alta divergência morfológica na curvatura média equalizada do arco IV do aedeago mostra que esta região evoluiu mais rapidamente do que outras, desde a divergência das duas espécies. A importância do presente estudo para a compreensão da base genética que controla a formação do aedeago, nas espécies do grupo Drosophila buzzatii, é discutida.
Introdução
Os caracteres morfológicos têm sido utilizados historicamente em estudos evolutivos e taxonômicos. No entanto, a falta de diferenças morfológicas qualitativas entre espécies irmãs torna difícil estabelecer as características morfológicas diagnósticas entre elas. Em muitos casos, variações quantitativas de traços morfométricos são suficientes para a discriminação de espécies irmãs (Moreteau et al. 2003, Moraes et al. 2004).
A morfologia do aedeago (genitália masculina externa) é de extrema importância na caracterização taxonômica das espécies de Drosophila (Vilela 1983, Silva e Sene 1991, Liu et al. 1996, Moreteau et al. 2003, Kullikov et al. 2004), assim como em outros Diptera. Variações quantitativas nas características morfológicas do aedeago também têm sido utilizadas para a discriminação das espécies irmãs de Drosophila (Silva e Sene 1991, Kullikov et al. 2004). No grupo Drosophila repleta , que inclui mais de 90 espécies neotropicais, a maioria é considerada espécies irmãs. No entanto, existe uma diferença marcante na forma dos aedeagos (forma + tamanho) entre elas, que é considerada a principal característica diagnóstica do grupo (Vilela 1983).
O Drosophila buzzatii cluster (repleta group, mulleri subgroup, buzzatii complex) é um grupo monofilético formado por sete espécies irmãs cactofílicas: D. buzzatii, D. borborema, D. koepferae, D. antonietae, D. gouveai, D. serido e D. seriema. Neste cluster, diferenças quantitativas das características morfológicas da asa (Moraes et al. 2004) e dos genitais masculinos (Silva e Sene 1991, Tidon-Sklorz e Sene 1995, Prado et al. 2004) foram utilizadas com sucesso para a discriminação de espécies e populações. Entre as sete espécies deste cluster, D. buzzatii e D. borborema apresentam aedeagos que são diferentes em forma e tamanho das outras espécies (Tidon-Sklorz e Sene 1995). No entanto, a morfologia do aedeagus das outras espécies do cluster é semelhante ao chamado tipo de aedeagus D. serido (Figura 1a) e com base nesta observação, essas espécies foram inicialmente classificadas como pertencentes à mesma espécie (Vilela e Sene 1977). Para estudar o aedeagus dessas espécies, Silva e Sene (1991) o dividiram em quatro regiões principais delimitadas por marcos (Figura 1b). Cada região delimitada por dois marcos adjacentes foi denominada arco. Com base no comprimento dos arcos, os pesquisadores identificaram cinco tipos diferentes de aedeagus, nomeados de A a E, específicos para cada espécie.
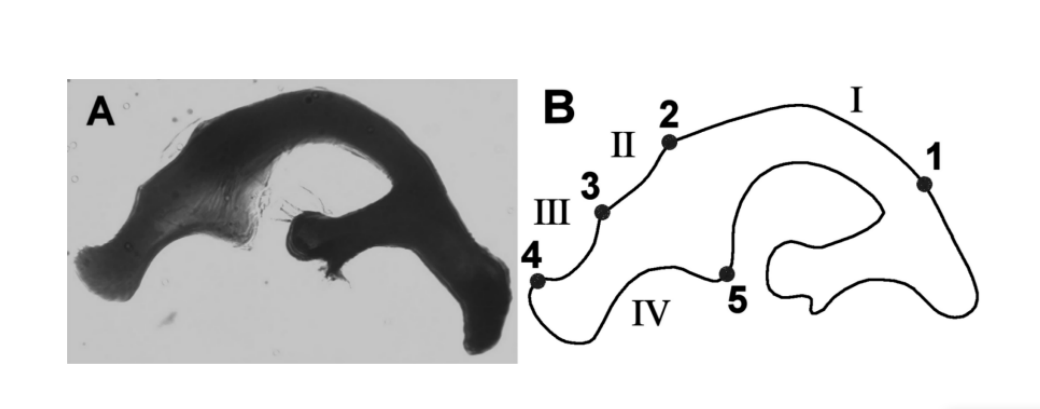
Drosophila serido e D. antonietae são duas espécies irmãs pertencentes ao grupo Drosophila buzzatii analisado neste estudo. D. antonietae ocorre em florestas mesofílicas nas regiões da bacia do Paraná-Paraguai, na América do Sul, associada ao cacto Cereus hildemannianus (Tidon-Sklorz e Sene 2001). D. serido está presente na Caatinga do Nordeste e na Costa Atlântica do Brasil, do Nordeste até a região Sul do Brasil, associada a uma série de gêneros de cactos (Pereira et al. 1983). No limite sul da distribuição de D. serido, há uma área de contato com D. antonietae (A.C. Morales et al., dados não publicados). Embora D. serido e D. antonietae apresentem placas metafásicas distintas (Baimai et al. 1983), padrões aloenzimáticos (A.C. Morales et al., dados não publicados, Mateus e Sene 2003), haplótipo mitocondrial (Manfrin et al. 2001) e DNA satélite (Kuhn e Sene 2005), elas compartilham a mesma inversão cromossômica fixa 2x7 (Ruiz et al. 2000), o que pode indicar uma relação filogenética próxima. Em termos morfológicos, apenas variações quantitativas podem discriminar essas duas espécies (Silva e Sene 1991, Moraes et al. 2004).
Neste artigo, foram analisados os caracteres morfométricos do aedeago de espécimes de D. antonietae de várias populações diferentes, cobrindo toda a distribuição conhecida da espécie, e de espécimes de D. serido provenientes de duas populações diferentes. Escolhemos essas espécies porque podem ser diferenciadas por meio de marcadores genéticos e, ao apresentar uma área de contato secundário, com uma população em simpatria, com possível formação de híbridos na região sul do Brasil. Além das medidas do comprimento do arco do aedeago, já utilizadas em Silva e Sene (1991), também foram utilizadas medidas de curvatura desses arcos (Prado et al. 2004). Nossos principais objetivos foram introduzir e testar o uso das medidas de curvatura nas espécies do grupo Drosophila buzzatii e determinar as regiões do aedeago que mais contribuíram para a discriminação das espécies D. serido e D. antonietae. Os dados discutidos aqui destacam a importância dessas regiões do aedeago para futuras pesquisas a fim de entender a base genética do aedeago das espécies pertencentes ao grupo Drosophila buzzatii, bem como para estudos da área de contato entre as duas espécies.
Materiais e métodos
Amostras
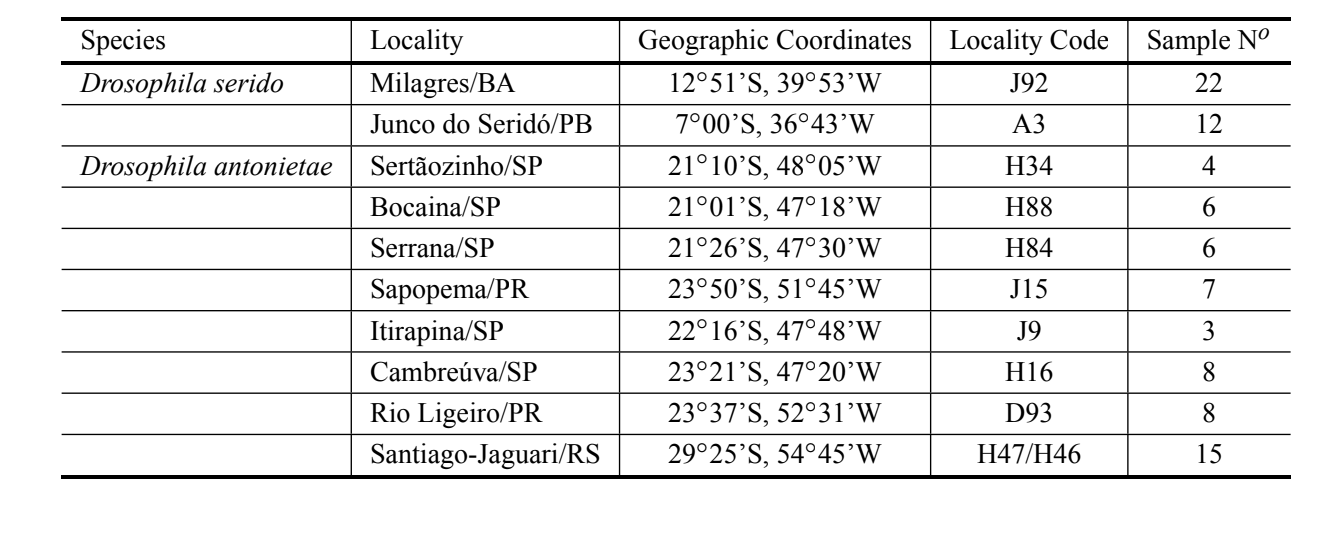
Cinquenta e oito aedeagi foram analisados da espécie D. antonietae de várias populações diferentes, representando toda a distribuição, e 34 aedeagi de D. serido, pertencentes a populações localizadas em Junco do Seridó/PB e Milagres/BA (localização tipo) (Tabela I). Todos os indivíduos analisados foram coletados em ambientes naturais (moscas capturadas na natureza). Os aedeagi foram preparados em fatias para microscopia óptica de acordo com Kaneshiro (1969). Todos os aedeagi utilizados neste artigo foram depositados no Laboratório de Genética Evolutiva da USP – Ribeirão Preto. As imagens dos aedeagi foram ampliadas 200X e digitalizadas a partir de um microscópio (Axioplan2 Zeiss) equipado com o sistema de captura de imagem digital Axiovision Zeiss e armazenadas em um computador.
Medida e Análise Estatística
Cinco pontos foram definidos manualmente como marcos, de acordo com Silva e Sene (1991). Os marcos foram usados para estabelecer os contornos internos da região em estudo; as regiões entre dois marcos adjacentes são os arcos (Figura 1b).
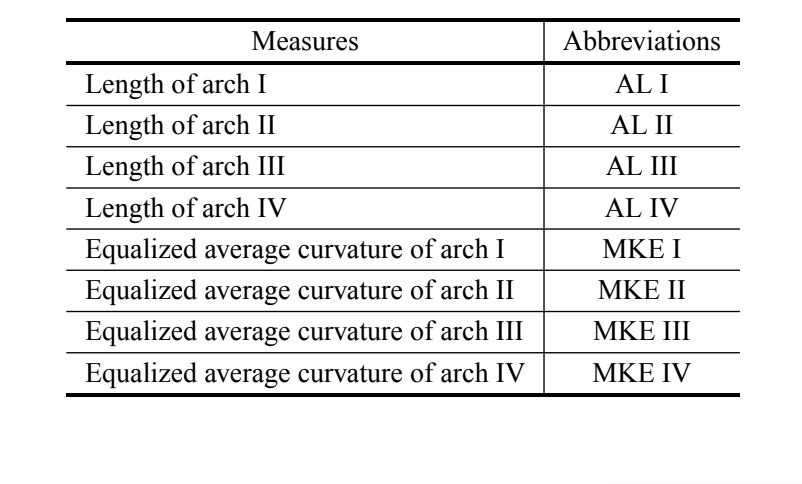
Assim como em Silva e Sene (1991), o comprimento dos arcos I, II, III e IV do aedeago foi medido (Tabela II). Isso mede a distância acumulada entre os marcos consecutivos. Além disso, também realizamos medidas igualadas de curvatura dos arcos. Em resumo, a curvatura contínua é uma medida geométrica que expressa a taxa de mudança do ângulo entre a tangente da curva e o eixo x (Costa et al. 2004). Os valores da curvatura igualada são gerados através da padronização por uma sigmoide da curvatura contínua para amplificar os pontos de baixa curvatura da região de interesse (Costa e Cesar 2000). Esta etapa permite a maximização das informações sobre a curvatura da estrutura analisada. Para realizar as análises, utilizamos as médias das curvaturas igualadas dos arcos I, II, III e IV do aedeago (Tabela II). As medidas foram obtidas de acordo com a metodologia descrita por Prado et al. (2004).
Realizamos três análises discriminantes distintas, utilizando apenas as medidas de comprimento do arco (discriminante I) e a curvatura média igualada (discriminante II) e uma análise discriminante utilizando todas as medidas juntas (discriminante III). Essas análises foram realizadas para obter percentuais corretos de classificação dos indivíduos, para verificar quais variáveis contribuíram mais para a discriminação dos grupos e para comparar o uso das medidas de curvatura utilizadas com as medidas do comprimento do arco, previamente realizadas por Silva e Sene (1991). Os valores mais baixos do lambda de Wilk (que variam de 0 a 1) indicam uma melhor análise. Além disso, com os dados da análise discriminante III, foi realizada uma análise de variáveis canônicas. A análise das variáveis discriminantes e canônicas foi realizada com o uso do software Splus (versão 1.8).
O valor absoluto dos coeficientes padronizados canônicos, gerados pela análise de variáveis canônicas, representa o peso de cada variável na formação da raiz canônica, onde valores mais altos correspondem a uma maior diferenciação entre os grupos. Esses coeficientes serão apresentados para mostrar a contribuição relativa de cada variável na formação da raiz canônica obtida e para determinar qual variável é mais importante para a discriminação dos grupos.
Além da análise multivariada, a medida mais importante para a discriminação das espécies foi utilizada individualmente a fim de obter a porcentagem correta de classificação dos indivíduos através do método de classificação bayesiana (Duda et al. 2000). Para isso, curvas normais foram estabelecidas a partir da média e do desvio padrão de cada grupo em relação à variável, definindo a densidade da função e a probabilidade utilizadas na análise bayesiana.
Resultados
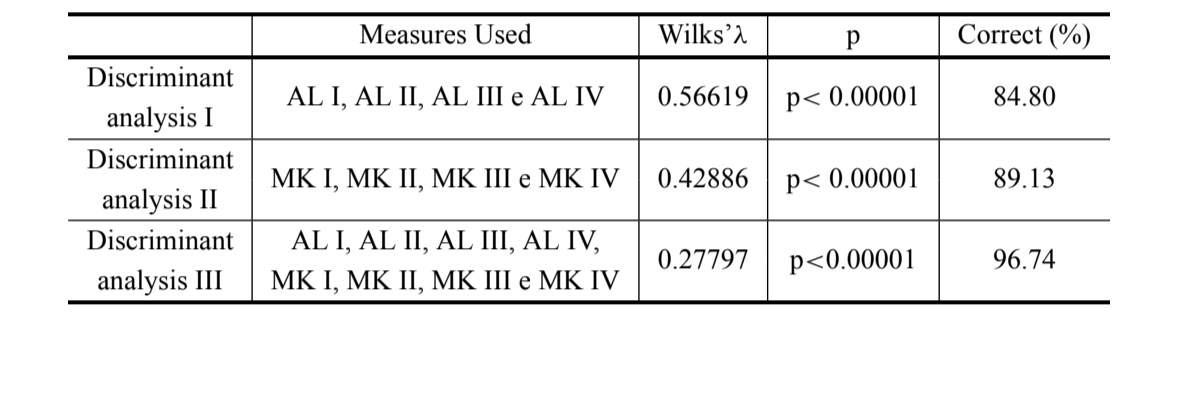
Os resultados das três análises discriminantes realizadas estão mostrados na Tabela III. A discriminação entre D. antonietae e D. serido é maior quando os comprimentos do arco do aedeago são utilizados juntamente com as medidas de curvatura (discriminante III) (λ de Wilks = 0.27797; p<0.00001), onde 96.74% dos indivíduos são classificados corretamente (Tabela III), a classificação correta de D. antonietae é 98.30% e de D. serido é 94.10%.
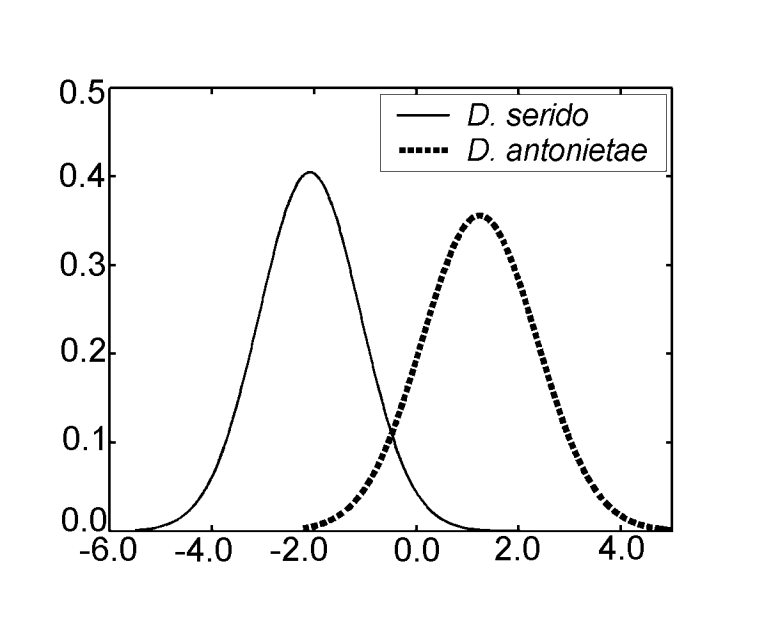
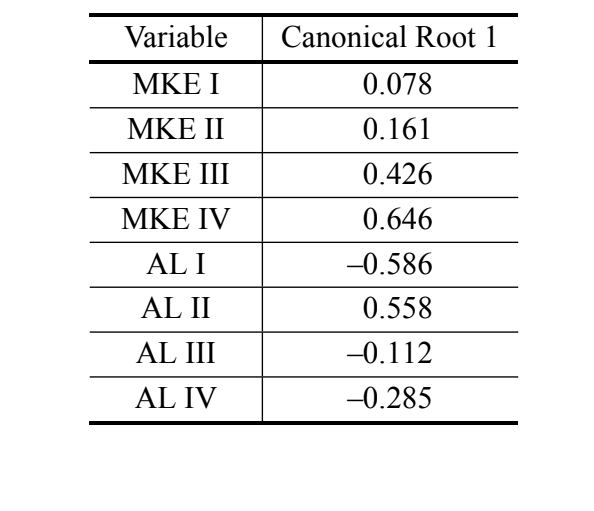
Foi obtido apenas um eixo canônico na análise das variáveis canônicas usando as medidas da análise discriminante III. Os coeficientes canônicos padronizados (o peso de cada variável) estão mostrados na Tabela IV. Os valores absolutos desses coeficientes indicam que a variável mais importante para a formação da raiz canônica foi MKE IV, enquanto a menos importante foi a variável MKE I. As curvas normais obtidas pela média e desvio padrão dos dois grupos em relação aos escores canônicos estão mostradas na Figura 2, na qual podemos observar a discriminação entre D. antonietae (escores canônicos mais altos) e D. serido (escores canônicos mais baixos).
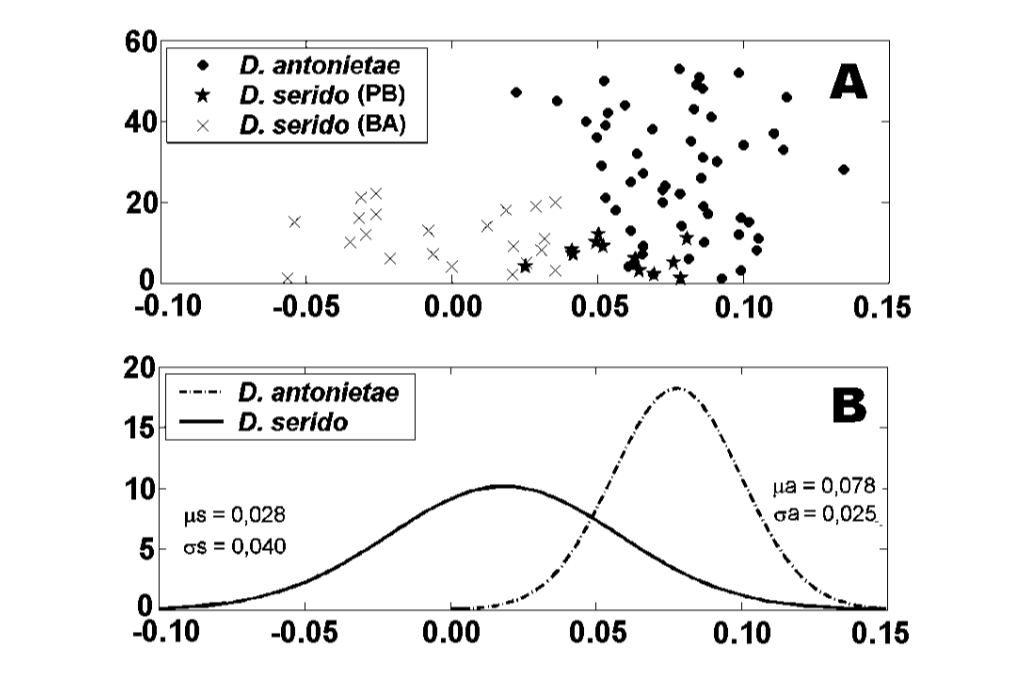
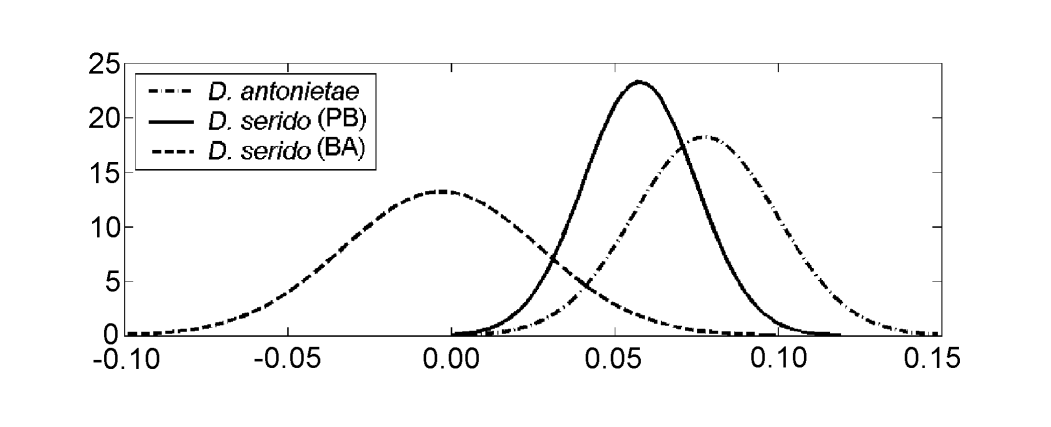
Os valores para cada indivíduo obtidos a partir da análise de MKE IV estão mostrados na Figura 3a. Em relação a essa medida, D. serido apresenta maior variação em torno da média (desvio padrão = 0.04) do que D. antonietae (desvio padrão = 0.025) (Figura 3b), principalmente porque existem diferenças significativas em relação a essa medida entre ambas as populações que compõem a amostra de D. serido (Figura 3a; Figura 4).
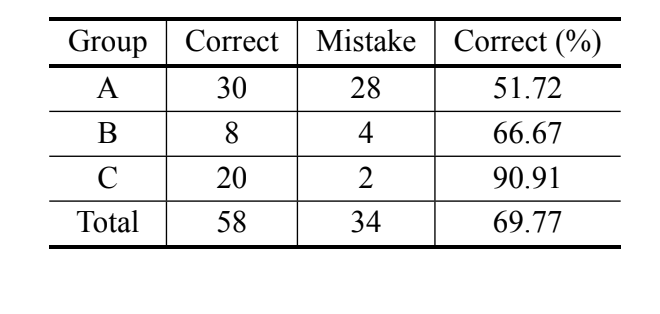
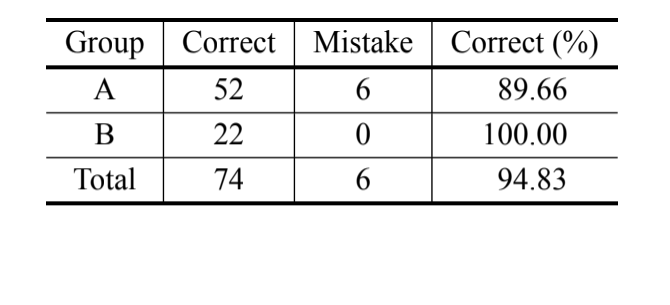
De acordo com a análise bayesiana, baseada apenas na medida MKE IV, 69,8% dos indivíduos foram classificados corretamente e mais de 90% dos indivíduos de D. serido de Milagres/BA foram classificados corretamente. No entanto, uma alta porcentagem de erros foi observada nos indivíduos de D. serido de Junco do Seridó/PB e
D. antonietae (Tabela V). A mesma análise foi realizada sem os indivíduos de D. serido de Junco do Seridó/PB e a porcentagem de classificações corretas foi de 94,83% (Tabela VI), mostrando uma divergência extrema entre os indivíduos da população de D. serido de Milagres/BA e D. antonietae com base no MKE IV.
Discussão
Nossos dados confirmam a existência de diferenças quantitativas nas características morfológicas do aedeagus dos indivíduos analisados, possibilitando a discriminação do D. serido do D. antonietae. Além disso, a curvatura média igualada do arco IV (MKE IV) foi a variável que mais contribuiu para a discriminação dos grupos (Tabela IV).
O comprimento dos primeiros quatro arcos do aedeago já havia sido utilizado com sucesso na discriminação de espécies do grupo Drosophila buzzatii, incluindo entre elas D. serido e D. antonietae (aedeago Tipo A e D, respectivamente em Silva e Sene 1991). Neste artigo, encontramos um aumento considerável na discriminação dos grupos ao adicionar medidas de curvatura média igualada na análise morfométrica, onde 96,74% dos indivíduos são corretamente classificados (Tabela III). Assim, as medições de curvatura média igualada são importantes para a discriminação de D. antonietae e D. serido e podem ser úteis no estudo de uma zona de simpatria entre essas espécies na região sul do Brasil. Como as medidas de curvatura não levam em consideração o tamanho da estrutura, é possível inferir que pequenas alterações quantitativas na forma do aedeago, especialmente na região do arco IV, podem ter ocorrido desde o evento de cladogênese das espécies D. serido e D. antonietae.
Há uma divergência morfológica significativa em relação ao MKE IV entre D. antonietae e D. serido, uma vez que D. antonietae apresenta relativamente menos variação em torno da média do que D. serido (Figura 3b). Indivíduos de diferentes populações, representando toda a área de distribuição das populações de D. antonietae (Tabela I), foram analisados; nesta amostra, os dados sugerem que há homogeneidade entre as populações de D. antonietae . Monteiro e Sene (1995) analisaram a morfologia do aedeagus de indivíduos de várias populações de
D. antonietae por meio do método morfométrico da rede truss e também não observaram as diferenças morfológicas entre elas. Padrões aloenzimáticos (Mateus e Sene 2003) e de microssatélites (L.P.B. Machado et al., dados não publicados) também mostraram homogeneidade entre as diferentes populações de D. antonietae. Esses resultados sugerem fluxo gênico entre as populações de D. antonietae, favorecido pela associação desta espécie e seu cacto hospedeiro, Cereus hildmaniannus que ocorre em florestas galeria mesofílicas ao longo dos rios da bacia do Paraná-Paraguai, que formam corredores de migração para indivíduos da espécie D. antonietae (Monteiro e Sene 1995).
Drosophila serido tem, comparativamente, uma maior variação interespecífica em relação ao MKE IV do que a D. antonietae (Figura 3b), como pode ser observado nas diferenças encontradas entre os indivíduos das populações de Junco do Seridó/PB e Milagres/BA. Os indivíduos de D. serido da população de Junco do Seridó/PB apresentam valores intermediários para MKE IV em relação aos encontrados para as populações de D. serido em Milagres/BA e as populações de D. antonietae analisadas (Figura 4). Esses dados sugerem uma diferenciação morfológica entre ambas as populações de D. serido, provavelmente devido à restrição do fluxo gênico entre elas. Há um grande rio entre os estados brasileiros da Bahia e Pernambuco, o rio São Francisco, que pode estar atuando como uma barreira geográfica, impedindo o fluxo gênico entre as populações de D. serido analisadas neste artigo. As divergências morfológicas entre as populações de D. serido estão de acordo com outros trabalhos, sendo que esta espécie é politépica em relação a outros marcadores. As populações do nordeste de D. serido possuem placas metafásicas do Tipo I, enquanto algumas populações costeiras têm placas metafásicas do Tipo III (Arraial do Cabo/RJ) e do Tipo IV (Peruíbe/SP) (Baimai et al. 1983). Em relação às inversões cromossômicas, embora todas as populações de D. serido compartilhem a inversão fixa 2x7, quatro inversões polimórficas estão restritas às populações do nordeste (2a8, 2b8, 2c8 e 2d8) e duas inversões fixas (2x8 e 2w8) ocorrem em populações costeiras (Tosi e Sene 1989, Ruiz et al. 2000). Além disso, as populações de D. serido do nordeste do Brasil estão parcialmente isoladas reprodutivamente da população de Arraial do Cabo/RJ ao longo da costa brasileira (N.M.V. Bizzo, dados não publicados). Estudos recentes também sugerem discriminação entre as populações de D. serido no Nordeste e na costa do Brasil com base na diferenciação de haplótipos mitocondriais (A.C. Morales et al., dados não publicados).
A diferenciação entre populações da mesma espécie é um requisito importante no processo de especiação, assim, estudos envolvendo uma variedade de populações de uma espécie politépica, como D. serido, são importantes para quantificar a divergência morfológica em relação à divergência genética em populações naturais.
Nem todos os arcos do aedeago são igualmente informativos na discriminação das espécies. De acordo com Silva e Sene (1991), os arcos II e III (Figura 1) são os mais informativos para a discriminação das espécies no grupo Drosophila buzzatii. Em comparação par-a-par, utilizando o método da rede de truss, as medidas relacionadas ao arco III foram as mais significativas na discriminação entre
D. antonietae e D. gouveai (Monteiro e Sene 1995). Através da análise da morfometria geométrica utilizando as medidas de curvatura, Prado et al. (2004) observaram que a curvatura e o comprimento normalizado do arco III são medidas importantes na discriminação entre as espécies D. gouveai e D. antonietae. Nossos dados mostram que o MKE IV é o mais importante na discriminação das espécies D. serido e D. antonietae; e com base apenas nesta medida, é possível discriminar mais de 94% dos indivíduos de D. serido da população de Milagres/BA (localização tipo) daqueles de D. antonietae (Tabela VI). Esses resultados mostram que a porção distal do aedeago (arco III + arco IV) apresenta as maiores diferenças interespecíficas, independentemente de outras partes deste órgão, sugerindo que esta região pode ser considerada um “ponto evolutivo quente” (Kullikov et al. 2004) para o aedeago durante eventos de cladogênese no grupo Drosophila buzzatii, mas essa questão ainda permanece em aberto para discussão.
As variações morfométricas entre e dentro dos grupos de organismos refletem a expressão de um fenótipo resultante de um controle poligênico integrado, que é alterado durante as cladogêneses e a evolução dos grupos (Falconer 1989). Além disso, vários fatores epigenéticos e ambientais podem afetar a formação de uma estrutura (Atchley et al. 1992), o que dificulta a identificação das causas da divergência morfológica entre populações e espécies. No entanto, estudos morfométricos comparativos das regiões homólogas de ambas as espécies, como os arcos do aedeago, são requisitos importantes para a compreensão da base genética que controla a formação dessa região. Embora a base genética do aedeago esteja sendo descoberta para outros grupos de Drosophila (Liu et al. 1996), os genes que controlam a formação do aedeago nas espécies do grupo Drosophila buzzatii ainda não estão estabelecidos. A alta porcentagem de correção dos indivíduos analisados neste artigo, baseada exclusivamente no MKE IV, indica que a região do arco quatro pode ser útil para estudos futuros na compreensão da base genética do aedeago nessas espécies, uma vez que estabelecer caracteres morfológicos informativos entre distintos grupos taxonômicos é um passo preliminar no estudo de QTL (Loci de Características Quantitativas), uma metodologia para a detecção, mapeamento e estimativa dos efeitos de alguns loci nas características métricas.
Autores: Fernando F. Franco, Pedro R.R. Prado, Fábio M. Sene, Luciano F. Costa e Maura H. Manfrin
Referências
- Atchley WR, Cowley DE, Vogi C e Mc-Lellan T. 1992. Divergência evolutiva, mudança de forma e estrutura de correlação genética na mandíbula de roedores. Syst Biol 41: 196–221.
- Baimai V, Sene FM e Pereira MAQR. 1983. Heterocromatina e diferenciação cariotípica de algumas espécies de cactáceas neotrópicas do grupo Drosophila repleta. Genetica 67: 81–92.
- Costa LF e Cesar RMJ. 2000. Análise de forma e classificação: teoria e prática. CRC Press Book Series on Image Processing. Cambridge Univ Press, Nova Iorque, 659 p.
- Costa LF, dos Reis SF, Arantes RAT, Alves ACR e Multinari G. 2004. Análise biológica de forma por curvatura digital. Pattern Recognit 37: 515–524.
- Duda RO, Hart PE e Stork DG. 2000. Classificação de Padrões. J Wiley & Sons, Nova Iorque, EUA, 680 p.
- Falconer DS. 1989. Introdução à genética quantitativa. 2ª ed., Londres: Longman.
- Kaneshiro KY. 1969. Um estudo das relações das espécies de Drosophila havaianas com base na genitália externa masculina. Univ Texas Publ 6918: 55–70.
- Kuhn GCS e Sene FM. 2005. Rotatividade evolutiva de duas subfamílias de DNA satélite pBuM no grupo de espécies Drosophila buzzatii (grupo repleta): de alpha para alpha/beta arrays. Gene 349: 77–85.
- Kullikov AM, Melnikov AI, Gornostaev NG, Lazebny OE e Mitrofanov VG. 2004. Análise morfológica do órgão de acasalamento masculino no grupo de espécies Drosophila virilis: uma abordagem multivariada. J Zool. Syst Evol Res 42: 135–144.
- Liu J, Mercer JM, Stam LF, Gibson GC, Zeng Zhao-Bang e Laurie CC. 1996. Análise genética de uma diferença morfológica na genitália masculina de Drosophila simulans e D. mauritiana. Genetics 142: 1129–1145.
- Manfrin MH, Brito ROA e Sene FM. 2001. Sistemática e evolução do grupo Drosophila buzzatii (Diptera; Drosophilidae) usando mtDNA. Ann Entomol Soc Am 94: 333–346.
- Mateus RP e Sene FM. 2003. Variação alozima temporal e espacial na Drosophila antonietae cactofílica da América do Sul (Diptera; Drosophilidae). Biochem Genet 41: 219–233.
- Monteiro SG e Sene FM. 1995. Estudo morfométrico de populações de Drosophila serido das regiões Central e Sul do Brasil. Rev Bras Genet 18 (Suppl.): 283.
- Moraes EM, Spressola VL, Prado PRR, Costa LF e Sene FM. 2004. Divergência na morfologia das asas entre espécies irmãs do grupo buzzatii. J Zool Syst Evol Res 42: 154–158.
- Moreteau B, Gibert P, Pétavy G, Moereteau JC, Huey RB e David JR. 2003. Evolução morfométrica em um clado de Drosophila: o grupo Drosophila obscure. J Zool Syst Evol Res 41: 64–71.
- Pereira MAQR, Vilela CR e Sene FM. 1983. Notas sobre locais de reprodução e alimentação de algumas espécies do grupo repleta do gênero Drosophila (Diptera; Drosophilidae). Cienc Cult 35: 1313–1319.
- Prado PRP, Franco FF, Manfrin MH, Costa LF e Sene FM. 2004. Uma maneira fácil e rápida de analisar caracteres morfométricos. Proc Third Braz Symp Mathem Comp Biol 1: 329–340.
- Ruiz A, Cassian AM, Kuhn GCS, Alves Maqr e Sene FM. 2000. O quebra-cabeça da especiação de Drosophila serido: juntando novas peças. Genetica 108: 217–227.
- Silva AFG e Sene FM. 1991. Variabilidade geográfica morfológica em Drosophila serido (Diptera; Drosophilidae). Rev Bras Entomol 35: 455–468.
- Tidon-Sklorz R e Sene FM. 1995. Evolução do grupo buzzatii (grupo de espécies Drosophila repleta) na América do Sul central. Evolución Biologica 9: 71–85.
- Tidon-Sklorz R e Sene FM. 2001. Duas novas espécies do conjunto de irmãos de Drosophila serido (Diptera; Drosophilidae). Iheringia 90: 141–146.
- Tosi D e Sene FM. 1989. Novos estudos sobre variabilidade cromossômica no táxon complexo Drosophila serido (Diptera; Drosophilidae). Rev Bras Genet 12: 729–745.
- Vilela CR. 1983. Uma revisão do grupo de espécies Drosophila repleta (Diptera; Drosophilidae). Rev Bras Entomol 27: 1–114.
- Vilela CR e Sene FM. 1977. Duas novas espécies neotrópicas do grupo repleta do gênero Drosophila (Diptera; Drosophilidae). Papéis Avulsos de Zoologia 30: 295–299.
