Eficácia do fibrina rica em plaquetas de silício e osso autólogo na regeneração óssea em defeitos calvários de coelhos: um estudo radiológico e histológico.
Tradução automática
O artigo original está escrito em EN language (link para lê-lo) .
Resumo: Reparar defeitos ósseos em Cirurgia Oral frequentemente requer o uso de técnicas de regeneração óssea. O silício é um elemento que tem sido empregado como material de regeneração em vários estudos. Em nosso estudo, o silício foi combinado com osso autólogo e membranas de fibrina rica em plaquetas (PRF) para analisar o comportamento deste elemento na regeneração óssea. Quatro defeitos circunferenciais foram criados na vault craniana de 5 coelhos da Nova Zelândia. Os seguintes elementos foram aplicados à regeneração dos defeitos: (P): PRF; (S): silício e (B): osso autólogo, com a seguinte distribuição dos grupos de estudo: Grupo 1 (PSB); Grupo 2 (PS); Grupo 3 (SB) e Grupo 4 (CONTROLE): grupo não regenerado. Os animais foram sacrificados após 3 semanas. Estudos de microtomografia computadorizada (μ-CT) foram realizados, assim como os histomorfométricos. O teste estatístico ANOVA foi utilizado com um teste post-hoc de Bonferroni para comparar os resultados (p≤ 0,05). Radiologicamente, os grupos PSB e SB foram melhores em termos de quantidade e percentual de osso saudável observado, mas não significativamente em comparação ao grupo controle. O grupo PS foi significativamente pior. O teste histológico revelou que o grupo PSB foi o que apresentou a maior área, percentual e perímetro de osso mineralizado. Ao avaliar o osso em formação (osteóide), nenhuma diferença foi observada entre os grupos, exceto no perímetro ósseo, onde o grupo SB foi significativamente melhor. A variável altura óssea não mostrou diferenças significativas. Em conclusão, podemos afirmar que a combinação de PRF, osso autólogo e silício proporciona bons resultados em 3 semanas, enquanto o grupo PS apresenta os piores resultados. Isso destaca a importância do osso autólogo fazer parte do material do enxerto para que o osso se mineralize.
Introdução
Defeitos ósseos em Cirurgia Oral são comuns e às vezes difíceis de reparar, exigindo técnicas de regeneração óssea para garantir o sucesso do tratamento restaurador. A pesquisa científica continua a avançar na compreensão dos processos biológicos e fisiológicos envolvidos na cicatrização, regeneração e remodelação óssea. In vivo, a engenharia de tecidos abrange a regeneração e reconstrução de tecidos e órgãos no próprio corpo. A premissa básica é que a manipulação controlada do microambiente extracelular pode levar ao controle da capacidade das células de se organizarem, crescerem, se diferenciarem e formarem uma matriz extracelular funcional e, finalmente, novo tecido funcional.
Técnicas regenerativas tornaram-se procedimentos de rotina e com resultados clínicos comprovados, mas sua previsibilidade e tempo de espera ainda são alguns dos fatores que motivam a investigação do desenvolvimento de novos e melhores materiais para regeneração óssea. O osso autólogo e o plasma rico em plaquetas são dois materiais amplamente utilizados no campo da implantologia para regenerar tecido mole e duro. No entanto, um material que combine todas as vantagens de cada um deles separadamente ainda não foi desenvolvido.
O uso de osso autólogo é amplamente descrito na literatura, uma vez que é considerado o padrão ouro para regeneração óssea. Não obstante, apesar de ter excelentes propriedades biológicas de osteoindução, osteocondução e osteogênese, o enxerto autólogo apresenta considerável morbidade e uma taxa de reabsorção elevada e imprevisível, mas demonstrou que seu comportamento melhora em combinação com outros substitutos ósseos, obtendo um volume mais abundante e consistente ao longo do tempo e uma cicatrização óssea mais rápida.
Juntamente com o osso autólogo, os derivados sanguíneos ricos em plaquetas também são frequentemente utilizados na regeneração de tecidos. Entre esses derivados está o fibrina rica em plaquetas [PRF]. É um biomaterial regenerativo amplamente utilizado em várias aplicações médicas. Além disso, ganhou maior popularidade em comparação com o plasma rico em plaquetas [PRP] porque é uma técnica de uma única etapa à qual não é necessário adicionar substâncias químicas. Outra vantagem é a liberação gradual maior de fatores de crescimento ao longo do tempo. Uma única membrana de fibrina contém uma grande quantidade de fatores de crescimento e citocinas envolvidos na regeneração óssea e na maturação de tecidos moles. É um biomaterial facilmente manipulável que, na Cirurgia Oral, é aplicado em terapia periodontal, preservação alveolar, procedimentos cirúrgicos de aumento ósseo e, em combinação com enxertos ósseos, na cirurgia de elevação do seio maxilar. Sua aplicação mais recente, ainda não testada clinicamente, é como um descontaminante para superfícies de titânio rugosas devido às suas propriedades antimicrobianas.
Finalmente, existem várias publicações que afirmam que íons bioinorgânicos como zinco, manganês, magnésio ou silício são essenciais no metabolismo ósseo. O silício é o segundo elemento mais abundante na crosta terrestre e no corpo humano é encontrado principalmente em áreas de mineralização e crescimento ósseo. Ele desempenha um papel vital na biologia do osso e do tecido conjuntivo, e embora seu mecanismo de ação não seja exatamente compreendido, graças à pesquisa de Carlisle e Schwarz, sabe-se que ele atua produzindo maior mineralização na matriz óssea através da síntese e estabilização da ligação cruzada das fibras de colágeno. O silício é um fator iniciador na mineralização óssea, uma vez que está presente em concentrações elevadas na matriz osteoide do osso imaturo e, à medida que o osso amadurece, a concentração de silício é diminuída pela concentração de cálcio. Tem sido utilizado ao longo dos anos como material regenerativo ósseo na forma de revestimento de implantes dentários, além de ser incorporado em biomateriais cerâmicos [hidroxiapatita, fosfato tricálcico ou cerâmicas de vidro], proporcionando bons resultados em relação à regeneração óssea em estudos in vitro e in vivo. Esse bom comportamento se deve à sua forte ligação. O silício tem sido empregado juntamente com outros biomateriais, como cerâmicas de vidro ou apatita, ou com fosfato tricálcico [TCP] para melhorar as propriedades biológicas dos materiais com os quais se liga. No entanto, até onde sabemos, não há estudos com osso devido à formação de uma camada biologicamente ativa, semelhante à apatita, em sua superfície.
O silício tem sido empregado juntamente com outros biomateriais, como cerâmicas de vidro ou apatita, ou com fosfato tricálcico [TCP], para melhorar as propriedades biológicas dos materiais com os quais se liga. No entanto, até onde sabemos, nenhum estudo foi encontrado sobre o uso de silício em combinação com osso autólogo ou com membranas de fibrina rica em plaquetas para uso na regeneração óssea.
No nosso estudo, o silício foi combinado com osso autólogo e membranas de PRF a fim de analisar o papel deste elemento na regeneração óssea quando combinado com outros biomateriais amplamente utilizados. O objetivo principal foi avaliar a regeneração óssea obtida nos diferentes grupos analisados (sendo estes (P): PRF; (S): silício e (B): osso autólogo, com uma distribuição do grupo de estudo da seguinte forma: Grupo 1 (PSB); Grupo 2 (PS); Grupo 3 (SB) e Grupo 4 (CONTROLE): grupo não regenerado) ao longo de um período de 3 semanas em um modelo de teste animal.
Materiais e Métodos
Especimes de animais de teste
O estudo experimental foi realizado no osso parietal de 5 coelhos da Nova Zelândia de laboratório com 6 meses de idade e pesando entre 3,5-4 kg. Os animais foram alimentados diariamente (ad libitum) com uma dieta para animais de laboratório utilizando Harlan-Teklad (2030). Os animais foram submetidos a cirurgia sob anestesia geral no Centro Cirúrgico Minimante Invasivo Jesús Usón, [Cáceres, Extremadura, Espanha]. O experimento foi conduzido de acordo com as diretrizes do Instituto Nacional de Saúde da Espanha (NIH) e da Diretiva Europeia 86/609/EEC sobre o cuidado e uso de animais experimentais. O estudo também cumpriu a Diretiva Europeia 2010/63/EU sobre a proteção de animais utilizados para fins experimentais e todas as leis e regulamentos locais. Os pesquisadores obtiveram a aprovação do Comitê de Ética da Instituição (CCMI-Ref 028/16). A identificação dos animais que compõem os grupos a serem avaliados foi realizada utilizando um chip. Durante o período experimental, os espécimes foram mantidos em gaiolas individuais.
Procedimento cirúrgico
Antes de iniciar o procedimento cirúrgico, a imobilização dos coelhos foi realizada e seus sinais vitais foram registrados. Os anestésicos utilizados foram midazolam intravenoso (0,25 mg / kg) e propofol (5 mg / kg) e gás sevoflurano inalatório a 2,8%. Dois analgésicos foram utilizados: tramadol (3 mg / kg) e cetorolaco (1,5 mg / kg). Após a sedação, uma amostra de sangue retro-orbital foi coletada de cada coelho usando uma agulha borboleta. As amostras foram colocadas em tubos de ensaio sem anticoagulante e foram centrifugadas por 12 minutos a uma velocidade de 2700 rpm à temperatura ambiente para obter membranas de PRF. Uma vez obtidas as membranas, estas foram cortadas em pequenas porções de aproximadamente 2 mm de diâmetro para serem divididas em três partes que foram utilizadas posteriormente para os três grupos experimentais. 0,01 mg por cc de versenato de silício foi utilizado. (Laboratório de Energia Natural da Venezuela, Caracas, Venezuela).
Quatro defeitos ósseos não autointegrantes foram realizados (diâmetro: 9 mm; profundidade: aproximadamente 3 mm, até atingir a dura-máter) no osso parietal, de cada lado da linha média do crânio, utilizando uma trefina (Helmut-Zepf Medical GmbH, Seitingen, Alemanha) montada em um micromotor cirúrgico a 2000 rpm sob irrigação com solução salina. Instrumentos piezoelétricos foram utilizados para remover a tabela interna e o osso medular de cada defeito. A profundidade foi controlada com uma sonda periodontal. Uma vez realizados os defeitos, o osso obtido foi moído e o material obtido foi dividido em duas partes iguais. A configuração dos grupos foi a seguinte: Grupo 1 (PSB): mistura de membrana de fibrina rica em plaquetas (P) + silício (S) + osso autólogo (B); Grupo 2 (PS): membrana de fibrina rica em plaquetas (P) + silício (S); Grupo 3 (SB): silício (S) + osso autólogo (B) e por último o Grupo 4 (CONTROLE) no qual nenhum material regenerativo foi colocado. A distribuição dos grupos no osso parietal pode ser vista na Tabela 1.
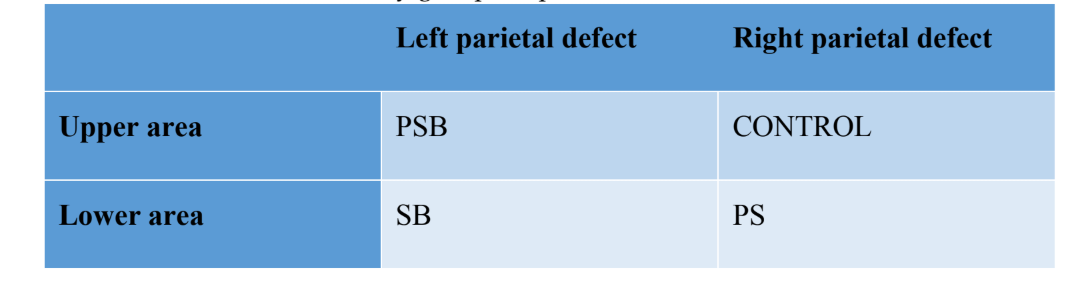
Após a sutura, agentes anti-inflamatórios e analgésicos foram administrados (carprofeno 1 ml / 12,5 kg e buprenorfina 0,05 mg / kg). Finalmente, os animais foram sacrificados usando uma overdose intravenosa de cloreto de potássio após 3 semanas. O procedimento cirúrgico pode ser visto na Figura 1.
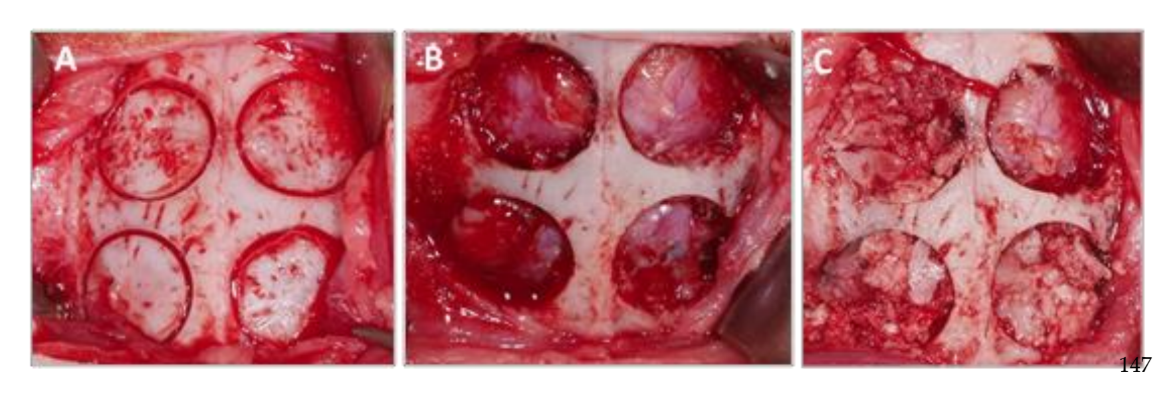
As amostras obtidas da caixa craniana de cada espécime foram cortadas no plano sagital anatômico, e após a separação da massa cerebral e lavagem em solução salina fisiológica, as peças foram cortadas e marcadas individualmente. Cada uma das amostras foi imersa em uma solução de formalina a 10% para análise tomográfica e histomorfométrica.
Microtomografia computadorizada (micro-CT)
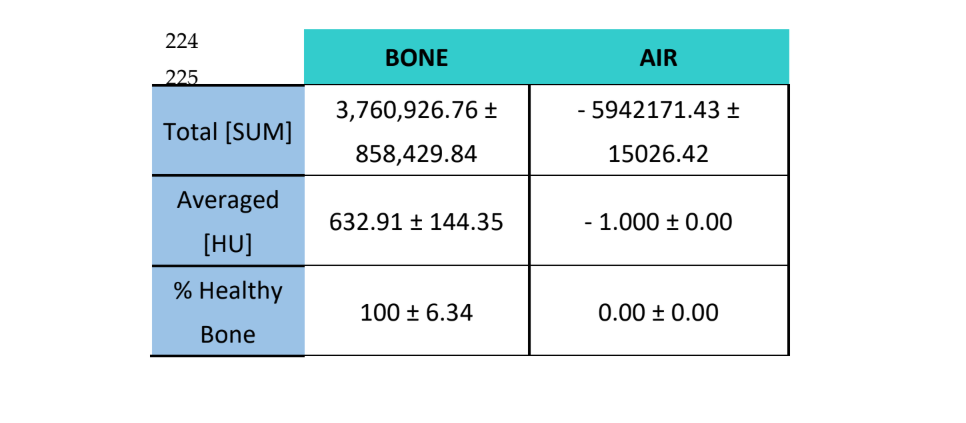
As amostras foram analisadas usando Tomografia Computadorizada (CT) com um scanner CT Bruker Albira (Bruker Co., Billerica, MA, EUA). As aquisições foram feitas usando os seguintes parâmetros: 1000 imagens, em projeção radiográfica de 360°, a 45 kV e 30 minutos de tempo de aquisição. A reconstrução tomográfica foi realizada usando o software Albira Suite (Bruker Co., Billerica, MA, EUA) e parâmetros de reconstrução padrão para gerar volumes 2D e 3D com resolução de 8,3 voxels/mm. A densidade óssea média medida em Unidades Hounsfield (HU) foi avaliada usando o software PMOD (Bruker Co., Billerica, MA, EUA), posicionando volumes esféricos de interesse [VOI] de 2 mm em uma formação de roseta dentro de cada lesão. Reconstruções de alta resolução de um volume de 10 mm3 foram realizadas em cada lesão usando o software Albira Suite, resultando em volumes com uma resolução de 20 voxels/mm. Para cada um dos volumes, as seguintes variáveis foram avaliadas: (1) A soma total dos valores Hounsfield de todos os voxels (SOMA TOTAL), (2) a média de todos os valores Hounsfield dos voxels (Média) em unidades Hounsfield e (3) a porcentagem de osso saudável (%).
Essas mesmas variáveis foram avaliadas para o ar ̶ como uma medida para estabelecer o ruído de fundo das imagens ̶ e para o osso circundante, no qual a porcentagem de osso saudável esperado é de 100%.
Processamento histológico da amostra
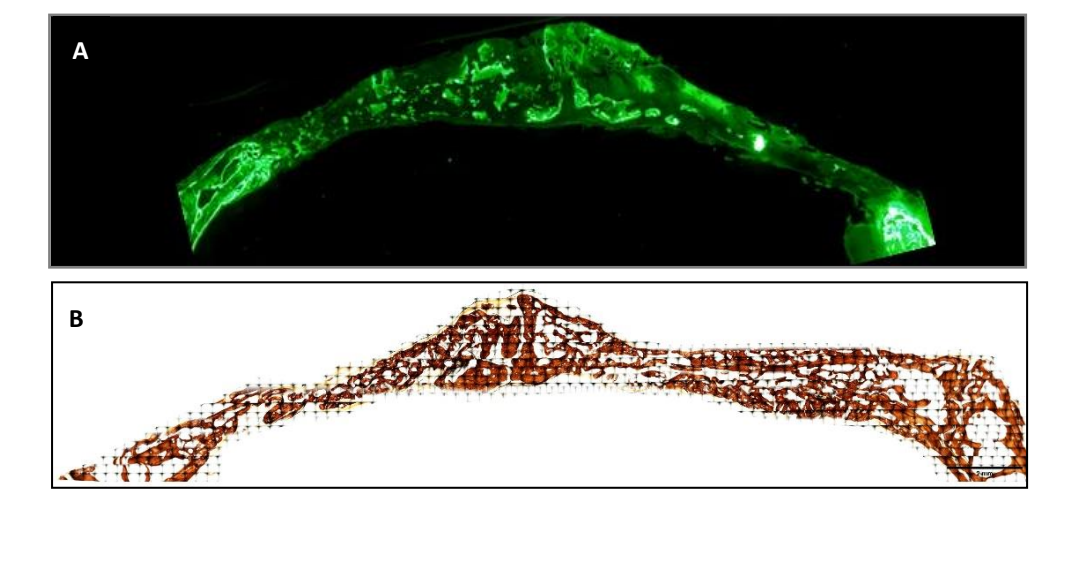
As amostras foram obtidas do crânio de cada amostra, cortando ao longo do plano sagital anatômico. Os espécimes desidratados foram imediatamente submersos em uma solução de 4% de formaldeído e 1% de cálcio embutidos em resina acrílica e foram processados para corte seguindo o método de Donath e Breuner para obtenção de cortes histológicos de 5µm de espessura. As amostras foram coradas com Von Kossa (VK) 5% de nitrato de prata (Sigma-Aldrich Chemical Co., Poole, Reino Unido) para visualizar o osso mineralizado após 3 semanas e foram observadas usando um microscópio óptico Olympus BXB61 (Olympus, Tóquio, Japão) com lentes de 1.5 e 20x. As imagens foram capturadas usando um processador de sinal digital DSP DS-Fi1 (Nikon, Tóquio, Japão) em conjunto com o software NIS-Elements 4.0 BR (Nikon, Tóquio, Japão). Uma imagem foi tirada de cada defeito ósseo. Uma semana antes de sacrificar os espécimes (com 2 semanas), um marcador fluorescente foi administrado aos coelhos para observar a deposição de calceína na matriz óssea recentemente depositada. As imagens fluorescentes foram capturadas usando uma câmera DSP DS-Fi1 [Nikon, Tóquio, Japão] em conjunto com o software NIS-Elements 4.0 BR [Nikon, Tóquio, Japão].
Para ambos os tipos de colorações (VK e imunofluorescência), quatro variáveis foram analisadas: altura do osso (apenas no VK) (mm) (BH), área do osso (µm2) (BA), porcentagem da área do osso (%) (BA) e perímetro do osso (µm) (BP).
Análise estatística
Para a análise estatística dos resultados obtidos, foi aplicado o teste t ANOVA com um teste de Bonferroni subsequente para comparar os resultados obtidos em ambos os grupos de estudo, utilizando o software STATVIEW F-4.5. Os resultados foram expressos como mediana ± desvio padrão para todas as variáveis analisadas. O nível de significância foi definido em p ≤ 0,05.
Resultados
Resultados para variáveis radiológicas
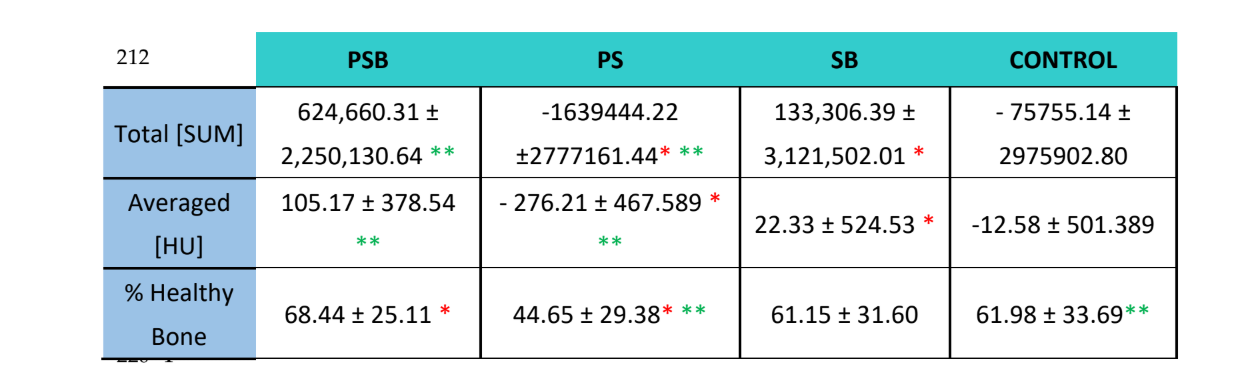
Usando o software Albira Suite, foram obtidas reconstruções em 2D e 3D de alta definição (Figura 2) e variáveis de quantificação óssea foram medidas, nas quais após 3 semanas não houve diferenças estatisticamente significativas entre os grupos PSB, SB e CONTROLE nas variáveis Total SOMA, Média e % Osso Saudável. O grupo PS foi o que obteve os valores menos significativos para essas três variáveis (Tabelas 2 e 3).
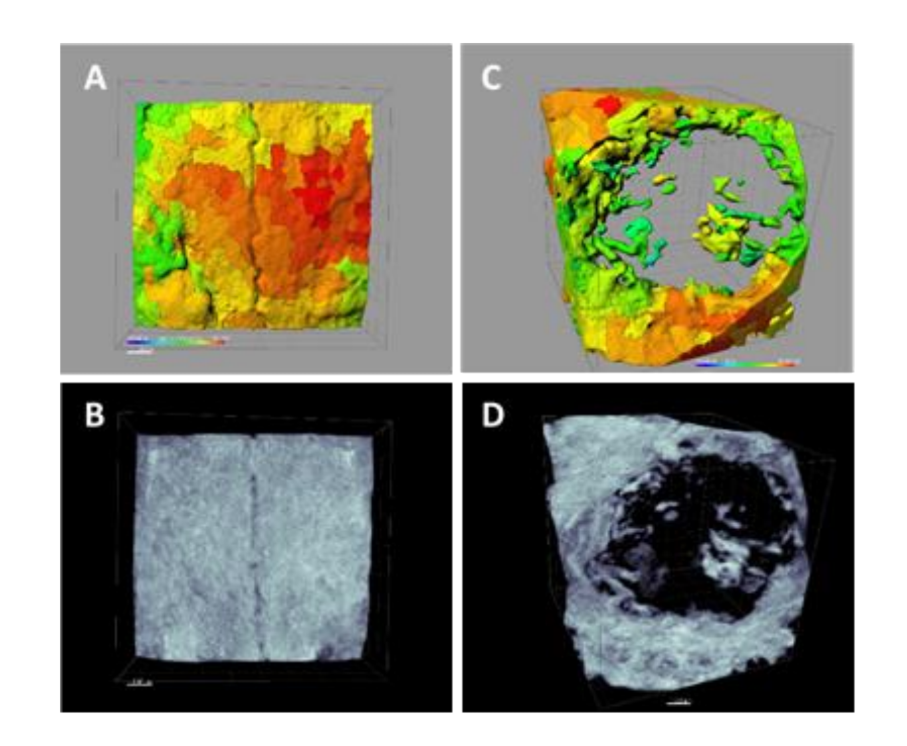
Três semanas depois, foram feitas avaliações histológicas dos quatro grupos (Tabela 4). A variável altura do osso não mostrou diferenças estatisticamente significativas entre os grupos após 3 semanas de cicatrização.
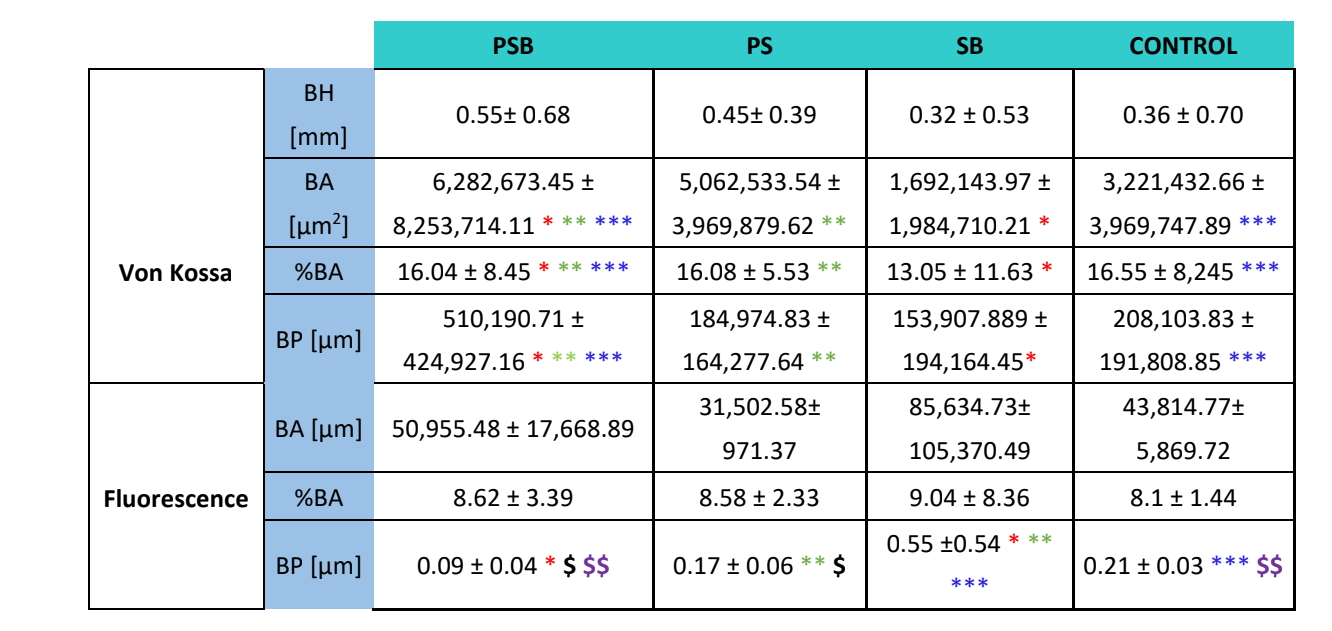
Foram realizadas duas colorações histológicas, Von Kossa e fluorescência (Figura 4). A primeira foi utilizada para observar o osso mineralizado. A área óssea [BA], a porcentagem da área [%BA] e o perímetro ósseo [BP] foram observados. A coloração de Von Kossa revelou que o grupo PSB apresentou BA e BP estatisticamente maiores do que os outros grupos. A %BA foi maior no grupo CONTROLE, embora não significativamente em comparação com todos os grupos, sendo o tamanho da amostra muito pequeno.
A coloração por fluorescência foi empregada para medir as variáveis mencionadas em osso recém-depositado. Nenhuma diferença estatisticamente significativa foi observada entre os grupos para as variáveis BA e %BA após 3 semanas. No grupo SB, o perímetro ósseo foi significativamente maior, sendo o grupo PSB aquele que apresentou um valor significativamente mais baixo.
Discussão
Neste estudo radiológico e histológico, observamos o osso formado após a colocação de diferentes materiais regenerativos ósseos aos quais foi adicionado silício, a fim de avaliar seu papel como estimulador da formação óssea.
No estudo radiológico (Tabela 2), observou-se que os grupos PSB e SB apresentaram valores mais altos em termos da quantidade e porcentagem de osso saudável observado. No entanto, essas diferenças não foram estatisticamente significativas em relação ao grupo CONTROLE. Por outro lado, o grupo PS apresentou valores significativamente mais baixos em comparação com os demais grupos.
O estudo histológico (Tabela 4) revelou que o grupo PSB foi o que apresentou a maior área, porcentagem e perímetro de osso mineralizado em comparação com os outros grupos. Por outro lado, ao avaliar a deposição de calceína na matriz óssea, nenhuma diferença foi observada entre os grupos em relação à área óssea e à porcentagem da área. O grupo SB apresentou um perímetro ósseo significativamente maior. A variável altura óssea não mostrou diferenças entre os grupos.
O silício é um íon bioinorgânico que tem sido empregado como material regenerativo em vários estudos, geralmente com outros biomateriais inorgânicos, como fosfato de cálcio ou hidroxiapatita. As vantagens que eles oferecem são um baixo custo e uma vida útil mais longa. A bioatividade do silício dependerá do acúmulo de íons de silício quando exposto a fluidos corporais, como o sangue, como no caso deste estudo. Esse fenômeno deu origem à formação de uma camada semelhante à apatita biologicamente ativa.
Até onde sabemos, não há evidências na literatura sobre o uso de versenato de silício como um material regenerativo, portanto, a comparação com outros estudos deve ser feita com cautela.
O método geralmente empregado é realizado pela substituição de hidroxiapatita ou fosfato de cálcio por silício através de métodos de precipitação, permitindo a obtenção de biomateriais regenerativos com melhores propriedades. Vários estudos in vitro mostraram que o silício é um elemento biocompatível e bioinerte. Além disso, promove angiogênese, diferenciação osteoblástica e aumenta a densidade mineral óssea, acelerando sua formação. Em um estudo recente, defeitos foram regenerados nas vaults cranianas de ratos e, após 4 semanas, observou-se que uma formação óssea significativamente maior ocorreu quando comparada a uma mistura semelhante à qual o silício não havia sido adicionado.
Da mesma forma, estudos mistos in vitro e in vivo foram realizados nos quais foi possível comparar o comportamento do silício em ambas as situações. Mao et al realizaram um estudo no qual o silício foi adicionado a uma mistura de fosfato de cálcio e cerâmica de vidro para regenerar defeitos nas vaults cranianas de coelhos. A viabilidade celular observada foi semelhante à apresentada no osso esponjoso bovino, mas com uma taxa maior de proliferação celular. Tudo isso foi atribuído à inclusão de íons de silício, que também impulsionaram outras funções celulares, como a adesão celular. No estudo histológico realizado, foi observada uma formação de novo osso aumentada no grupo experimental.
De acordo com a literatura revisada, uma maior quantidade de osso mineralizado seria esperada nos grupos contendo silício. Em nosso estudo, os grupos PS e SB não mostraram diferença em comparação com o grupo controle, sendo a combinação de silício, fibrina rica em plaquetas e osso autólogo [o grupo PSB] aquele que possibilitou um nível significativamente mais alto de osso mineralizado do que os demais.
O osso autólogo ainda é considerado o material padrão ouro para regeneração, uma vez que é o único com propriedades osteogênicas, osteoindutivas e osteocondutivas, o que lhe confere uma vantagem em comparação com os demais materiais disponíveis. Não obstante, sua disponibilidade limitada, morbidade e sua maior taxa de reabsorção têm impulsionado a busca por novos biomateriais.
Em nosso estudo, o osso autólogo combinado com silício [SB] não mostrou diferença significativa em comparação com os grupos PS e controle em relação ao osso calcificado. No entanto, foi, após o grupo PSB, aquele que apresentou uma maior quantidade de osso e o que apresentou maior perímetro ósseo de osso osteoide. Não há publicações nas quais qualquer um dos grupos do estudo tenha empregado osso autólogo com silício; e nossos resultados preliminares sugerem que precisaríamos observar como o osso autólogo se comporta ao longo de períodos mais longos.
O plasma rico em fibrina foi utilizado anteriormente na regeneração óssea como o único material de preenchimento, ou em combinação com osso autólogo, xenófitos ou enxertos aloplásticos, proporcionando melhores resultados em relação à regeneração óssea e cicatrização mais rápida em comparação com grupos de controle negativos. No entanto, há evidências limitadas sobre a combinação de silício e concentrados ricos em plaquetas. Apenas dois estudos foram encontrados na literatura que combinam ambos os materiais. Seus resultados diferem e também diferem dos nossos. No primeiro estudo, uma combinação de PRP/silício foi posteriormente gelificada com cloreto de cálcio. Foi aplicada em uma cultura celular de osteoblastos, e uma maior proliferação, maior viabilidade celular e maior deposição de cálcio foram observadas no grupo experimental do que no grupo sem silício. Por outro lado, no segundo estudo, um fator gerador de células (CGF) foi combinado com ortossilicato de sódio em osteoblastos humanos. Nenhuma diferença estatisticamente significativa foi observada em relação à proliferação ou crescimento celular em comparação com os grupos em que apenas ortossilicato ou apenas concentrado de plaquetas foram administrados. Em contrapartida, uma maior produção de colágeno tipo I foi observada. Em ambos os estudos, concluiu-se que as propriedades osteocondutivas do silício seriam potencializadas pelos fatores de crescimento no CGF. Ambos os resultados diferiram em nosso estudo, no qual o grupo PS foi o que obteve valores radiológicos significativamente mais baixos, embora histologicamente não tenha mostrado diferença em comparação com o grupo controle. A comparação com ambas as publicações deve ser feita com cautela, pois foram estudos in vitro com um material diferente. Não obstante, nossos resultados estariam de acordo com dois ensaios realizados em osso de coelho nos quais foi observado que o PRF não melhorou significativamente a regeneração óssea quando comparado com o grupo de controle negativo.
No nosso estudo, ocorreu uma maior formação de osso mineralizado no grupo PSB e isso pode ser devido a dois fatores: o primeiro deles é que o silício e o PRF poderiam aumentar sua capacidade osteocondutora ao se combinarem e, ao mesmo tempo, acelerariam a mineralização óssea. Isso poderia explicar o melhor desempenho do grupo PSB em nosso estudo. O segundo fator é a adição de osso autólogo ao biomaterial que, como mencionado anteriormente, é considerado o material de referência na regeneração óssea.
Como limitações do estudo, vale ressaltar o baixo número de espécimes na amostra, bem como o período de tempo avaliado. Os grupos de estudo PSB e SB ofereceram bons resultados de regeneração, no entanto, radiologicamente não apresentaram uma diferença significativa em comparação ao grupo controle. Uma forma de melhorar o estudo seria avaliar períodos de tempo mais longos, que talvez oferecessem resultados mais reveladores sobre o comportamento desses materiais regenerativos. Além disso, o uso de um grupo controle positivo (preenchendo o defeito com osso autólogo sem silício ou uma mistura apenas de osso autólogo e heterólogo) poderia ter sido contemplado. Outra limitação do estudo é a dificuldade em comparar devido ao tipo de material empregado (silício versenato). O silício é um elemento que é empregado de formas muito diferentes na literatura, como dióxido de silício, acetato de silício e silicato de sódio, e ainda não existe um protocolo validado. O silício granulado foi utilizado em nosso estudo. Em condições fisiológicas, o silício bio-disponível é encontrado na forma de ácido ortossilícico, enquanto nos estudos em que a hidroxiapatita substituída por silício foi empregada, o silício utilizado está na forma de SiO4, embora, por outro lado, tenha sido recentemente demonstrado que o silício em sua forma fisiológica poderia não ser concentrado na fase mineral inorgânica do osso sem antes ser metabolizado para ortossilicato.
No estudo radiológico, nenhuma diferença estatisticamente significativa foi observada entre os grupos de estudo em comparação com o grupo controle e isso pode ser devido à falta de uso de membranas ou agentes de fixação para revestir o defeito, a fim de estabilizar a coagulação e prevenir atrasos na completa ossificação da área, embora o período estudado (3 semanas) seja insuficiente para observá-lo.
Conclusões
O silício é um elemento promissor como material a ser incluído com outros materiais regenerativos ósseos devido ao seu baixo custo e boas propriedades observadas in vitro e in vivo, embora a definição de suas propriedades e condições ótimas de uso ainda esteja sendo investigada. A combinação de fibrina rica em plaquetas, osso autólogo e silício oferece bons resultados após 3 semanas. Os grupos PSB e SB são os que apresentam bons resultados, sendo que o grupo PSB apresenta maior velocidade de mineralização óssea em comparação ao SB e isso pode ser devido à inclusão de plasma rico em plaquetas e silício. Os resultados obtidos neste estudo revelam a importância do osso autólogo como parte do material do enxerto para que o osso se mineralize.
Dentro dos limites desta pesquisa, a análise histológica dos tecidos regenerados pode fornecer informações úteis sobre a natureza e a quantidade de osso formado com o uso de silício, fibrina rica em plaquetas e osso autólogo. Estudos adicionais são necessários para adquirir conhecimento sobre o verdadeiro potencial regenerativo de íons bioinorgânicos como o silício.
Autores: Argimiro Hernández-Suarez, María Rizo-Gorrita, Dubraska Suárez-Vega, Gladys Velazco, Ivan Rodriguez Gelfenstein, María-Ángeles Serrera-Figallo e Daniel Torres-Lagares
Referências:
- Ferres E. Estudo do efeito da adição de silício ao beta-fosfato tricálcico e hidroxiapatita na neoformação óssea em defeitos críticos em calotas e coelhos. Tese de Doutorado. Universidade de Murcia.2017.
- Morales D. Engenharia tecidual como pilar da medicina regenerativa em estomatologia. Revista Cubana de Estomatología 2014;51(3):288-304
- Oppenheimer AJ, Tong L, Buchman SR. Enxerto Ósseo Craniofacial: A Lei de Wolff Revisitada. Craniomaxillofac Trauma Reconstr. 2008;1(1):49-61.
- Henkel J, Woodruff MA, Epari DR, Steck R, Glatt V, Dickinson IC, Choong PF, Schuetz MA, Hutmacher DW. Regeneração Óssea Baseada em Conceitos de Engenharia de Tecidos - Uma Perspectiva do Século 21. Bone Res. 2013 Sep 25;1(3):216-48.
- Mordenfeld A, Johansson CB, Albrektsson T, Hallman M. Um ensaio clínico randomizado e controlado de duas composições diferentes de osso bovino desproteinizado e osso autógeno usados para aumento lateral da crista. Clin Oral Implants Res. 2014 Mar;25(3):310-320.
- Masoudi E, Ribas J, Kaushik G, Leijten J, Khademhosseini A. Derivados de Sangue Rico em Plaquetas para Engenharia de Tecidos Baseada em Células-Tronco e Regeneração. Curr Stem Cell Rep. 2016 Mar;2(1):33-42.
- Anitua E, Sánchez M, Nurden AT, Nurden P, Orive G, Andía I. Novas percepções e novas aplicações para terapias com fibrina rica em plaquetas. Trends Biotechnol. 2006 May;24(5):227-34.
- Amaral Valladão CA Jr, Freitas Monteiro M, Joly JC. Regeneração óssea guiada em aumento ósseo vertical e horizontal em estágios usando fibrina rica em plaquetas associada a enxertos ósseos: um estudo clínico retrospectivo. Int J Implant Dent. 2020 Oct 17;6(1):72.
- Cho YS, Hwang KG, Jun SH, Tallarico M, Kwon AM, Park CJ. Análise comparativa radiológica entre preenchimento com solução salina e fibrina rica em plaquetas após levantamento sinusal transcrestal hidráulico sem enxerto ósseo adjunto: Um ensaio clínico randomizado controlado. Clin Oral Implants Res. 2020 Nov;31(11):1087-1093.
- Areewong K, Chantaramungkorn M, Khongkhunthian P. Fibrina rica em plaquetas para preservar alvéolos ósseos após extração dentária: Um ensaio clínico randomizado controlado. Clin Implant Dent Relat Res. 2019 Dec;21(6):1156-1163.
- de Almeida Barros Mourão CF, de Mello-Machado RC, Javid K, Moraschini V. O uso de fibrina rica em leucócitos e plaquetas na gestão da cicatrização de tecidos moles e dor em alvéolos pós-extração: Um ensaio clínico randomizado. J Craniomaxillofac Surg. 2020 Apr;48(4):452-457.
- Castro AB, Herrero ER, Slomka V, Pinto N, Teughels W, Quirynen M. Capacidade antimicrobiana da Fibrina Rica em Leucócitos e Plaquetas contra patógenos periodontais. Sci Rep. 2019 Jun 3;9(1):8188.
- Schuldt L, Bi J, Owen G, Shen Y, Haapasalo M, Häkkinen L, Larjava H. Descontaminação de superfícies de implantes rugosas colonizadas por biofilme oral multiespécies pela aplicação de fibrina rica em leucócitos e plaquetas. J Periodontol. 2020 Aug 27.
- Zofková I, Nemcikova P, Matucha P. Elementos traço e saúde óssea. Clin Chem Lab Med. 2013 Aug;51(8):1555-61.
- Zhang D, Wong CS, Wen C, Li Y. Respostas celulares de células semelhantes a osteoblastos a 17 metais elementares. J Biomed Mater Res A. 2017 Jan;105(1):148-158.
- Arora M., Arora E. A Promessa do Silício: regeneração óssea e aumento da densidade óssea. J Arthroscopy and Joint Surgery 2017;4(3):103-105.
- Carlisle EM. Silício. Um possível fator na calcificação óssea. Science 1970;167:279–280.
- Carlisle EM. Silício como um elemento traço essencial na nutrição animal. Ciba Found Symp. 1986;121:123-39.
- Schwarz K, Milne DB. Efeitos promotores de crescimento do silício em ratos. Nature. 1972 Oct 6;239(5371):333-4.
- Dong M, Jiao G, Liu H, Wu W, Li S, Wang Q, Xu D, Li X, Liu H, Chen Y. Silício Biológico Estimula a Síntese de Colágeno Tipo 1 e Osteocalcina em Células Semelhantes a Osteoblastos Humanos Através da Via de Sinalização BMP-2/Smad/RUNX2. Biol Trace Elem Res. 2016 Oct;173(2):306-15.
- Price CT, Koval KJ, Langford JR. Silício: uma revisão de seu papel potencial na prevenção e tratamento da osteoporose pós-menopáusica. Int J Endocrinol. 2013;2013:316783.
- Zou S, Ireland D, Brooks RA, Rushton N, Best S. Os efeitos dos íons silicato na adesão, proliferação e diferenciação de osteoblastos humanos. J Biomed Mater Res B Appl Biomater. 2009 Jul;90(1):123-30. Uribe P, Johansson A, Jugdaohsingh R, Powell JJ, Magnusson C, Davila M, Westerlund A, Ransjö M. Silica solúvel estimula a diferenciação osteogênica e a comunicação por junções gap em células do folículo dental humano. Sci Rep. 2020 Jun 18;10(1):9923.
- Kim, E. J., Bu, S. Y., Sung, M. K. & Choi, M. K. Efeitos do silício na atividade osteoblástica e mineralização óssea de células MC3T3-E1. Biol. Trace Elem. Res. 2013; 152(1):105–12.
- Hench LL, Xynos ID, Polak JM. Vidros bioativos para regeneração tecidual in situ. J Biomater Sci Polym Ed. 2004;15(4):543-62.
- Chowdhury M. As Formulações à Base de Sílica para Liberação de Medicamentos, Tratamento Ósseo e Regeneração Óssea. ChemBioEng Rev 2016; 3(5):229-246.
- Byun IS, Sarkar SK, Anirban Jyoti M, Min YK, Seo HS, Lee BT, Song HY. Biocompatibilidade inicial e resposta osteoblástica aprimorada da dopagem de Si em um substituto de enxerto ósseo BCP poroso. J Mater Sci Mater Med. 2010 Jun;21(6):1937-47.
- Mao Z, Gu Y, ZhangJ, Shu W.W., Cui Y. Desempenho biológico superior e atividade osteoindutiva de partículas bioativas de regeneração óssea contendo Si para reconstrução do osso alveolar. Ceram. Int. 2020. 46(2020):353-364.
- Wang X, Ito A, Sogo Y, Li X, Oyane A. Camadas de compósito silicato-apatita em hastes de fixação externa e avaliação in vitro usando fibroblastos e osteoblastos. J Biomed Mater Res A. 2010 Mar 1;92(3):1181-9.
- Roh J, Kim JY, Choi YM, Ha SM, Kim KN, Kim KM. Regeneração Óssea Usando uma Mistura de Coral HA Substituído por Silício e β-TCP em um Modelo de Defeito Ósseo Calvarial em Ratos. Materials (Basel). 2016 Feb 6;9(2):97.
- Toledano M, Toledano-Osorio M, Osorio R, Carrasco-Carmona Á, Gutiérrez-Pérez JL, Gutiérrez-Corrales A, Serrera-Figallo MA, Lynch CD, Torres-Lagares D. Doxiciclina e Polímeros de Sílica-Nanofibras Carregados com Zinco como Biomateriais para Regeneração Óssea. Polímeros (Basel). 2020 May 25;12(5):1201.
- Sánchez F, Orero A, Soriano A, Correcher C, Conde P, González A, Hernández L, Moliner L, Rodríguez-Alvarez MJ, Vidal LF, Benlloch JM, Chapman SE, Leevy WM. ALBIRA: um sistema de imagem PET∕SPECT∕CT para pequenos animais. Med Phys. 2013 May;40(5):051906.
- Donath K, Breuner G. Um método para o estudo de ossos e dentes não desmineralizados com tecidos moles anexados. A técnica Säge-Schliff (serragem e moagem). J Oral Pathol. 1982 Aug;11(4):318-26.
- Garbo C, Locs J, D'Este M, Demazeau G, Mocanu A, Roman C, Horovitz O, Tomoaia-Cotisel M. Hidroxiapatitas Avançadas Multi-Substituídas por Mg, Zn, Sr, Si para Regeneração Óssea. Int J Nanomedicine. 2020 Feb 13;15:1037-1058.
- Wang W, Yeung KWK. Enxertos ósseos e substitutos biomateriais para reparo de defeitos ósseos: Uma revisão. Bioact Mater. 2017 Jun 466 7;2(4):224-247.
- Götz W, Tobiasch E, Witzleben S, Schulze M. Efeitos de Compostos de Silício na Biomineralização, Osteogênese e Formação de Tecidos Duros. Pharmaceutics. 2019 Mar 12;11(3):117.
- Gibson IR, Best SM, Bonfield W. Efeito da substituição de silício na sinterização e microestrutura da hidroxiapatita. J Am Ceram Soc. 2002;85(11):2771–2777
- Porter AE, Botelho CM, Lopes MA, Santos JD, Best SM, Bonfield W. Comparação ultraestrutural da dissolução e precipitação de apatita na hidroxiapatita e hidroxiapatita substituída por silício in vitro e in vivo. J Biomed Mater Res A. 2004 Jun 15;69(4):670-9.
- Li H, Chang J. Materiais silicatados bioativos estimulam angiogênese em sistema de co-cultura de fibroblastos e células endoteliais através do efeito parácrino. Acta Biomater. 2013 Jun;9(6):6981-91.
- Shie MY, Ding SJ, Chang HC. O papel do silício na proliferação e apoptose de células semelhantes a osteoblastos. Acta Biomater. 2011 477 Jun;7(6):2604-14.
- Thian E.S., Huang J., Best S.M., et al., A resposta dos osteoblastos ao filme fino de hidroxiapatita substituída por silício nanocristalino. Biomaterials 2006; 27(13):2692–2698
- Lee, S. H., Kim, S. W., Lee, J. I., Yoon, H. J. O efeito da fibrina rica em plaquetas na regeneração óssea e angiogênese em defeitos cranianos de coelhos. Engenharia de Tecidos e Medicina Regenerativa 2015. 12(5):362-370.
- Jeon YR, Kim MJ, Kim YO, Roh TS, Lee WJ, Kang EH, Yun IS. Regeneração Óssea Sem Escaffold Usando Fibrina Rica em Plaquetas em Modelo de Defeito Calvarial. J Craniofac Surg. 2018 Jan;29(1):251-254.
- Sindel A, Dereci Ö, Toru HS, Tozoğlu S. Comparação Histomorfométrica da Regeneração Óssea em Defeitos Ósseos de Tamanho Crítico Usando Matriz Óssea Desmineralizada, Fibrina Rica em Plaquetas e Ácido Hialurônico como Substitutos Ósseos. J Craniofac Surg. 2017 Oct;28(7):1865-1868.
- Kökdere NN, Baykul T, Findik Y. O uso de fibrina rica em plaquetas (PRF) e enxerto ósseo autógeno particulado misturado com PRF no tratamento de defeitos ósseos: Um estudo experimental e histomorfométrico. Dent Res J (Isfahan). 2015 Sep-Oct;12(5):418-24.
- Karayürek F, Kadiroğlu ET, Nergiz Y, Coşkun Akçay N, Tunik S, Ersöz Kanay B, Uysal E. Combinando fibrina rica em plaquetas com diferentes materiais de enxerto ósseo: Um estudo experimental sobre os aspectos histopatológicos e imuno-histoquímicos da cicatrização óssea. J Craniomaxillofac Surg. 2019 May;47(5):815-825.
- Knapen M, Gheldof D, Drion P, Layrolle P, Rompen E, Lambert F. Efeito da fibrina rica em leucócitos e plaquetas (L-PRF) na regeneração óssea: um estudo em coelhos. Clin Implant Dent Relat Res. 2015 Jan;17 Suppl 1:e143-52.
- Sani F, Mehdipour F, Talaei-Khozani T, Sani M, e RazbanV. Fabricação de scaffolds de plasma rico em plaquetas/sílica para engenharia de tecidos ósseos Bioinspirados, Biomiméticos e Nanobiomateriais 2018 7:2, 74-81.
- Bonazza V, Borsani E, Buffoli B, Parolini S, Inchingolo F, Rezzani R, Rodella LF. Tratamento in vitro com fatores de crescimento concentrados (CGF) e ortossilicato de sódio afeta positivamente a renovação celular em três linhagens celulares humanas diferentes. Cell Biol Int. 2018 Mar;42(3):353-364.
- Faot F, Deprez S, Vandamme K, Camargos GV, Pinto N, Wouters J, van den Oord J, Quirynen M, Duyck J. O efeito das membranas L-PRF na cicatrização óssea em defeitos ósseos da tíbia de coelhos: resultados de micro-CT e biomarcadores. Sci Rep. 2017 Apr 12;7:46452.
- Fielding GA, Smoot W, Bose S. Efeitos de dopantes de SiO2, SrO, MgO e ZnO em fosfatos tricálcicos osteoblásticos na expressão de Runx2. J Biomed Mater Res A. 2014 Jul;102(7):2417-26.
- Kamitakahara M, Tatsukawa E, Shibata Y, Umemoto S, Yokoi T, Ioku K, Ikeda T. Efeito da incorporação de silicato nas respostas in vivo de cerâmicas de α-fosfato tricálcico. J Mater Sci Mater Med. 2016 May;27(5):97.
- Chappell HF, Jugdaohsingh R, Powell JJ. A incorporação fisiológica de silício no mineral ósseo requer metabolismo do ácido ortossilícico para SiO44. J R Soc Interface. 2020 Jun;17(167):20200145.
- Gutiérrez-Prieto SJ, Fonseca LF, Sequeda-Castañeda LG, Díaz KJ, Castañeda LY, Leyva-Rojas JA, Salcedo-Reyes JC, Acosta AP. 508 Elaboração e Biocompatibilidade de um Material de Hidroxiapatita Derivada de Casca de Ovo Modificado com Si/PLGA para Regeneração Óssea em Odontologia. Int J Dent. 2019 Dec 5;2019:5949232.
- Szurkowska K, Szeleszczuk Ł, Kolmas J. Efeitos das Condições de Síntese na Formação de Fosfatos Tricálcicos Substituídos por Si. Int J Mol Sci. 2020 Dec 1;21(23):9164.
