Administração local repetida de gel de ácido hialurônico como tratamento adjunto de bolsas residuais em pacientes com periodontite em cuidados periodontais de suporte. Um ensaio clínico controlado randomizado.
Tradução automática
O artigo original está escrito em EN language (link para lê-lo) .
Resumo
Objetivos Avaliar o efeito da aplicação de ácido hialurônico (HyA) como adjunto à reinstrumentação de bolsas residuais em pacientes submetidos a cuidados periodontais de suporte (CPS) regulares.
Métodos Pacientes com periodontite crônica (estágio III e IV, grau B e C) com 4 bolsas residuais interproximais foram randomicamente designados para o grupo teste (gel de HyA) ou controle (solução salina). Após a instrumentação subgengival, a substância teste ou controle foi aplicada subgengivalmente, depois diariamente supragengivalmente por 3 meses, e se necessário uma segunda vez após a reinstrumentação subgengival após 3 meses. Parâmetros clínicos e de resultado relatados pelos pacientes foram registrados a cada 3 meses durante 12 meses. O fechamento da bolsa [profundidade de sondagem da bolsa (PSB) ≤ 4mm com ausência de sangramento à sondagem (SaS) em PSB = 4mm] foi o principal parâmetro de resultado.
Resultados Cinquenta e seis pacientes (221 locais experimentais) foram analisados. O fechamento da bolsa foi alcançado em 56,8 e 46,6% dos locais experimentais no grupo teste e controle, respectivamente (p > 0,05), enquanto a mediana da PSB e a distribuição da PSB (< 5mm/5mm/ > 5mm) diferiram significativamente entre os grupos em favor do grupo teste, aos 12 meses. Além disso, significativamente menos locais no grupo HyA necessitaram de reinstrumentação aos 3 meses, e os locais no grupo HyA mostraram uma tendência para menores chances de permanecer doentes em comparação com o grupo controle (OR 0,48, 95%CI 0,22–1,06). As chances de um local permanecer doente após 12 meses aumentaram significativamente na presença de placa (OR 7,94, 95%CI 4,12–15,28), mas, em geral, diminuíram significativamente ao longo do tempo (OR 0,48, 95%CI 0,28–0,81).
Conclusão A reinstrumentação de bolsas residuais em pacientes com SPC, por si só, leva a um aumento significativo no fechamento das bolsas ao longo do tempo; isso foi impedido pelo controle inadequado da placa. A aplicação local repetida de HyA resulta em menos locais que requerem reinstrumentação e pode melhorar ligeiramente a taxa de fechamento das bolsas. (registro clinicaltrials.gov nr. NCT04792541).
Relevância clínica O gel de HyA é fácil de aplicar, bem aceito pelos pacientes e pode ter algum efeito positivo em termos de menos locais que requerem reinstrumentação em 3 meses e maior taxa de fechamento das bolsas em 12 meses.
Introdução
A instrumentação subgengival não cirúrgica inicial (ou seja, o segundo passo da terapia), seja manual ou por instrumentos (ultra)sonoros (ou uma combinação deles), é uma abordagem de tratamento muito bem-sucedida em pacientes com periodontite; em média, uma profundidade de sondagem de bolsa (PPD) rasa pode ser alcançada em 3 de 4 bolsas. Recentemente, o Workshop Mundial sobre a Classificação de Doenças e Condições Periodontais e Peri-Implantares e a Diretriz de Prática Clínica de Nível S3 da EFP definiram o objetivo do tratamento periodontal. No nível do local, o fechamento da bolsa é definido como PPD ≤ 4 mm e sem sangramento à sondagem (BoP), enquanto no nível do paciente, um paciente com periodontite tratada com sucesso e estável é caracterizado por ter 1) PPD de ≤ 4 mm, 2) sem PPD = 4 mm com BoP, e 3) BoP em toda a boca < 10%. Embora esse objetivo seja difícil de alcançar em todos os pacientes, foi demonstrado que pacientes que atingem esses pontos finais clínicos apresentam uma taxa reduzida de progressão/recorrência da doença e perda dentária devido à periodontite durante o cuidado periodontal de suporte a longo prazo (SPC). Assim, o uso de produtos adjuntos (administrados local ou sistemicamente) durante o segundo passo da terapia é frequentemente discutido, com o objetivo de 1) melhorar ainda mais a taxa de fechamento das bolsas, 2) reduzir a necessidade de terapia cirúrgica adicional e/ou 3) melhorar a taxa de alcançar um paciente com periodontite tratada com sucesso e estável. Isso, por sua vez, deve não apenas melhorar a estabilidade a longo prazo do tratamento e reduzir a perda dentária, mas também minimizar a morbidade do paciente e, eventualmente, os custos do tratamento. As várias opções e a eficácia dos adjuntos administrados localmente (ou seja, moduladores do hospedeiro ou antimicrobianos) durante o segundo passo da terapia foram avaliadas extensivamente dentro dos parâmetros da Diretriz de Prática Clínica de Nível S3 da EFP. Foi finalmente sugerido que apenas a clorexidina de liberação sustentada e antibióticos aplicados localmente podem ser considerados como opções válidas. Nesse contexto, há informações limitadas sobre o “melhor” ponto de entrega dos adjuntos aplicados localmente, em termos de (custo-)eficiência, ou seja, se devem ser aplicados durante o segundo passo da terapia ou durante o terceiro ou quarto passo da terapia na reinstrumentação de bolsas residuais/recidivantes, respectivamente. Considerando os impactos do paciente, da sociedade e/ou possíveis impactos biológicos do uso desnecessário de qualquer medida adjunta, a última abordagem permitiria limitar seu uso àqueles pacientes/lugares que não cicatrizam após a instrumentação subgengival inicial. Duas revisões sistemáticas recentes abordaram a eficácia dos adjuntos para pacientes com periodontite com bolsas residuais/recidivantes durante o SPC. Especificamente, entre os antimicrobianos administrados localmente, a clorexidina de liberação sustentada e as fibras de tetraciclina foram as que apresentaram maior classificação, com uma redução adicional de PPD estatisticamente e clinicamente significativa de aproximadamente 0,6 a 0,7 mm, enquanto evidências insuficientes estão disponíveis para qualquer outra opção de tratamento adjuntiva (ou seja, diferente de antimicrobianos).
Outro adjunto entregue localmente, no entanto, que não foi incluído em nenhuma das revisões sistemáticas mencionadas acima nem nas Diretrizes de Prática Clínica de Nível S3 da EFP, é o ácido hialurônico (HyA). Vários géis contendo HyA em diferentes concentrações têm sido, há vários anos, testados como adjuntos à instrumentação mecânica subgengival não cirúrgica e sua eficácia foi até resumida em algumas revisões sistemáticas. Essas revisões tiveram conclusões bem comparáveis, ou seja, a maioria dos ensaios clínicos incluídos relatou um efeito positivo, embora moderado, a favor do HyA em termos de redução de PPD e BoP. No entanto, houve uma grande variação nos modos de aplicação e frequência nos estudos originais, e todas as revisões enfatizaram a necessidade de mais ensaios clínicos randomizados controlados (RCTs) bem projetados, incluindo um relato suficiente dos detalhes do produto. Nesse contexto, atualmente não está claro se a aplicação repetida de um adjunto entregue localmente é, em geral, vantajosa em comparação com a aplicação única, ou seja, apenas logo após a instrumentação. No entanto, 2 RCTs recentes avaliaram a aplicação de HyA no consultório especificamente na re-instrumentação de bolsas residuais/recidivantes. Cada estudo testou um produto HyA diferente e frequência de aplicação; em um dos estudos, o HyA foi aplicado subgengivalmente, uma vez, enquanto no outro estudo o HyA foi aplicado subgengivalmente em 2 consultas consecutivas, mas ambos mostraram uma tendência a favor da aplicação de HyA.
Assim, parece razoável avaliar se a aplicação local combinada de HyA, ou seja, subgengivalmente no consultório, após a instrumentação mecânica, e repetidamente supragengivalmente, pelo paciente, uma vez por dia durante 3 meses, tem o potencial de melhorar a taxa de fechamento de bolsas em comparação com a re-instrumentação isoladamente no tratamento de bolsas residuais em pacientes com periodontite que estão passando por SPC regular.
Materiais e métodos
Desenho do estudo e participantes
O presente estudo foi um ensaio clínico randomizado, duplo-cego (paciente e observador), controlado por placebo, com grupos paralelos e acompanhamento de 12 meses, e é relatado de acordo com os padrões de relato de ensaios clínicos (Declaração CONSORT; Apêndice 1). O protocolo foi aprovado pelo comitê de ética regional (Dnr. 2016/468) e registrado no clinicaltrials.gov (NCT04792541); quaisquer alterações no protocolo após sua publicação estão listadas no Apêndice 2. O recrutamento de pacientes foi realizado entre dezembro de 2016 e janeiro de 2020, ou seja, o recrutamento de pacientes começou antes do Workshop Mundial sobre a Classificação de Doenças e Condições Periodontais e Peri-Implantares em 2017. Todos os pacientes com periodontite que haviam completado a fase de tratamento ativo há ≥ 6 meses e estavam inscritos em um programa regular de SPC (ou seja, etapa 4 do tratamento) em uma Clínica Especializada em Periodontologia (Serviço Dental Público, Värmland, Suécia), que atendiam aos seguintes critérios de inclusão, foram incluídos consecutivamente: (i) 35 a 75 anos, (ii) diagnóstico de periodontite crônica, (iii) pelo menos 10 dentes remanescentes, e (iv) 4 a 8 locais interproximais com PPD de ≥ 5 a < 8 mm e presença de BoP no momento da inclusão. Além disso, os seguintes critérios de exclusão foram definidos: (i) molares com envolvimento de furca classe II ou III, (ii) mobilidade dentária classe II ou III, (iii) > 2 mm de PPD mais profundo em outro local no mesmo espaço interproximal (iv) terapia antibiótica nos 6 meses anteriores ou durante a participação no estudo, (v) necessidade de profilaxia antibiótica antes da avaliação periodontal e/ou tratamento, (vi) uso prolongado de medicamentos anti-inflamatórios e imunossupressores, (vii) diabetes descontrolado ou recém-diagnosticado antes ou durante a participação no estudo, (viii) gravidez ou lactação, (ix) disfunção oclusal severa, (x) tratamento ortodôntico em andamento, e (xi) lesões endodônticas. Idade, gênero, status de tabagismo (ou seja, nunca / ex / fumante atual) e presença/ausência de diabetes mellitus bem controlado foram registrados para cada participante.
Produto de teste e placebo
O produto utilizado no grupo “teste/HyA” para aplicação sub- e supragengival foi um gel contendo ácido hialurônico (0,3%, não reticulado, de peso molecular médio; Afta Clear™ Gel; Sunstar Europe SA, Etoy, Suíça), enquanto o “grupo controle/placebo” recebeu um pequeno frasco de solução salina fisiológica. Ambos os produtos foram encobertos com fita branca, de modo que o paciente não soubesse a alocação do grupo.
Intervenção, randomização e cegamento
Antes do início do estudo, uma lista de sequência aleatória para alocação de grupos foi gerada por computador (razão 1:1 para o grupo teste/HyA e grupo controle/placebo) por um periodontista não incluído no processo de recrutamento (KB). Todos os participantes foram recrutados por um dos 3 higienistas dentais experientes (LG, AS, MSS). Quatro locais interproximais de cada participante foram definidos como locais experimentais (ou seja, mesio-bucal, mesio-palatino/-lingual, disto-bucal ou disto-palatino/-lingual); se possível, 1 local por quadrante foi escolhido, caso contrário, os locais experimentais tiveram que estar em diferentes espaços interproximais. Todos os participantes receberam, na linha de base, uma sessão padrão de SPC incluindo reinstrumentação com um dispositivo ultrassônico (E.M.S. Electro Medical Systems S.A., Nyon, Suíça) e/ou instrumentos manuais (HuFriedyGroup, Chicago, EUA) de todos os bolsões residuais por um dos 3 higienistas dentais mencionados acima; cada paciente foi tratado pelo mesmo higienista dental durante todo o período do estudo. A alocação do grupo foi mantida em sigilo até após a reinstrumentação dos bolsões residuais. Após a reinstrumentação, um periodontista (AZ) juntou-se à sessão de tratamento, revelou a alocação do grupo apenas para si mesmo, abrindo uma nota oculta no envelope com o formulário de relatório de caso do paciente, e aplicou o produto de teste ou placebo subgengivalmente em todos os locais experimentais. Para a aplicação subgengival, o produto de teste e o produto placebo foram transferidos para uma seringa estéril com uma agulha romba e os locais experimentais foram preenchidos até que o produto transbordasse do bolsão (Fig. 1). O mesmo periodontista realizou esse procedimento em todos os participantes, enquanto os higienistas dentais e os pacientes permaneceram cegos em relação à alocação do grupo. Cada paciente recebeu um folheto com um resumo das instruções relevantes e um desenho indicando os 4 locais experimentais, incluindo o tamanho correto das escovas interdentais (TePe Munhygienprodukter AB, Malmö, Suécia) para o espaço interproximal específico e o produto de teste ou placebo. Os pacientes deveriam aplicar o produto uma vez ao dia supragengivalmente com uma escova interdental após escovar os dentes, apenas nos locais experimentais, e durante os próximos 3 meses até a segunda consulta de SPC (ou seja, acompanhamento de 3 meses). Além disso, os pacientes foram instruídos a evitar escovar os dentes ou comer por 3 horas após a aplicação e não usar soluções de enxágue bucal ou quaisquer outros géis durante a participação no presente estudo. As sessões de SPC foram repetidas após 3, 6, 9 e 12 meses, no entanto, o paciente parou de aplicar o produto de teste ou placebo após os primeiros 3 meses. Finalmente, todos os locais experimentais com PPD = 5 mm e BoP ou PPD > 5 mm no acompanhamento de 3 meses receberam novamente reinstrumentação e uma segunda aplicação subgengival do produto alocado, conforme descrito acima. Em geral, todos os locais com PPD= 5 mm e BoP ou PPD>5 mm em qualquer uma das sessões de SPC receberam como padrão de cuidado reinstrumentação subgengival.
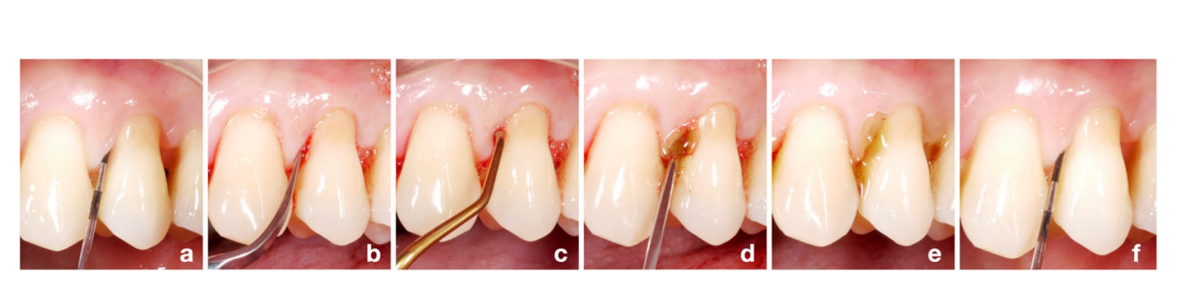
Avaliação de resultados e cegamento
A amostragem microbiológica subgengival dos 4 locais experimentais foi realizada na linha de base e após 3, 6 e 12 meses. Os resultados da amostragem microbiológica serão relatados em outro lugar. Além disso, após a amostragem microbiológica e em cada SPC (ou seja, na linha de base, e após 3, 6, 9 e 12 meses) o mesmo higienista dental cegado e calibrado (LG, AS, MSS) registrou PPD, nível de inserção clínica (CAL), presença/ausência de BoP e presença/ausência de placa em cada local experimental. Como padrão de atendimento, o periodontista (AZ) desta Clínica Especializada específica controla as medições de PPD de cada higienista aproximadamente 2 a 3 vezes por ano, o que foi considerado como calibração. Além disso, em cada acompanhamento, os pacientes foram questionados sobre quaisquer mudanças em seu histórico médico e sobre qualquer uso de antibióticos nos 3 meses anteriores. No segundo SPC (ou seja, acompanhamento de 3 meses), os pacientes receberam adicionalmente um questionário curto sobre sua opinião sobre o produto testado. O questionário perguntava sobre a presença e intensidade da dor durante a aplicação e sobre a opinião dos pacientes sobre a consistência e o sabor do produto durante o uso em casa, utilizando uma escala de 1 a 10. Um resultado de tratamento bem-sucedido (ou seja, fechamento de bolsa) foi definido como PPD≤ 4 mm com ausência de BoP em PPD = 4 mm; se esses critérios não fossem atendidos, o local experimental permanecia classificado como “doente”. Este resultado composto foi definido como parâmetro de resultado primário e avaliado em cada SPC.
Critérios de elegibilidade para acompanhamento
Os pacientes foram agendados a cada 3 meses para SPC, no entanto, foi permitido um intervalo de 2,5 a 5 meses entre 2 sessões de SPC; se o tempo entre 2 sessões de SPC excedesse 5 meses, a consulta de SPC foi considerada como faltada. Além disso, o período total da primeira à quinta consulta de SPC não deveria exceder 18 meses, caso contrário, o paciente seria excluído. Devido à inclusão de vários pacientes antes do surto da pandemia de Covid-19, os pacientes puderam faltar à consulta de 6 ou 9 meses sem serem excluídos do estudo. No entanto, pacientes que faltaram a 2 sessões de SPC ou à consulta de 3 ou 12 meses também foram excluídos.
Cálculo do tamanho da amostra
Para o cálculo do tamanho da amostra, assumiu-se que 75 e 25% dos locais no grupo teste/HyA e no grupo controle/placebo, respectivamente, alcançariam o fechamento da bolsa, ou seja, PPD ≤ 4 mm com ausência de BoP em PPD = 4 mm. Na presença desses parâmetros clínicos, o risco de progressão da doença é considerado baixo e o tratamento é considerado bem-sucedido. Com base no conjunto de dados de uma publicação anterior, um coeficiente de correlação intraindividual de 0,42 é assumido para a presença de BoP. Com base nesse coeficiente de correlação, um poder de 0,80 e um valor alfa de 0,05, foi calculado um tamanho de amostra de 30 participantes por grupo (ou seja, uma população total de estudo de 60). Para compensar as desistências, um total de 80 pacientes (40 pacientes por grupo) foram recrutados consecutivamente.
Análise estatística
A distribuição de frequência para variáveis categóricas (como gênero, status de tabagismo, distribuição de PPD, etc.) e médias (desvios padrão) ou medianas e intervalos interquartis para variáveis contínuas (como idade, PPD, etc.) são relatadas separadamente para o grupo teste/HyA e o grupo controle/placebo. Para testar quaisquer diferenças entre o grupo teste/HyA e o grupo controle/placebo, foi aplicado o teste exato de Fisher ou o teste qui-quadrado para parâmetros categóricos (ou seja, o teste qui-quadrado foi aplicado se cada célula apresentasse uma frequência > 5) e para variáveis contínuas, foi utilizado um teste t independente (para dados normalmente distribuídos) ou um teste Mann Whitney-U (para dados não normalmente distribuídos). A normalidade dos dados foi controlada pelo teste de Shapiro-Wilk. O “estado de saúde do local experimental” foi definido como o parâmetro de resultado primário [dichotômico; “doente” (ou seja, PPD > 4 mm ou PPD = 4 mm com BoP) versus “tratado com sucesso/fechamento de bolsa” (ou seja, PPD ≤4 mm com ausência de BoP em PPD = 4 mm). Dois modelos de regressão logística de efeitos mistos multivariáveis foram calculados com a alocação do grupo como o principal preditor e os seguintes confundidores a priori: 1) tipo de dente (anterior / pré-molar / molar), 2) local interproximal (bucal / palatino/lingual), 3) PPD na linha de base no local experimental (5 mm / 6–7 mm), 4) placa no local experimental em cada consulta (ausente / presente), 5) status de tabagismo (nunca / ex-fumante / atual), 6) gênero (feminino / masculino), 7) tempo decorrido entre as consultas (meses) e 8) idade (anos). O primeiro modelo incluiu apenas os dados de 3 meses, enquanto o segundo modelo incluiu todos os dados coletados ao longo de um período de 12 meses; neste último modelo, um confundidor adicional foi adicionado, ou seja, ponto no tempo (3- / 6- / 9- / 12-meses de acompanhamento). A análise estatística foi realizada com STATA/IC 17.0 para Mac (Lakeway Drive, Texas, EUA) e um valor de p ≤ 0,05 foi considerado estatisticamente significativo.
Resultados
Características da população na linha de base (nível do paciente)
Oitenta pacientes com periodontite crônica (correspondendo a pacientes com periodontite em estágio III e IV e grau B e C) submetidos a SPC regular foram recrutados e randomizados. No total, 24 participantes desistiram ou não puderam ser incluídos na análise por vários motivos (para detalhes, veja a Fig. 2). As características dos 56 pacientes (ou seja, 30 e 26 pacientes no grupo teste/HyA e grupo controle/placebo, respectivamente), que contribuíram para a análise, estão exibidas na Tabela 1; nenhuma das características da linha de base no nível do paciente diferiu significativamente entre os 2 grupos. Em resumo, a amostra 1) consistia em cerca de 66% de mulheres, 2) tinha uma idade média de 58 anos, 3) incluía aproximadamente 46% de fumantes atuais e 4) tinha 3 diabéticos bem controlados.
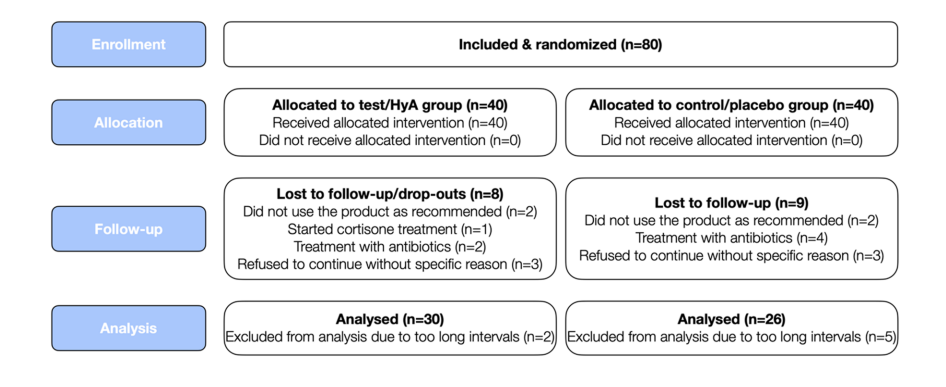
Características dos locais experimentais na linha de base (nível do dente)
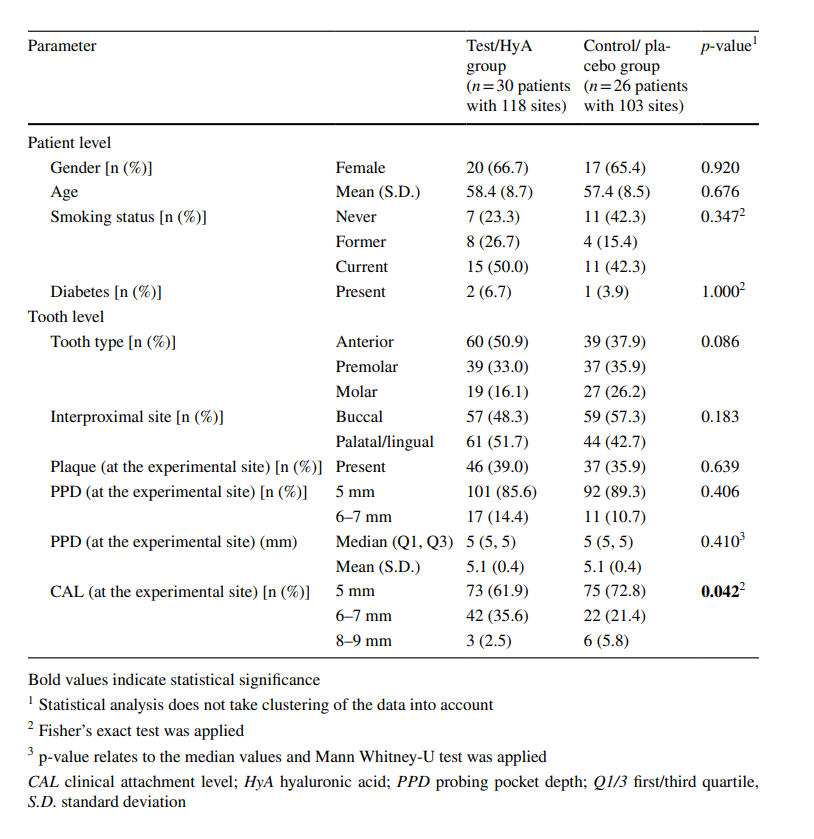
A amostra incluiu 221 locais experimentais, que foram todos julgados como “doentes” com presença de BoP na linha de base, de acordo com os critérios de elegibilidade. Exceto por 3 pacientes, cada paciente contribuiu com 4 locais experimentais. Três locais experimentais (um local de cada um dos 2 pacientes test/HyA e 1 paciente controle/placebo) tiveram que ser excluídos devido à reabilitação com uma nova restauração protética no dente experimental ou vizinho (n = 2) e devido a um paciente que aplicou por engano o produto no dente contralateral, ou seja, no errado (n = 1). As características basais dos locais experimentais do grupo test/HyA e controle/placebo estão exibidas na Tabela 1. O tipo de dente, locais interproximais, placa e PPD estavam bem distribuídos entre os 2 grupos, enquanto o grupo test/HyA contribuiu com significativamente mais locais apresentando um CAL ≥ 6 mm em comparação com o grupo controle/placebo (p = 0.042). A maioria dos locais apresentou PPD = 5 mm na linha de base, enquanto 14,4 e 10,7% do grupo test/HyA e controle/placebo, respectivamente, tinham um PPD de 6 a 7 mm na linha de base.
Características dos locais experimentais após 3 meses (nível do dente)
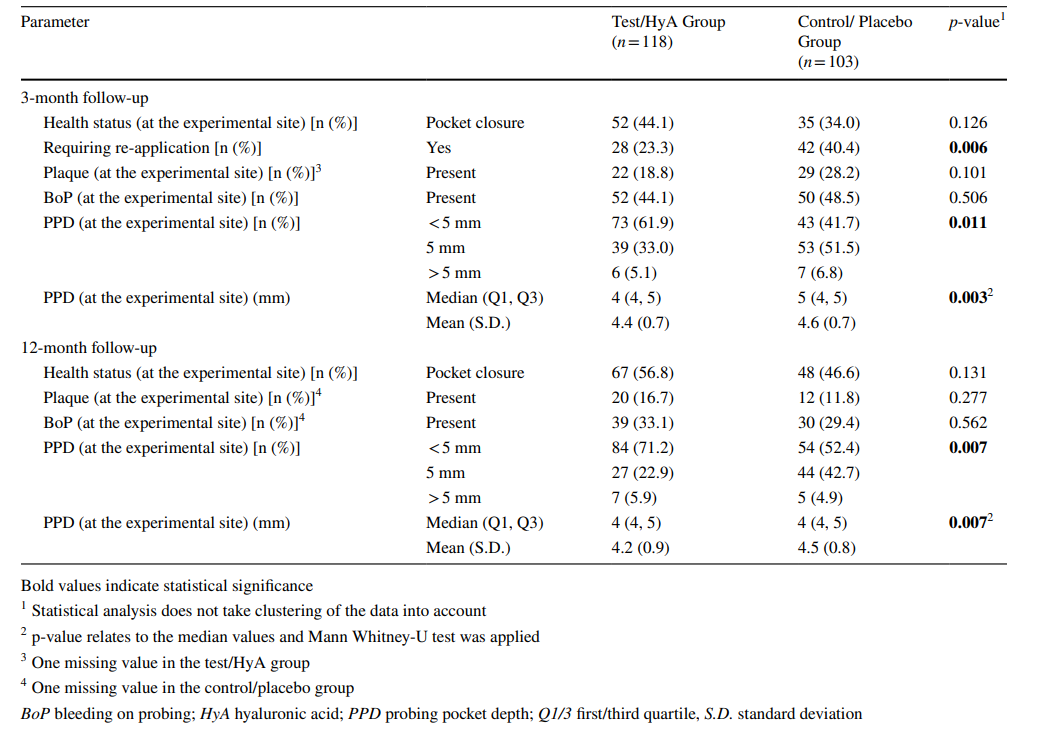
As características dos locais experimentais após 3 meses estão relatadas na Tabela 2. Após 3 meses, 44,1 e 34,0% dos locais experimentais do grupo teste/HyA e do grupo controle/placebo, respectivamente, alcançaram fechamento de bolsa sem diferença significativa entre os grupos. Da mesma forma, a presença de placa e BoP foi comparável entre os 2 grupos. No entanto, a mediana de PPD (p = 0,003) e a distribuição de PPD (< 5mm / 5 mm / > 5mm; p = 0,011) diferiram significativamente entre os grupos em favor do grupo teste/HyA. Especificamente, 61,9 e 41,7% dos locais experimentais do grupo teste/HyA e do grupo controle/placebo, respectivamente, apresentaram PPD < 5 mm. Além disso, significativamente menos locais no grupo teste/HyA (p = 0,006) em comparação com o grupo controle/placebo, 23,3 e 40,4%, respectivamente, necessitaram de re-aplicação subgengival no acompanhamento de 3 meses.
Avaliação do resultado do tratamento após 3 meses
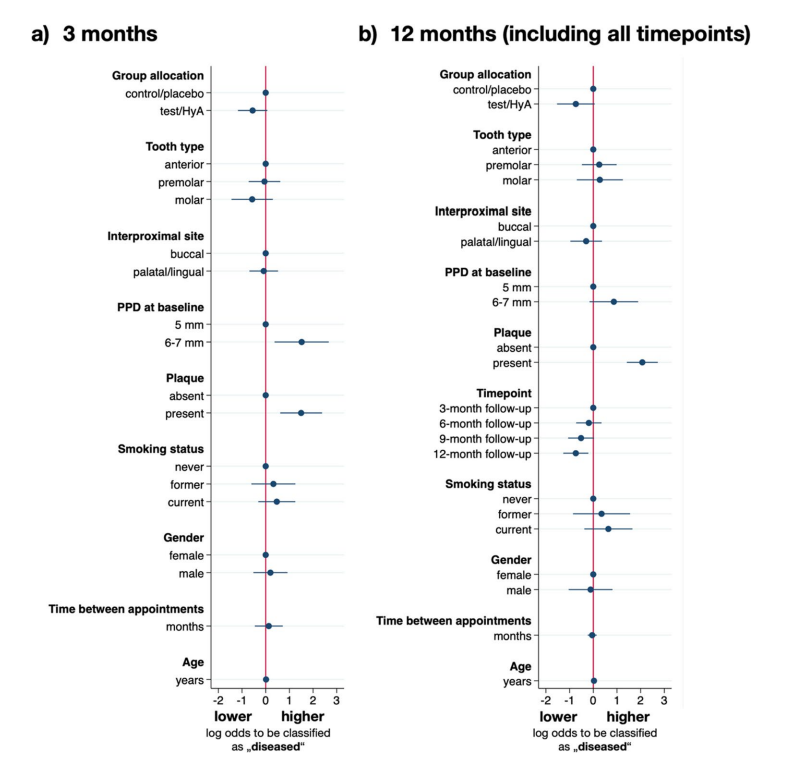
Os resultados da análise de regressão logística de efeitos mistos multivariáveis após 3 meses de SPC estão exibidos na Fig. 3a e na Tabela 3. Os locais experimentais no grupo teste/HyA tiveram chances ligeiramente, mas estatisticamente não significativas, menores em comparação com o grupo controle/placebo de permanecer “doentes” (ou seja, PPD > 4 mm ou PPD = 4 mm com BoP) (OR 0.58, 95% CI 0.31–1.07; p = 0.081). Dos confundidores incluídos, apenas a placa e o PPD na linha de base tiveram um efeito significativo no resultado. Especificamente, a presença de placa (OR 4.47, 95% CI 1.84–10.81; p = 0.001) e um PPD mais alto na linha de base (OR 4.57, 95% CI 1.45–14.34; p = 0.009) aumentaram significativamente as chances de permanecer “doente” na avaliação de 3 meses.
Características dos locais experimentais após 12 meses (nível do dente)
As características dos locais experimentais na avaliação final (seguimento de 12 meses) estão relatadas na Tabela 2. Na avaliação final, 56,8% e 46,6% dos locais experimentais do grupo teste/HyA e do grupo controle/placebo, respectivamente, alcançaram fechamento de bolsa sem diferença significativa entre os grupos. De forma semelhante, a presença de placa e BoP foram comparáveis entre os 2 grupos. No entanto, a mediana de PPD (p = 0,007) e a distribuição de PPD (< 5mm / 5 mm / > 5mm; p = 0,007) diferiram significativamente entre os grupos em favor do grupo teste/HyA. Especificamente, 71,2% e 52,4% dos locais teste/HyA e controle/placebo, respectivamente, apresentaram PPD < 5 mm e a mediana de PPD foi menor no grupo teste/HyA. No grupo teste/HyA, de 28 locais experimentais que receberam reaplicação aos 3 meses, 28,6% não estavam mais doentes após 12 meses, enquanto de 90 locais experimentais que não receberam reaplicação aos 3 meses, 34,4% foram classificados como “doentes” novamente. No grupo controle/placebo, de 42 locais experimentais que receberam reaplicação aos 3 meses, 33,3% não estavam mais doentes após 12 meses, enquanto de 61 locais experimentais que não receberam reaplicação aos 3 meses, 44,3% foram classificados como “doentes” novamente.
Avaliação do resultado do tratamento após 12 meses
Os resultados da análise de regressão logística de efeitos mistos multivariáveis estão exibidos na Fig. 3b e na Tabela 3. Os locais experimentais do grupo teste/HyA apresentaram chances ligeiramente, mas estatisticamente não significativas, menores em comparação ao grupo controle/placebo de permanecer “doente” (ou seja, PPD > 4 mm ou PPD = 4 mm com BoP) (OR 0.48, 95% CI 0.22–1.06; p = 0.070). Dos fatores de confusão incluídos, apenas a placa e o ponto de tempo tiveram um efeito significativo no resultado. Especificamente, a presença de placa aumentou significativamente as chances de permanecer “doente” em aproximadamente 8 vezes (OR 7.94, 95% CI 4.12–15.28; p < 0.001), e, de modo geral, as chances de permanecer “doente” diminuíram durante o período do estudo, alcançando significância na avaliação final (OR 0.48, 95% CI 0.28–0.81; p = 0.006).
Opinião dos pacientes
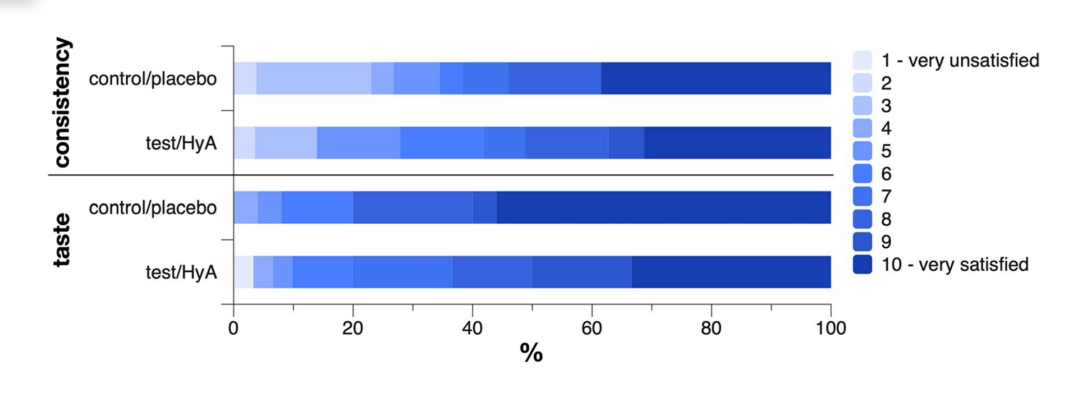
Um paciente de cada grupo relatou ter sentido dor na gengiva durante a aplicação do produto com uma intensidade de 3 a 4 em 10, sendo 10 a dor máxima. Um paciente do grupo teste/HyA não respondeu sobre a consistência e um paciente do grupo controle/placebo não respondeu sobre o sabor. Os grupos não apresentaram diferença significativa em sua opinião sobre a consistência e o sabor do produto (Fig. 4). Especificamente, os valores médios (desvio padrão) da escala para a consistência foram 7.2 (2.6) e 7.0 (3.0) no grupo teste/HyA e no grupo controle/placebo, respectivamente (p = 0.822), e os valores medianos (primeiro, terceiro quartil) da escala para o sabor foram 8.5 (7, 10) e 10 (8, 10) no grupo teste/HyA e no grupo controle/placebo, respectivamente (p = 0.184); para ambos os parâmetros, um valor de 10 representou estar muito satisfeito.
Segurança
Nenhum dos pacientes relatou efeitos colaterais/complicações relacionadas à aplicação do produto e nenhum evento adverso pôde ser observado clinicamente.
Discussão
Quimioterápicos administrados localmente são frequentemente utilizados como adjuntos ao tratamento não cirúrgico em pacientes com periodontite, seja na fase inicial do tratamento ou em bolsas residuais/recidivantes durante uma fase posterior do tratamento. No entanto, como a instrumentação subgengival não cirúrgica inicial é um tratamento bastante bem-sucedido por si só, uma abordagem mais específica para locais que não cicatrizaram durante a segunda etapa da terapia e/ou para bolsas recidivantes durante o SPC pode ser a abordagem mais relevante. Neste contexto, um gel contendo HyA, aplicado repetidamente (diariamente) por um período de 3 meses, como adjunto à reinstrumentação de bolsas residuais/recidivantes em pacientes submetidos a SPC regular, mostrou alguma tendência a melhorar o resultado, ou seja, uma taxa de fechamento de bolsa 10% maior foi observada para os locais que receberam HyA em comparação com aqueles no grupo controle que receberam solução salina fisiológica (ou seja, 57 versus 47% dos locais, respectivamente), após 12 meses. Além disso, a porcentagem de locais experimentais com PPD < 5 mm foi cerca de 1,4 vezes maior no grupo teste/HyA em comparação com o grupo controle/placebo (ou seja, 71 e 52% dos locais, respectivamente).
Esses resultados estão de acordo com os relatados em 2 RCTs recentes que avaliaram um gel contendo HyA como adjunto à reinstrumentação de bolsas residuais/recidivantes e mostraram que o uso de um gel contendo HyA resultou em uma tendência a resultados superiores em comparação com a reinstrumentação apenas. Além disso, ambos os estudos relataram em seu grupo de teste uma frequência semelhante de locais com PPD < 5 mm após 12 meses, ou seja, 76 a 77% nos 2 estudos anteriores e 71% aqui. Além disso, em um dos estudos RCT que relatou sobre o fechamento de bolsas (ou seja, PPD ≤ 4 mm sem BoP), uma taxa comparável no grupo HyA, como aqui, foi observada, ou seja, em 59 e 57%, respectivamente. No entanto, uma diferença significativa entre esses 2 RCTs e o estudo atual diz respeito às características do produto do gel HyA aplicado. Especificamente, um HyA não reticulado, de peso molecular médio, com uma concentração relativamente baixa (0,3%) foi utilizado neste estudo, enquanto os outros estudos utilizaram um produto com HyA reticulado, de alto peso molecular, em uma concentração mais alta ou um produto combinado com polinucleotídeos e HyA de alto peso molecular em uma concentração mais alta. Estudos laboratoriais em células periodontais ou patógenos associados à periodontite compararam os efeitos de HyA não reticulado e reticulado ou de HyA de diferentes pesos moleculares; nenhuma das formulações testadas mostrou qualquer efeito negativo em termos de cicatrização de feridas periodontais. Nesse contexto, devido à falta de ensaios clínicos comparativos até agora, permanece incerto se diferentes características de HyA realmente se traduzem em diferenças clinicamente relevantes. Outra diferença entre esses 2 RCTs e aqui diz respeito ao modo/frequência de aplicação de HyA. Neste estudo, o gel contendo HyA foi aplicado repetidamente (diariamente) supraginigivalmente por 3 meses pelos pacientes, além das aplicações subgengivais no consultório. Um dos estudos anteriores avaliou o efeito de uma aplicação repetida no consultório após 3 meses, mas não conseguiu mostrar qualquer efeito benéfico adicional de HyA após a reaplicação; no entanto, antes da reaplicação, nenhuma instrumentação subgengival adicional foi realizada neste estudo específico. Aqui, apenas locais com sinais remanescentes de patologia receberam uma reaplicação em combinação com a reinstrumentação subgengival. Em ambos os grupos (ou seja, teste e controle), aproximadamente 30% dos locais que necessitavam de reinstrumentação e reaplicação foram considerados tratados com sucesso ao final do ensaio. No entanto, embora o retratamento tenha melhorado a situação em 1 em cada 3 casos e nenhum efeito benéfico distinto de HyA pudesse ser notado, o número de locais que necessitavam de reinstrumentação (retrabalho) aos 3 meses foi significativamente menor no grupo HyA, comparado ao que recebeu NaCl. Finalmente, os dados atuais também não permitem qualquer conclusão sobre um potencial efeito adicional da aplicação supraginigival repetida pelos pacientes durante 3 meses, uma vez que um terceiro grupo com entrega subgengival no consultório estava ausente aqui.
De modo geral, a redução do número de bolsas residuais após o tratamento periodontal ativo (ou seja, etapas 1 a 3) mostrou ser benéfica em termos de recorrência/progressão da doença e perda dentária em vários estudos focando na SPC a longo prazo após o tratamento periodontal ativo. Assim, é razoável supor que qualquer medida de tratamento, como o uso de adjuntos aplicados localmente, que melhore a taxa de fechamento de bolsas – independentemente da fase do tratamento – pode contribuir positivamente também para o resultado a longo prazo. Nesse contexto, géis contendo HyA como adjunto à instrumentação subgengival na segunda etapa da terapia mostraram algum potencial em termos de redução de PPD e BoP, o que foi re-confirmado por RCTs mais recentes. Comparado a outros estudos com um desenho de estudo semelhante, mas avaliando produtos diferentes como adjuntos à re-instrumentação de bolsas residuais em pacientes com SPC, a frequência de fechamento de bolsas pareceu um pouco mais baixa aqui. Por exemplo, 2 RCTs recentes que avaliaram o efeito adjuntivo da aplicação sem retalho de derivados da matriz de esmalte, gel de hipoclorito de sódio e gel de clorexidina relataram fechamento de bolsas (ou seja, PPD ≤ 4 mm sem BoP) em 80, 78 e 63% dos locais em comparação com 57% aqui. Portanto, e considerando a falta de RCTs que comparam diretamente esses produtos, o HyA pareceu igualmente eficaz ao gel de CHX, mas ligeiramente inferior aos derivados da matriz de esmalte e ao gel de hipoclorito de sódio. Este último pode ser de interesse específico, uma vez que a combinação do gel de hipoclorito de sódio com gel de HyA reticulado recebeu recentemente atenção como tratamento adjuntivo combinado em pacientes com periodontite. No entanto, uma série de casos retrospectiva recente incluindo 29 pacientes com SPC com bolsas residuais/recidivantes relatou para essa abordagem combinada uma taxa de fechamento de bolsas um pouco mais baixa de 25%.
Entre os fatores de confusão utilizados para ajustar a análise atual, dois tiveram um efeito significativo no resultado na avaliação final, ou seja, controle de placa e conformidade/tempo, que estão ambos bem de acordo com a literatura. Especificamente, aqui a presença de placa, que foi avaliada em cada local experimental em cada sessão de SPC, reduziu significativamente as chances de alcançar o fechamento de bolsa. Motivar os pacientes para manter continuamente altos níveis de controle de placa durante o SPC é um desafio clínico bem conhecido e estudos recentes de SPC a longo prazo re-confirmaram a relevância clínica disso. Ambos os estudos, incluindo 100 e > 200 indivíduos, respectivamente, submetidos a aproximadamente 10 anos de SPC após tratamento periodontal ativo, mostraram um aumento do risco de recorrência da doença e perda dentária devido à periodontite com controle de placa inadequado. Além disso, os pacientes do presente RCT mostraram, de maneira geral e independente da alocação do grupo, uma melhoria significativa ao longo do tempo, que se tornou significativa após 12 meses. Especificamente, também no grupo controle/placebo, quase 50% dos locais experimentais alcançaram fechamento de bolsa ao final do ensaio. Esse tamanho de efeito de alcançar o fechamento de bolsa apenas por reinstrumentação mecânica é bem comparável com estudos anteriores que relataram taxas de 42 a 60%. Além disso, a participação no estudo por si só provavelmente tem um efeito benéfico na conformidade do ponto de vista do paciente, mas também do ponto de vista do dentista/higienista dental que pode ser mais insistente em manter o intervalo de 3 meses. Nesse contexto, foi demonstrado que um tempo mais curto entre sessões consecutivas de SPC pode resultar ao longo do tempo em redução da PPD e estabilidade periodontal, enquanto um tempo mais longo pode levar à instabilidade periodontal e, subsequentemente, à perda dentária.
O presente estudo – realizado em condições de “vida real” – apresenta algumas limitações, como uma taxa de desistência relativamente alta de 30%, que não nos permitiu alcançar o tamanho da amostra pretendido no grupo controle/placebo, ou seja, 26 em vez de 30 participantes foram analisados. A alta taxa de desistência deve-se pelo menos em parte ao fato de os participantes não comparecerem às suas consultas agendadas durante a pandemia de Covid-19, ou seja, embora uma faixa de 2,5 a 5 meses entre 2 sessões de SPC tenha sido aceita, quase 10% dos participantes (ou seja, 2 e 5 do grupo teste/HyA e do grupo controle/placebo, respectivamente) foram excluídos da análise devido a intervalos muito longos. No entanto, como o tempo entre 2 sessões de SPC parece ser um fator relevante, esse parâmetro foi incluído nas análises de regressão aqui, para corrigir no modelo a leve variação nos intervalos de SPC. No entanto, como o presente ensaio foi realizado em um desenho de grupo paralelo, os pacientes não receberam ambos os produtos, o que, por sua vez, deve limitar qualquer viés devido ao insuficiente mascaramento dos pacientes. Nesse contexto, foi interessante que os grupos não apresentaram diferença significativa em relação à opinião dos pacientes sobre a consistência e o sabor do produto; ambos os produtos foram bem aceitos pelos pacientes, o que, por sua vez, pode indicar boa adesão.
Conclusão
A reinstrumentação de bolsas residuais em pacientes com SPC, por si só, leva a um aumento significativo no fechamento das bolsas ao longo do tempo. Essa melhoria dependia da higiene bucal do paciente, ou seja, a presença de placa aumentava as chances de permanecer doente em aproximadamente 8 vezes. A aplicação adicional sub- e supragengival repetida de um gel contendo HyA resultou em significativamente menos locais necessitando de reinstrumentação em 3 meses, e em algumas diferenças clinicamente relevantes após 12 meses de SPC em comparação com o grupo controle/placebo, como 71 contra 52% dos locais experimentais alcançando um PPD < 5 mm, respectivamente. No entanto, a significância estatística desse efeito foi marginalmente perdida na análise ajustada sobre o fechamento das bolsas. Portanto, mais ensaios clínicos são necessários para confirmar a superioridade deste adjunto em comparação com a reinstrumentação subgengival isolada.
Autores: Kristina Bertl, Stefania Vlachou, Nikolaos Pandis, Antonios Zampelis, Andreas Stavropoulos
Referências:
- Sanz M, Herrera D, Kebschull M et al (2020) Tratamento da periodontite em estágio I-III - A diretriz de prática clínica de nível S3 da EFP. J Clin Periodontol 47(Supl 22):4–60. https://doi.org/10.1111/jcpe.13290
- Suvan J, Leira Y, Moreno Sancho FM, Graziani F, Derks J, Tomasi C (2020) Instrumentação subgengival para tratamento da periodontite. Uma revisão sistemática. J Clin Periodontol 47(Supl 22):155–175. https://doi.org/10.1111/jcpe.13245
- Chapple ILC, Mealey BL, Van Dyke TE et al (2018) Saúde periodontal e doenças e condições gengivais em um periodonto intacto e reduzido: relatório de consenso do grupo de trabalho 1 do Workshop Mundial de 2017 sobre a Classificação de Doenças e Condições Periodontais e Peri-Implantares. J Clin Periodontol 45(Supl 20):S68–S77. https://doi.org/10.1111/jcpe.12940
- Bertl K, Pandis N, Stopfer N, Haririan H, Bruckmann C, Stavropoulos A (2022) O impacto do status de “paciente com periodontite tratada com sucesso e estável” nos parâmetros de resultado relacionados ao paciente durante o cuidado periodontal de suporte a longo prazo. J Clin Periodontol 49:101–110. https://doi.org/10.1111/jcpe.13582
- Rattu V, Raindi D, Antonoglou G, Nibali L (2023) Prevalência de sujeitos com periodontite estável e tratada com sucesso e incidência de perda dentária subsequente dentro do cuidado periodontal de suporte: Uma revisão sistemática com meta-análises. J Clin Periodontol. https://doi.org/10.1111/jcpe.13835
- Donos N, Calciolari E, Brusselaers N, Goldoni M, Bostanci N, Belibasakis GN (2020) O uso adjunto de moduladores do hospedeiro na terapia periodontal não cirúrgica. Uma revisão sistemática de estudos clínicos randomizados controlados por placebo. J Clin Periodontol 47(Supl 22):199–238. https://doi.org/10.1111/jcpe.13232
- Herrera D, Matesanz P, Martín C, Oud V, Feres M, Teughels W (2020) Efeito adjunto de antimicrobianos administrados localmente na terapia da periodontite: uma revisão sistemática e meta-análise. J Clin Periodontol 47(Supl 22):239–256. https://doi.org/10.1111/jcpe.13230
- Calciolari E, Ercal P, Dourou M, Akcali A, Tagliaferri S, Donos N (2022) A eficácia das terapias periodontais adjuntas durante o cuidado periodontal de suporte em pacientes com bolsas residuais. Uma revisão sistemática e meta-análise. J Periodontal Res 57:671–689. https://doi.org/10.1111/jre.13001
- Wang CY, Yang YH, Li H et al (2020) Tratamentos locais adjuntos para pacientes com bolsas residuais durante o cuidado periodontal de suporte: Uma revisão sistemática e meta-análise em rede. J Clin Peri- odontol 47:1496–1510. https://doi.org/10.1111/jcpe.13379
- Bertl K, Bruckmann C, Isberg PE, Klinge B, Gotfredsen K, Stavropoulos A (2015) Hialuronano na terapia periodontal não cirúrgica e cirúrgica: uma revisão sistemática. J Clin Periodontol 42:236–246. https://doi.org/10.1111/jcpe.12371
- Eliezer M, Imber JC, Sculean A, Pandis N, Teich S (2019) Ácido hialurônico como adjunto à terapia periodontal não cirúrgica e cirúrgica: uma revisão sistemática e meta-análise. Clin Oral Investig 23:3423–3435. https://doi.org/10.1007/s00784-019-03012-w
- Karakostas P, Davidopoulou S, Kalfas S (2022) Uso de ácido hialurônico no tratamento de doenças periodontais: uma revisão sistemática. J Contemp Dent Pract 23:355–370
- Tan OL, Safii SH, Razali M (2021) Eficácia clínica de aplicações repetidas de entrega local de medicamentos e agentes adjuntos na terapia periodontal não cirúrgica: uma revisão sistemática. Antibiotics (Basel) 10:1178. https://doi.org/10.3390/antibiotics10101178
- Pilloni A, Rojas MA, Trezza C et al (2023) Efeitos clínicos do uso adjunto de gel à base de polinucleotídeos e ácido hialurônico na re-instrumentação subgengival de bolsas periodontais residuais: um ensaio clínico randomizado e de boca dividida. J Periodontol 94:354–363. https://doi.org/10.1002/JPER.22-0225
- Pilloni A, Zeza B, Kuis D et al (2021) Tratamento de bolsas periodontais residuais usando um gel à base de ácido hialurônico: um ensaio clínico randomizado multicêntrico de 12 meses com triplo cegamento. Antibiotics (Basel) 10:924. https://doi.org/10.3390/antibiotics10080924
- Schulz KF, Altman DG, Moher D, CONSORT G (2010) Declaração CON-SORT 2010: diretrizes atualizadas para relato de ensaios randomizados em grupo paralelo. PLoS Med 7:e1000251. https://doi.org/ 10.1371/journal.pmed.1000251
- Papapanou PN, Sanz M, Buduneli N et al (2018) Periodontite: Relatório de consenso do grupo de trabalho 2 do Workshop Mundial de 2017 sobre a Classificação de Doenças e Condições Periodontais e Peri-Implantares. J Clin Periodontol 45(Supl 20):S162–S170. https:// doi.org/10.1111/jcpe.12946
- Tonetti MS, Greenwell H, Kornman KS (2018) Estadiamento e graduação da periodontite: estrutura e proposta de uma nova classificação e definição de caso. J Clin Periodontol 45(Supl 20):S149– S161. https://doi.org/10.1111/jcpe.12945
- Armitage GC (2000) Desenvolvimento de um sistema de classificação para doenças e condições periodontais. Northwest Dent 79:31–35
- Hamp SE, Nyman S, Lindhe J (1975) Tratamento periodontal de dentes multirraiz. Resultados após 5 anos. J Clin Periodontol 2:126–135. https://doi.org/10.1111/j.1600-051x.1975.tb01734.x
- Asparuhova MB, Kiryak D, Eliezer M, Mihov D, Sculean A (2019) Atividade de duas preparações de hialuronano em fibroblastos orais humanos primários. J Periodontal Res 54:33–45. https://doi.org/10. 1111/jre.12602
- Fujioka-Kobayashi M, Müller HD, Mueller A et al (2017) Efeitos in vitro do ácido hialurônico em células do ligamento periodontal humano. BMC Oral Health 17:44. https://doi.org/10.1186/ s12903-017-0341-1
- Mueller A, Fujioka-Kobayashi M, Mueller HD et al (2017) Efeito do ácido hialurônico em mudanças morfológicas nas superfícies de dentina e efeito subsequente na sobrevivência, adesão e espalhamento das células do ligamento periodontal. Clin Oral Investig 21:1013–1019. https://doi.org/10.1007/s00784-016-1856-6
- Chen M, Li L, Wang Z, Li P, Feng F, Zheng X (2019) Ácido hialurônico de alto peso molecular regula a inflamação induzida por P. gingivalis e a migração em fibroblastos gengivais humanos via via de sinalização MAPK e NF-κB. Arch Oral Biol 98:75–80. https:// doi.org/10.1016/j.archoralbio.2018.10.027
- Dannewitz B, Zeidler A, Hüsing J et al (2016) Perda de molares em pacientes tratados periodontais: resultados 10 anos ou mais após terapia periodontal ativa. J Clin Periodontol 43:53–62. https:// doi.org/10.1111/jcpe.12488
- Graetz C, Schützhold S, Plaumann A et al (2015) Fatores prognósticos para a perda de molares - um estudo de coorte retrospectivo de 18 anos. J Clin Periodontol 42:943–950. https://doi.org/10.1111/jcpe.12460
- Graetz C, Plaumann A, Schlattmann P et al (2017) Retenção dental a longo prazo na periodontite crônica - resultados após 18 anos de um regime de tratamento periodontal conservador em um ambiente universitário. J Clin Periodontol 44:169–177. https://doi.org/10.1111/jcpe.12680
- Matuliene G, Pjetursson BE, Salvi GE et al (2008) Influência de bolsas residuais na progressão da periodontite e perda dentária: resultados após 11 anos de manutenção. J Clin Periodontol 35:685– 695. https://doi.org/10.1111/j.1600-051X.2008.01245.x
- Salvi GE, Mischler DC, Schmidlin K et al (2014) Fatores de risco associados à longevidade de dentes multirraiz. Resultados a longo prazo após terapia periodontal ativa e de suporte. J Clin Periodontol 41:701–707. https://doi.org/10.1111/jcpe.12266
- Ariel H, Kahn A, Hila ZO, Anton S, Natan G, Kolerman R (2022) Um gel termossensível com um ingrediente ativo de ácido hialurônico que contém um sistema de preservação de octenidina como adjunto à raspagem e alisamento radicular: um estudo clínico prospectivo randomizado. Clin Oral Investig 26:3721–3733. https://doi.org/10.1007/s00784-021-04344-2
- Mohammad CA, Mirza BA, Mahmood ZS, Zardawi FM (2023) O efeito do gel de ácido hialurônico nos parâmetros periodontais, citocinas pró-inflamatórias e marcadores bioquímicos em pacientes com periodontite. Gels 9:325. https://doi.org/10.3390/gels9040325
- Olszewska-Czyz I, Kralik K, Prpic J (2021) Biomoléculas em aplicações dentais: ensaio clínico randomizado controlado avaliando a influência da terapia adjunta com ácido hialurônico nos parâmetros clínicos de periodontite moderada. Biomolecules 11:1491. https://doi.org/10.3390/biom11101491
- Ramanauskaite E, Machiulskiene V, Shirakata Y, Dvyliene UM, Nedzelskiene I, Sculean A (2023) Avaliação clínica de hipoclorito de sódio/aminoácidos e ácido hialurônico reticulado como adjunto ao tratamento periodontal não cirúrgico: um ensaio clínico randomizado controlado. Clin Oral Investig. https://doi.org/10.1007/ s00784-023-05271-0
- Jentsch HFR, Roccuzzo M, Pilloni A, Kasaj A, Fimmers R, Jepsen S (2021) Aplicação sem retalho de derivado da matriz de esmalte em retratamento periodontal: um ensaio de viabilidade randomizado multicêntrico. J Clin Periodontol 48:659–667. https://doi.org/10.1111/jcpe.13438
- Radulescu V, Boariu MI, Rusu D et al (2022) Efeitos clínicos e microbiológicos de uma única aplicação de gel de hipoclorito de sódio durante a re-instrumentação subgengival: um ensaio clínico randomizado placebo-controlado triplo-cego. Clin Oral Investig 26:6639–6652. https://doi.org/10.1007/s00784-022-04618-3
- Diehl D, Friedmann A, Liedloff P, Jung RM, Sculean A, Bilhan H (2022) Aplicação adjunta de ácido hialurônico em combinação com um gel de hipoclorito de sódio para tratamento não cirúrgico de bolsas residuais reduz a necessidade de cirurgia periodontal - análise retrospectiva de uma série de casos clínicos. Materials (Basel) 15:6508. https://doi.org/10.3390/ma15196508
- Costa FO, Costa AM, Cortelli JR et al (2023) Efeito do controle de placa supragengival na periodontite recorrente e estabilidade clínica entre indivíduos sob terapia de manutenção periodontal: acompanhamento de 10 anos. J Periodontol 94:55–65. https://doi.org/10. 1002/JPER.22-0301
- Tomasi C, Koutouzis T, Wennström JL (2008) Doxiciclina administrada localmente como adjunto à desbridamento mecânico no retratamento de bolsas periodontais. J Periodontol 79:431–439. https:// doi.org/10.1902/jop.2008.070383
- Ramseier CA, Nydegger M, Walter C et al (2019) Tempo entre visitas de recall e profundidades de sondagem residuais preveem estabilidade a longo prazo em pacientes inscritos em terapia periodontal de suporte. J Clin Periodontol 46:218–230. https://doi.org/10.1111/jcpe.13041
