Variação Genética em Drosófilas Havaianas. IV. Similaridade Alozimática Entre D. Silvestris e D. Heteroneura da Ilha do Havai
Tradução automática
O artigo original está escrito em EN language (link para lê-lo) .
Resumo
As espécies são endêmicas da mais nova ilha do arquipélago e são amplamente simpátricas. Elas são facilmente distinguidas morfologicamente em ambos os sexos. Usando procedimentos eletroforéticos padrão, examinamos 25 locos que codificam para proteínas estruturais de 539 silvestris e 325 heteroneura coletados em três localidades amplamente separadas onde as duas espécies são simpátricas. Comparações pareadas dentro e entre as espécies mostram os seguintes coeficientes de identidade genética (I de Nei): dentro de silvestris 0.961 ± 0.01; dentro de heteroneura 0.949 ± 0.02; entre silvestris e heteroneura, 0.939 ± 0.01. Nem as diferenças dentro nem entre as espécies são significativas. Não há diferenças alélicas fixas nem dentro nem entre as espécies. Nas três áreas de simpatria, as espécies mostram diferenças de frequência gênica P < 0.05) em 9, 11 e 13 locos, respectivamente. Isso não é muito diferente da variação dentro de qualquer uma das espécies nas três localidades. As duas espécies têm níveis de heterozigosidade semelhantes (H) (silvestris, 0.083; heteroneura, 0.089) e percentagem de locos polimórficos (ambos 0.37). Sugere-se que, apesar de sua divergência morfológica, essas espécies são muito mais recentemente formadas do que as espécies irmãs clássicas. Diferenças alozímicas significativas podem não ter tido tempo para se acumular.
DROSOPHILA silvestris e D. heteroneura são um par de espécies gigantes intimamente relacionadas, endêmicas apenas nas florestas tropicais da ilha do Havai, a mais nova do arquipélago. Elas são simpátricas na maioria das áreas, exceto em altitudes mais elevadas, onde as populações tendem a ser exclusivamente silvestris.
As espécies são facilmente distinguidas morfologicamente (Hardy 1965), não apenas pela extraordinária cabeça larga em ambos os sexos de heteroneura, mas também pelos padrões de cor do rosto, tórax, pleuras e abdômen, além das diferenças no padrão das marcas das asas. D. silvestris possui seis inversões únicas em estado polimórfico; uma sétima inversão é polimórfica em ambas as espécies (Carson e Stalker 1968; Craddock e Carson 1975). Não há inversões fixas entre as espécies, e as duas compartilham um conjunto comum de sequências padrão, ou seja, são cromossomicamente homosequenciais.
Embora haja um forte isolamento sexual entre as espécies em cruzamentos laboratoriais (Ahearn et al. 1974; Kaneshiro 1976), híbridos F1 foram obtidos a partir de ambos os cruzamentos recíprocos (Craddok 1974; Ahearn e Val 1975). Ambos os sexos desses híbridos F1 são totalmente férteis e a segregação genética das diferenças morfológicas das espécies foi observada na geração F1 e em retrocruzamentos (Val 1976).
Estudos preliminares de alozimas mostraram uma semelhança extraordinária entre as duas espécies (S = 0.96; Johnson et al. 1975; Johnson e Carson 1975). O presente artigo amplia o estudo da variabilidade genética dentro e entre as duas espécies para proteínas solúveis codificadas por 25 locos. Os dados são de três áreas de simpatria. Os resultados confirmam a notável semelhança bioquímica das espécies, apesar das diferenças genéticas entre elas em morfologia, inversões e comportamento.
Materiais e métodos
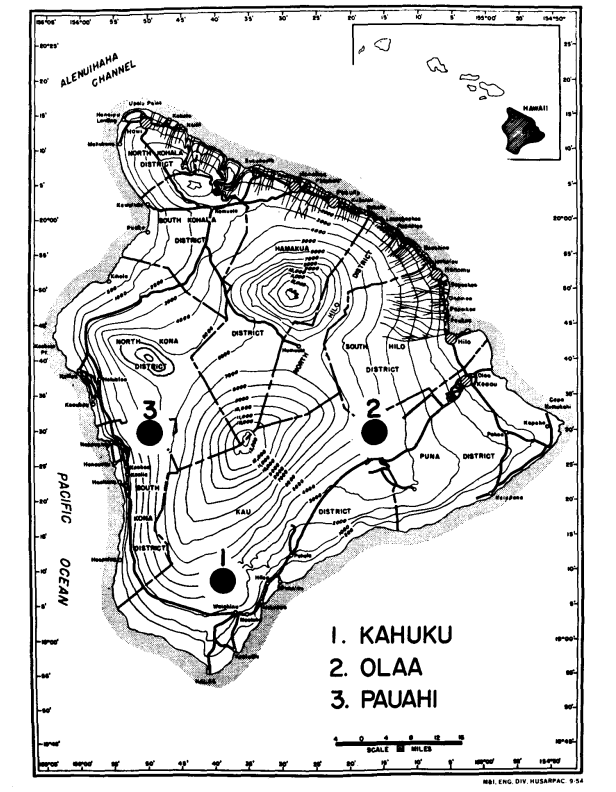
Em 1974 e 1975, coletamos as duas espécies de três áreas de elevação moderada no Havai (A Grande Ilha) onde são simpátricas. Estas são (Figura 1): (1) Kahuku Ranch na parte sul do Distrito de Kau, (elevação 1158 m); (2) Olaa, floresta perto da Estação Experimental do Vulcão na Wright Road, Distrito de Puna (elevação 1238 m) e (3) Pauahi, Distrito de South Kona (elevação 1311 m). Machos recém-capturados foram usados para eletroforese assim que possível após a captura. As fêmeas foram isoladas e permitidas a produzir prole F1 para uso em preparações de glândulas salivares. Após a produção de larvas, as mães foram usadas para eletroforese. Somente o abdômen das moscas foi submetido à eletroforese; o restante (cabeça, tórax e apêndices) foi montado e colocado em uma coleção para ser usado em análises morfológicas.
Após a remoção, o abdômen foi congelado durante a noite e, em seguida, homogeneizado individualmente em 0,05 ml de água destilada deionizada e cada sobrenadante absorvido por quatro fitas de papel filtro Whatman No. I (1 X 0,2 cm). Essas fitas foram então separadas e aplicadas a quatro géis de amido horizontais combinando diferentes sistemas de tampão. Após a eletroforese, cada gel foi cortado horizontalmente quatro ou cinco vezes, e essas fatias foram coradas separadamente para uma ou mais das 25 enzimas. Todo o trabalho foi realizado usando Electrostarch lote 303 a 12% de concentração.
As três combinações de tampão utilizadas no estudo são as seguintes: Sistema de Tampão A = Tampão de gel: pH 8.9, 0.0076 m Tris, 0.005 m citrato; Tampão de eletrodos: pH 8.7, 0.269 m borato, 0.1 m hidróxido de sódio. Sistema de Tampão C = Tampão de gel: pH 8.1, 0.074 m Tris, 0.008 m citrato; Tampão de eletrodos: pH 8.1, cátodo = 0.343 m Tris, 0.079 m citrato; ânodo = 0.458 m Tris, 0.0104 m citrato. Sistema de Tampão JRP = Tampão de gel: pH 7.0, 0.009 m Tris, 0.003 m citrato; tampão de eletrodo: 0.135 m Tris, 0.040 m citrato. Todos esses tampões e os métodos de coloração utilizados são semelhantes aos descritos por Steiner e Johnson (1973) e Ayala et al. (1972; 1974a).
Os alelos em um determinado locus foram numerados de acordo com as mobilidades relativas de seus alozimas nos sistemas de tampão eletroforético especificados. O alelo que produziu o alozima mais frequente foi designado como l.00 e os alelos correspondentes a bandas que migraram mais rapidamente ou mais lentamente foram arbitrariamente atribuídos valores indicativos de suas respectivas mobilidades.
O tampão utilizado e a notação para cada enzima são os seguintes: Sistema de Tampão A : Esterase (EST, 1 lócus) ; Fosfatase Alcalina (AP, 1 lócus) ; Fosfatase Ácida (ACPH, 1 lócus) ; Transaminase Glutamato Oxaloacetato (GOT, 2 lócus) ; Aldeído Oxidase (AO, 1 lócus) ; Desidrogenase de Octanol (ODH, I lócus) ; Desidrogenase de Álcool (ADH, 1 lócus) ; Desidrogenase de Xantina (XDH, 1 lócus) ; Aminopeptidase de Leucina (LAP, 2 lócus) ; Desidrogenase de Glicerolde-3-Fosfato (G-3-PDH, 1 lócus). Sistema de Tampão C : Enzima Málica (ME, 1 lócus) ; Desidrogenase de Malato (MDH, 2 lócus) ; Desidrogenase de α-Glicerofosfato (α-GPDH, 1 lócus) ; Fosfoglucomutase (PGM, I lócus) ; Fumarase (FUM, 1 lócus) ; Desidrogenase de Sorbitol (SDH, 1 lócus) ; Hexocinase (HK, 2 lócus) ; Desidrogenase de Isocitrato (IDH, 1 lócus). Sistema de Tampão JRP : Desidrogenase de 6-Fosfogluconato (6-PGDH, 1 lócus) ; Desidrogenase de Hidroxibutirato (HBDH, 1 lócus) ; Isomerase de Fosfoglucose (PGI, 1 lócus).
Resultados
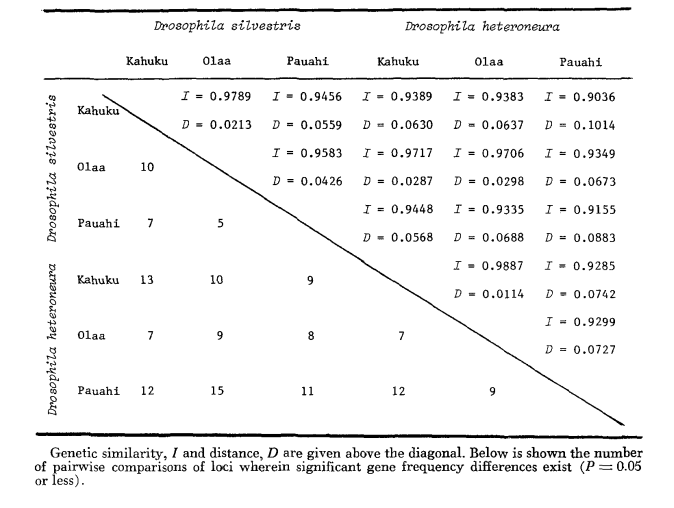
Os dados básicos de alozima são apresentados na Tabela 1. A Tabela 2 mostra os resultados do uso dos dados na Tabela 1 para calcular os coeficientes de similaridade genética, I, e distância, D (Nei 1972) de forma pareada dentro e entre as espécies. Na mesma tabela (abaixo da diagonal) estão mostrados o número de locos que exibem diferenças na frequência gênica (P ≤ 0,05) em comparações pareadas. O cálculo foi feito, usando χ2, utilizando a frequência do alelo mais comum contra uma frequência agrupada dos outros alelos. A correção de Yates foi utilizada.
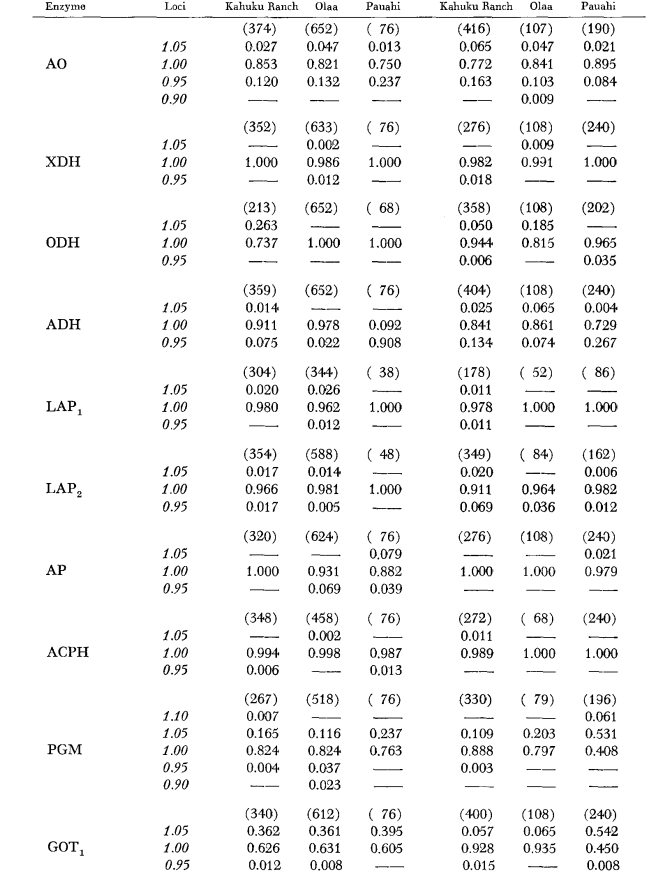
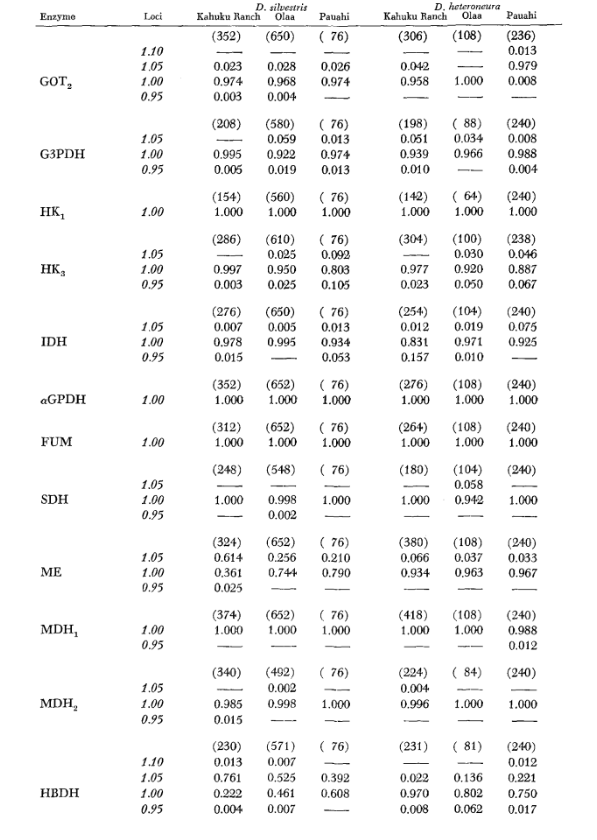
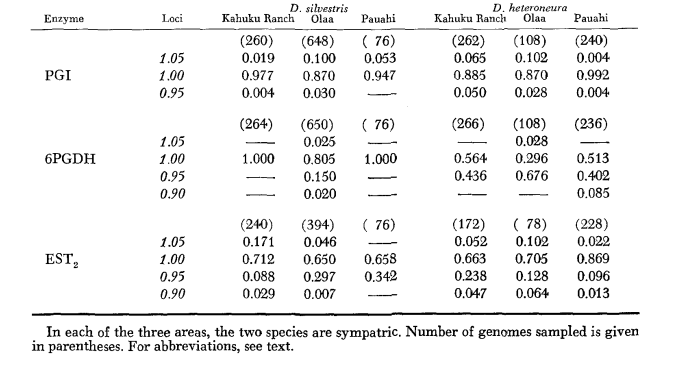
Os níveis médios de heterozigosidade e as estimativas da frequência de locos polimórficos estão apresentados na Tabela 3. Uma representação gráfica da frequência do alelo 1.0 para cada alozima em cada população é apresentada na Figura 2.
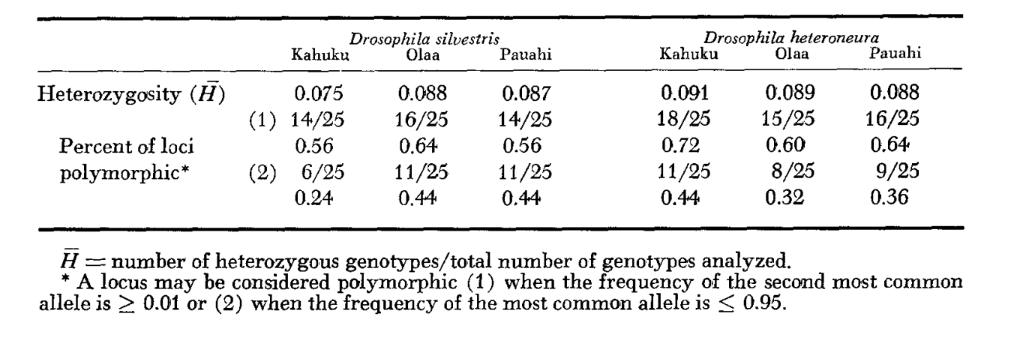
A similaridade alozímica é muito grande tanto dentro quanto entre as espécies, seja medida por coeficientes de similaridade ou por diferenças na frequência gênica (veja o resumo na Tabela 4). Não há diferenças alélicas fixas, nem dentro nem entre as espécies. Nas três áreas de simpatria, as espécies mostram diferenças na frequência gênica (P = 0.05) em 9, 11 e 13 locos, respectivamente. Isso não é muito diferente da variação dentro de uma ou outra das espécies nas três localidades (silvestris: 5, 7, 10; heteroneura: 7, 9, 12). As duas espécies têm níveis de heterozigosidade semelhantes (silvestris 0.083; heteroneura 0.089) e percentagem de locos polimórficos (ambos 0.37).

Alguns detalhes são de interesse. A semelhança entre as espécies é menor em Pauahi (Tabela 2; Figura 2). A inspeção mostra que isso se deve principalmente às diferenças de frequência em ADH e GOT2. Grandes diferenças nesses loci aparecem entre as espécies apenas nesta área; ou seja, o alelo 1.00 GOT2 é baixo apenas em Pauahi heteroneura e o alelo 1.00 de ADH é baixo apenas em Pauahi silvestris (Tabela 1; Figura 2).
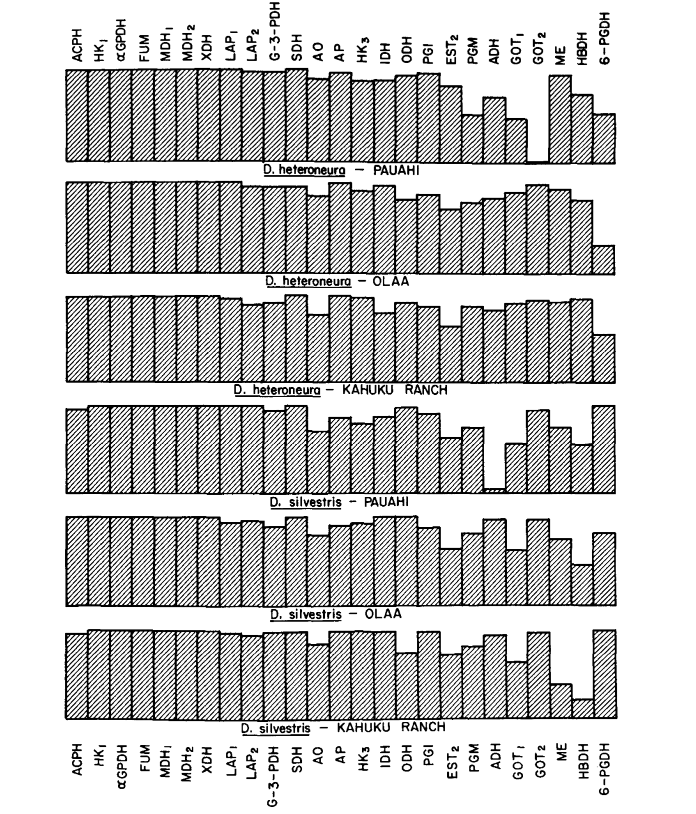
A semelhança entre as espécies é um pouco maior na área de Kahuku. Aqui, as diferenças envolvem principalmente GOT1, ME e HBDH. Em Olaa, a semelhança entre as espécies é a maior. GOT1 e HBDH novamente mostram diferenças, embora não sejam tão grandes quanto aquelas entre as espécies em Kahuku.
Discussão
Comparações genéticas de populações usando alozimas inundaram a literatura nos últimos dez anos (veja as revisões de Ayala 1975 e Powell 1975). Como as proteínas estudadas e os métodos eletroforéticos utilizados têm sido, em geral, semelhantes, os achados de táxons bastante distintos podem ser comparados de forma útil. Por exemplo, a similaridade genética entre duas espécies de lagartos, quando reduzida a um coeficiente como o de Nei, pode ser comparada diretamente com dados semelhantes de pares de espécies de camundongos, plantas ou Drosophila.
Em seu artigo seminal, Lewontin e Hubby (1966) apontaram uma série de razões pelas quais os métodos eletroforéticos padrão tendem a subestimar a variabilidade genética e a diferença genética. Isso deve ser levado em consideração ainda mais hoje devido ao recente desenvolvimento da análise eletroforética sequencial. Assim, Singh, Lewontin e Felton (1976) e Coyne (1976) mostraram que, para o locus da xantina desidrogenase de D. pseudo-obscura e persimilis, o número de alelos em amostras naturais bastante pequenas dessas espécies é pelo menos quatro vezes maior do que o número revelado pelos métodos padrão. No que diz respeito às comparações entre populações, esses novos métodos parecem certos em reduzir as similaridades observadas em todos os níveis de diferenciação populacional (por exemplo, populações locais, subespécies, semiespécies, espécies).
Apesar desses novos desenvolvimentos, comparações baseadas nos métodos padrão continuam a ser valiosas se suas limitações forem reconhecidas. D. silvestris e heteroneura são muito mais próximas alozimicamente do que qualquer outro par de espécies de Drosophila já examinado, incluindo todos os pares de espécies "irmãs", subespécies e semiespécies (Ayala et al. 1974b). De fato, os coeficientes de similaridade para populações dentro de silvestris ou heteroneura são da mesma ordem de magnitude que aqueles entre as mesmas duas espécies. As pequenas diferenças que existem entre pares de populações das duas espécies, além disso, não são as mesmas nas três áreas estudadas; ou seja, não envolvem os mesmos loci ou alelos.
Como discutido na introdução, continuamos a reconhecer essas duas entidades como boas espécies biológicas. Elas são morfologicamente distintas, amplamente simpátricas, isoladas comportamentalmente e diferentes em seus polimorfismos cromossômicos. As diferenças morfológicas dependem de aproximadamente quatorze poligenes (Val 1976).
Uma característica marcante e importante dessas espécies, no entanto, é o fato de que híbridos recíprocos, obtidos em laboratório, são totalmente férteis em ambos os sexos (Craddock 1974; Ahearn e Val 1975). Assim, a hibridação natural deve ser considerada. Embora nenhuma evidência para isso tenha sido encontrada por Craddock (1974), Kaneshiro e Val (1977) relataram que aproximadamente dois por cento das moscas selvagens capturadas no Kahuku Ranch podem ser identificadas como híbridos por meios morfológicos. Esta é a mesma região onde híbridos naturais entre duas outras espécies foram encontrados (Carson, Nair e Sene 1975). A análise morfométrica da forma da cabeça tem sido usada com sucesso para especificar a paternidade recíproca exata de certos indivíduos híbridos F1. Em um caso, uma fêmea D. silvestris capturada na natureza produziu prole composta inteiramente por híbridos F1. Como cada fêmea selvagem foi isolada imediatamente de todos os machos na captura, é claro que os acasalamentos relevantes ocorreram na natureza. Deve-se enfatizar que o histórico de extensos estudos morfométricos de híbridos de laboratório (Val 1976) preparou o terreno para essas novas observações naturais e, assim, o diagnóstico desses casos repousa em evidências comparativas sólidas. Todos os indivíduos híbridos naturais foram excluídos dos dados eletroforéticos apresentados neste artigo.
Um fato ainda mais que acrescenta à situação incomum em relação a essas espécies é sua estreita semelhança ecológica. Ambas foram criadas a partir do mesmo caule em decomposição do planta hospedeira comum, Clermontia. Ambas, igualmente, formam seus leks em lugares muito semelhantes, de modo que machos e fêmeas de ambas as espécies interagem na natureza.
Qual é a razão para a grande semelhança alozimática dessas espécies? Duas possibilidades se apresentam. Primeiro, quando a divergência entre as espécies ocorreu originalmente, pode ter sido acompanhada por uma certa quantidade de divergência eletroforética. As semelhanças atualmente observadas exigiriam, assim, que tais diferenças fossem erosionadas pela hibridização introgressiva subsequente à especiação. Uma segunda visão sustenta que apenas mudanças eletroforéticas menores acompanharam os eventos de especiação em primeiro lugar. Isso pode estar correlacionado com a considerável proximidade ecológica.
Nós favorecemos a segunda visão por uma série de razões. As duas espécies são mais semelhantes em Olaa. No entanto, evidências fortes de hibridização recente foram obtidas apenas para Kahuku, onde as espécies são mais distantes alozimaticamente. Em Kahuku, além disso, as populações naturais não apresentam evidências de formar um “cardume híbrido” semelhante à ampla recombinação genética observada em cruzamentos de laboratório. De fato, a introgressão entre as espécies provavelmente está ocorrendo, mas pode estar restrita a um espectro genotípico estreito pela seleção natural. Assim, apenas genes de importância biológica menor (o “sistema aberto”, Carson 1975) podem ser capazes de fluir através da barreira das espécies. Por outro lado, outros genes podem marcar ou ser uma parte funcional de um sistema fechado de equilíbrios epistáticos único para uma ou outra das espécies. A seleção pode, assim, servir para inibir a ruptura de tal “sistema fechado” (Carson 1975).
Devido à novidade geológica da ilha do Havai, somos tentados a sugerir que D, silvestris e D. heteroneura podem realmente ter se formado recentemente no tempo. Essa circunstância pode ser a causa primária da similaridade eletroforética das duas espécies. De fato, elas podem ser muito mais novas do que os clássicos pares de espécies "irmãs" (veja Carson 1976b). Assim como em outras aparentes neoespécies, (por exemplo Gottlieb 1974; Turner 1974; Avise, Smith e Ayala 1975), a diferenciação alozímica tem sido relativamente leve. De fato, existe a possibilidade de que a diferença alozímica possa simplesmente correlacionar-se com o tempo decorrido desde o evento cladístico que separou as duas entidades comparadas (Avise, Smith e Ayala 1975; Carson 1976a). Diferenças morfológicas, por outro lado, podem servir como melhores indicadores dos efeitos subjacentes dos genes reguladores que caracterizam as importantes diferenças genéticas entre espécies recém-formadas.
Autores: F. M. Sene, H. L. Carson
Literatura citada:
- Ahearn, J. N., H. L. Carson, Th. Dobzhansky e K. Y. Kaneshiro, 1974 Isolamento etológico entre três espécies do subgrupo planitibia de Drosophila havaiana. Proc. Natl. Acad. Sci. U.S. 71: 901—903.
- Ahearn, J. N. e F. C. Val, 1975 Híbridos interespecíficos férteis de duas Drosophila havaianas simpátricas. Genetics 80: s9.
- Avise, J. C., J. J. Smith e F. J. Ayala, 1975 Diferenciação adaptativa com pouca mudança gênica entre dois minnow nativos da Califórnia. Evolution '29: 411—426.
- AYALA, F. J., 1975 Diferenciação genética durante o processo de especiação. Evolutionary Biology 8: 1—78.
- Ayala, F. J., J. R. Powell, M. L. Tracey, C. A. Mourão e S. Pérez-Salas, 1972 Variabilidade enzimática no grupo Drosophila willistoni. IY Variação gênica em populações naturais de Drosophila willistoni. Genetics 70: 113—139.
- Ayala, F. J., M. L. Tracey, L. G. Barr e J. G. Ehrenfeld, l9f4a Diferenciação genética e reprodutiva da subespécie, Drosophila equinoxialis caribbensis. Evolution 28: 24—41.
- Ayala F. J., M. L. Tracey, D. Hedgecock e R. C. Richmond, 1974b Diferenciação genética durante o processo de especiação em Drosophila. Evolution 28: 576—592.
- Carson, H. L. 1975 A genética da especiação no nível diploide. Am. Naturalist 109: 83—92, 1976a Inferência do tempo de origem de algumas espécies de Drosophila. Nature 259: 395—396, 1976b Diferenças genéticas entre espécies recém-formadas. Bioscience 26: 700—701.
- Carson, H. L., P. S. Nair e F. M. Sene, 1975 Híbridos de Drosophila na natureza: Prova de troca de genes entre espécies simpátricas. Science 189: 806—807.
- Carson, H. L. e H. D. Stalker, 1968 Relações de cromossomos politénicos em espécies havaianas de Drosophila. II. O subgrupo D. planitibia. Univ. Texas Publ. 6818: 355-365.
- Coyne, J. A., 1976 Falta de similaridade gênica entre duas espécies irmãs de Drosophila conforme revelado por técnicas variadas. Genetics 84: 593—607.
- Craddock, E. M., 1974 Relações reprodutivas entre espécies homosequenciais de Drosophila havaiana. Evolution 28: 593—606.
- Craddock, E. M. e H. L. Carson, 1975 Variabilidade cromossômica em uma espécie endêmica de Drosophila havaiana. Genetics 80: s23.
- Gottlieb, L. D., 1974 Confirmação genética da origem de Clarkia lingulata. Evolution 2B: 244-250.
- Hardy, D. E., 1965 insetos do Havai, Vol. 12. p. 814. University of Hawaii Press, Honolulu.
- Johnson, W. E. e H. L. Carson, 19f5 Variação alozímica em Drosophila silvestris. Genetics 80: s46.
- Johnson, W. E., H. L. Carson, K. Y. Kaneshiro, W. W. M. Steiner e M. M. Cooper, 1975 Variação genética em Drosophila havaiana. II. Diferenciação alozímica no subgrupo D. planitibia. pp. 563—584. In: Isozymes IV. Genetics and Evolution. Editado por C. L. Markert. Academic Press, New York.
- Kaneshiro, K. Y., 1976 Isolamento etológico e filogenia no subgrupo planitibia de Drosophila havaiana. Evolution 30: 740-745.
- Kaneshiro, K. Y. e F. C. Val, l977 Hibridação natural entre um par simpátrico de Drosophila havaiana. Am. Naturalist (em imprensa).
- Lewontin, R. C. e J. L. Hubby, 1966 Uma abordagem molecular para o estudo da heterozigosidade gênica em populações naturais. II. Quantidade de variação e grau de heterozigosidade em populações naturais de Drosophila pseudoobscura. Genetics 54: 595—609.
- Nei, M., 1972 Distância genética entre populações. Am. Naturalist 106: 283—292.
- Powell, I. R., 1975 Variação proteica em populações naturais de animais. Evol. Biol. 8: 79-113.
- Simon, R. S., R. C. LEWONTin e A. A. Fzczou, 19 Z6 Heterogeneidade genética dentro de “alelos” eletroforéticos de desidrogenase de xantina em Drosophila pseudoobscura. Genetics 84: 609—629.
- Steiner, W. W. M. e W. E. Johnson, 1973 Técnicas para eletroforese de Drosophila havaiana. US/IBP Island Ecosystems IRP. Tech. Report 30: ii + 21 pp.
- Turner B. J., 1974 Divergência genética das espécies de peixes-pupfish do Death Valley: Evidência bioquímica versus morfológica. Evolution fl8: 281-294.
- Val, F. C., 1976 Genética das diferenças morfológicas entre duas espécies de Drosophila interfertéis. Genetics 83: s78.