Eficácia da terapia de macrolídeos em baixa dose a longo prazo na prevenção da recorrência precoce de pólipos nasais após cirurgia endoscópica dos seios paranasais.
Tradução automática
O artigo original está escrito em EN language (link para lê-lo) .
Contexto: Este estudo avaliou a eficácia da terapia com macrolídeos “a longo prazo” com claritromicina como um complemento à terapia de manutenção com corticosteroides nasais para prevenir a recorrência de pólipos nasais (PN) após a cirurgia endoscópica funcional dos seios paranasais (FESS).
Métodos: Um total de 66 pacientes com rinossinusite crônica e PN bilaterais foram randomizados em 3 grupos de estudo, com 22 pacientes em cada grupo. Após a FESS, os pacientes nos primeiros e segundos grupos foram tratados com claritromicina 250 mg/dia por 12 e 24 semanas, respectivamente, enquanto os pacientes no terceiro grupo não receberam claritromicina. Pacientes em todos os 3 grupos receberam terapia de manutenção com furoato de mometasona 400 μg/dia. A avaliação dos pacientes foi realizada antes da cirurgia e 6, 12 e 24 semanas após a cirurgia, utilizando uma escala analógica visual (EAV), o Teste de Resultado SinoNasal de 20 itens (SNOT-20), rinometria acústica, rinomanometria, tempo de trânsito de sacarose, endoscopia nasal, tomografia computadorizada (TC) dos seios paranasais e medição do nível de proteína catiônica eosinofílica (ECP) em suas secreções nasais.
Resultados: O estudo confirmou a eficácia da terapia com macrolídeos “a longo prazo”, resultando em uma melhora significativa de todos os parâmetros, exceto na rinometria acústica e na VAS em ambos os grupos de claritromicina em comparação com o controle. A concentração de ECP nas secreções nasais aumentou dramaticamente após a cirurgia, retornando aos níveis basais após 12 e 24 semanas de tratamento com claritromicina. No grupo controle, o nível de ECP continuou a aumentar e foi significativamente mais alto no ponto final. Ambos os grupos com claritromicina mostraram escores endoscópicos e de TC significativamente melhores do que o grupo controle no ponto final.
Conclusão: A claritromicina “a longo prazo” em baixa dose de 250 mg/dia é capaz de controlar a inflamação eosinofílica e prevenir a recaída precoce de NP após FESS 2014 ARS-AAOA, LLC.
A rinossinusite crônica (CRS) frequentemente ocorre em associação com pólipos nasais (NP). Em um estudo, a CRS com NP (CRSwNP) foi diagnosticada em 4% de toda a população e está associada à asma brônquica (BA) em 7% a 13% dos casos. Além disso, a doença respiratória exacerbada por aspirina (AERD) e NP estão presentes em um grande número de pacientes (variando de 36% a 96%). Na CRSwNP, a célula inflamatória predominante é o eosinófilo, que é encontrado tanto no tecido quanto no muco das vias aéreas em quase todos os pacientes com CRSwNP. Embora o papel da infecção (inflamação neutrofílica) tenha sido investigado, não parece ser um fator primário no desenvolvimento da CR-SwNP, embora a CRSwNP esteja associada à BA. A alergia parece ser uma condição comórbida e não um fator primário no desenvolvimento da CRSwNP. No momento, nem o tratamento médico nem o cirúrgico podem garantir controle permanente ou cura duradoura. Atualmente, o único tratamento comprovado para o controle eficaz da CRSwNP são sprays nasais esteroides tópicos com ou sem glucocorticoides sistêmicos (GCS). A CRSwNP recorrente nem sempre é prevenida mesmo com GCS sistêmicos e os efeitos colaterais podem ser graves, incluindo cataratas e colapso vertebral. Como o controle da doença pode ser difícil mesmo com GCS sistêmicos, decidimos estudar o tratamento com terapia “a longo prazo” (3-6 meses ou mais) usando antibióticos macrolídeos em baixa dose. Aparentemente, são as propriedades não antimicrobianas dos macrolídeos (eritromicina, roxitromicina, claritromicina) que contribuem para seus efeitos anti-inflamatórios, que incluem a inibição da inflamação tanto neutrofílica quanto eosinofílica. Os macrolídeos são capazes de modular a resposta imunológica, inibir o crescimento de pólipos, destruir biofilmes e aumentar as propriedades protetoras da mucosa das vias respiratórias.
A eficácia dos macrolídeos em pacientes com CRS sem NP foi confirmada; no entanto, sua eficácia em pacientes com CRSwNP não foi investigada de forma abrangente. Portanto, nosso estudo controlado randomizado prospectivo foi projetado para avaliar a eficácia e segurança de um tratamento prolongado (3 e 6 meses) com claritromicina em baixa dose em pacientes com CRSwNP após cirurgia endoscópica funcional dos seios paranasais (FESS).
Pacientes e métodos
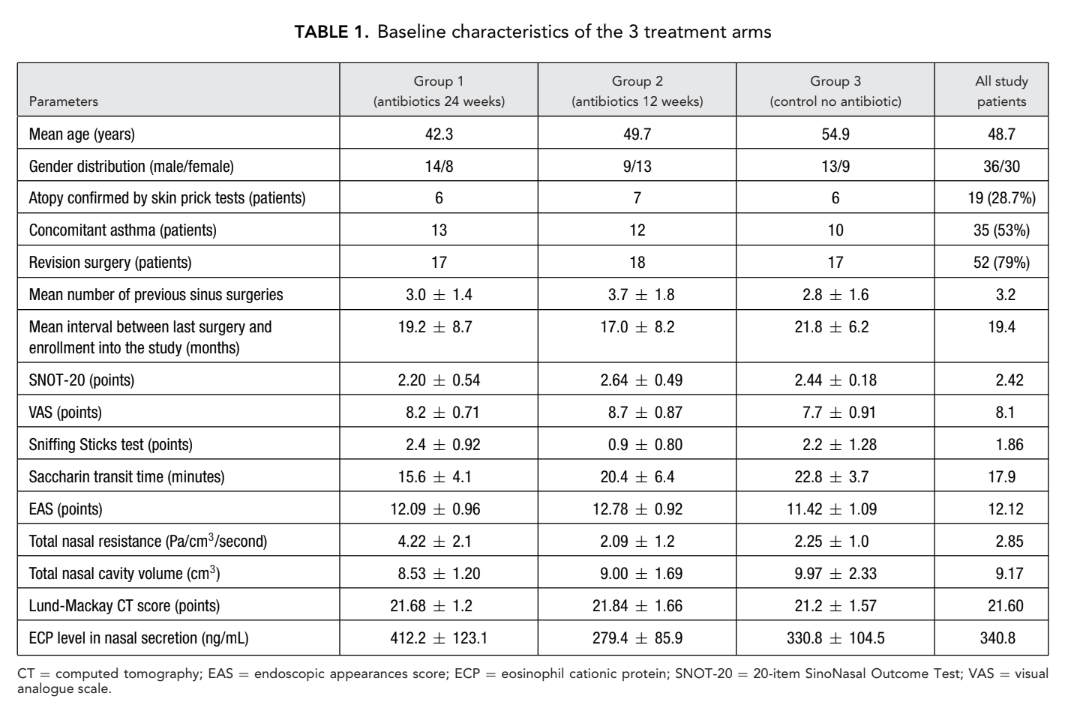
No total, 66 pacientes (36 homens e 30 mulheres) com idades entre 18 e 77 (média, 48,7) anos com CRSwNP bilateral confirmada por endoscopia foram recrutados. O período do estudo foi de janeiro de 2008 a março de 2011. Todos os 66 pacientes foram aleatoriamente designados (sistema de envelope selado) para 1 de 3 grupos de estudo (22 pacientes por grupo) da seguinte forma: grupo 1 (antibióticos por 24 semanas); grupo 2 (antibióticos por 12 semanas); e grupo 3 (controle, sem antibióticos).
Todos os 3 grupos receberam spray nasal esteroide tópico (furoato de mometasona), 400 μg/dia por 24 semanas após a FESS. O antibiótico macrolídeo utilizado nos grupos 1 e 2 foi a claritromicina 250 mg/dia (Klacid; Abbott Laboratories, Abbott Park, Illinois, EUA). A maioria dos pacientes (79%) havia realizado pelo menos 1 cirurgia anterior nos seios sem sucesso a longo prazo; o número médio de cirurgias anteriores em todos os 66 pacientes foi de 3,2 (Tabela 1).
Os critérios de exclusão incluíram o seguinte: CR-SwNP unilateral, intolerância a macrolídeos, uso de esteroides sistêmicos, gravidez, lactação e doenças somáticas graves. Excluímos todos os pacientes que estavam em uso de esteroides sistêmicos porque na Rússia, a terapia com esteroides sistêmicos é reservada apenas para pacientes com BA grave. Seria antiético interromper os esteroides sistêmicos nesses pacientes com BA; além disso, os esteroides sistêmicos poderiam ter um impacto negativo na confiabilidade dos resultados do nosso estudo. O Comitê de Ética da Primeira Universidade Estatal de Medicina de Moscovo Sechenov exigiu que todos os pacientes em todos os 3 grupos mantivessem o uso de esteroides nasais tópicos após a FESS, caso contrário, o NP pode reaparecer rapidamente.
Após a recrutamento, todos os 66 pacientes foram submetidos a FESS bilateral realizado pelo mesmo cirurgião (autor sênior Lopatin A.). Os pacientes do grupo 1 (antibióticos por 24 semanas) e do grupo 2 (antibióticos por 12 semanas) iniciaram a terapia de longo prazo com claritromicina 250 mg/dia no primeiro dia pós-operatório e durante 24 semanas (6 meses) ou 12 semanas (3 meses), respectivamente. No 7º dia após a cirurgia, todos os pacientes iniciaram a terapia de manutenção com spray nasal de furoato de mometasona (Nasonex, MSD, Merck & Co., Inc., NJ, EUA) 400 μg/dia por um total de 6 meses, incluindo os pacientes do grupo 3 (controle sem antibióticos). O Comitê de Ética aprovou o protocolo final do estudo, com todos os 66 pacientes inscritos assinando os formulários de consentimento.
Os pacientes foram cuidadosamente acompanhados e vistos em 6 semanas, 12 semanas e 24 semanas após a FESS (Fig. 1). Os resultados do tratamento foram baseados na avaliação dos seguintes testes.
Teste de Resultado SinoNasal de 20 itens (SNOT-20) O Teste de Resultado SinoNasal de 20 itens (SNOT-20) é um questionário para avaliar a qualidade de vida (QoL) em pacientes com rinossinusite.
Escala analógica visual
A gravidade da doença foi avaliada pela avaliação subjetiva dos pacientes na escala analógica visual (EAV) de 10 cm; 1 cm na escala refletia 1 ponto da avaliação do paciente; 0 a 3 pontos correspondiam a doença leve, 3 a 7 pontos correspondiam a doença moderada, e 7 a 10 pontos correspondiam a doença grave.
Teste olfativo
O “teste Sniffin Sticks,” versão estendida (Burghart Messtechnik GmbH, Wedel, Alemanha) foi utilizado para cada paciente. A identificação de odores foi avaliada por meio de 16 tubos de ensaio com diferentes odores. O número de respostas corretas estava relacionado ao grau de distúrbio olfativo, com 16 sendo a pontuação máxima possível. Uma pontuação de 0 a 6 reflete anosmia, uma pontuação de 7 a 12 é chamada de hiposmia, enquanto uma pontuação variando de 13 a 16 é normal.
Teste do tempo de trânsito da sacarina
Este teste mede o tempo de trânsito de uma partícula de sacarina para passar da cabeça anterior do corneto nasal inferior até a faringe quando o paciente experimenta pela primeira vez a sensação de um gosto doce.
Endoscopia nasal
A endoscopia foi realizada com um endoscópio rígido de 2,7 mm (Karl Storz, Tutlingen, Alemanha) sem descongestionamento. Pontuações semiquantitativas foram registradas para pólipos, edema, secreção, crostas e cicatrização na linha de base, 6 semanas, 12 semanas e na avaliação final 24 semanas após a FESS. Esses resultados foram avaliados usando uma pontuação de aparência endoscópica (EAS). Os pólipos foram classificados por tamanho de 0 a 3 pontos; a ausência de pólipos foi pontuada como 0, pólipos aparecendo apenas no meato médio foram pontuados como 1; pólipos se estendendo além do meato médio, mas não obstruindo o nariz foram pontuados como 2; e pólipos que obstruíam completamente o nariz foram pontuados como 3. A secreção foi pontuada da seguinte forma: 0 = sem secreção; 1 = secreção clara e fina; e 2 = secreção espessa e purulenta. O edema mucoso foi pontuado da seguinte forma: 0 = ausente; 1 = leve; 2 = severo. Crostas e cicatrização na cavidade pós-operatória foram pontuadas da seguinte forma: 0 = ausente; 1 = leve; e 2 = severo; esses achados foram avaliados para a cavidade nasal direita e esquerda separadamente.
Rinomanometria anterior ativa e rinometria acústica
A rinomanometria anterior ativa (AAR) e a rinometria acústica (AR) foram realizadas com o dispositivo SRE 2000 (Rhinometrics, Lynge, Dinamarca), que permitiu a realização de ambos os testes: a AAR avaliou objetivamente tanto a resistência nasal quanto o fluxo de ar nasal, enquanto a AR refletiu a geometria e o volume de toda a cavidade nasal.
A tomografia computadorizada multislice A tomografia computadorizada multislice (TC) do nariz e dos seios paranasais foi realizada antes e 6 meses após a FESS em todos os pacientes. Fatias de meio centímetro (5 mm) nos planos axial e coronal foram obtidas. O grau de opacificação de um determinado seio (0-2) e do complexo ostiomeatal (0 = intacto, 2 = ocluído) foram calculados usando o sistema de pontuação de Lund-Mackay.
Proteína catiônica eosinofílica
Os conteúdos de proteína catiônica eosinofílica (ECP) na secreção nasal foram medidos usando um kit de coleta com dados gerados pelo analisador automático de quimioluminescência IMMULITE 1000 (Siemens Healthcare Diagnostics Inc, NY, EUA). Para coletar o muco, um pedaço de esponja de borracha espuma estéril medindo 20 × 20 × 5 mm foi introduzido no meato médio por 20 minutos. Após a remoção, a esponja foi colocada em um tubo de ensaio de 10 mL e centrifugada por 3 minutos a uma velocidade de 4000 rpm, permitindo a coleta de 0,2 a 1,0 mL de muco para análise posterior. A sensibilidade do teste foi de 0,2 ng/mL.
Teste microbiológico
O swab nasal para teste microbiológico foi coletado do meato nasal médio antes da FESS e em todas as visitas pós-operatórias. O teste de cultura e sensibilidade (resistência) foi realizado usando o analisador bacteriológico Walk Away-40 (Dade Behring, Marburg, Alemanha) e o método de difusão em disco (discos Becton Dickinson com claritromicina, EUA). Os resultados foram estimados de acordo com as recomendações do CLSI (instituto de padrões clínicos e de laboratório).
Testes de picada na pele
Testes de picada na pele para alérgenos internos e externos foram realizados em todos os pacientes usando métodos padrão.
Avaliação final dos resultados do tratamento
A avaliação final dos resultados do tratamento foi realizada usando as mudanças nos escores de EAS e Lund-Mackay CT 24 semanas após a FESS.
Análise estatística
Após consultar um estatístico médico, os resultados obtidos foram inseridos em um banco de dados computadorizado e processados usando o pacote de software estatístico SPSS versão 17.0 para Windows. Testes de postos assinados de Wilcoxon foram realizados para avaliar os efeitos do tratamento em vários pontos no tempo. Os valores foram apresentados como médias ± desvios padrão. Mudanças dentro e entre grupos foram consideradas estatisticamente significativas quando os valores de p eram <0,05.
Resultados
Onze pacientes foram retirados do estudo por várias razões: 8 pacientes no grupo 2 (antibióticos por 12 semanas) foram retirados. Um paciente desenvolveu dor abdominal após iniciar a terapia com claritromicina; um segundo paciente foi retirado devido a pesadelos que começaram 3 dias após o início do tratamento com claritromicina. Uma mulher no mesmo grupo desenvolveu uma exacerbação de duodenite erosiva 2 meses após a inclusão e foi retirada, enquanto 5 outras foram retiradas devido à falta de adesão. Uma paciente do grupo 3 (controle sem antibióticos) foi excluída devido à gravidez e 2 outras neste grupo foram retiradas devido à falta de adesão. Portanto, 55 pacientes completaram o estudo e na última visita todos os 22 pacientes do grupo 1 (antibióticos por 24 semanas) completaram o estudo, 14 pacientes permaneceram no grupo 2 (antibióticos por 12 semanas) e 19 pacientes permaneceram no grupo 3 (controle sem antibióticos).
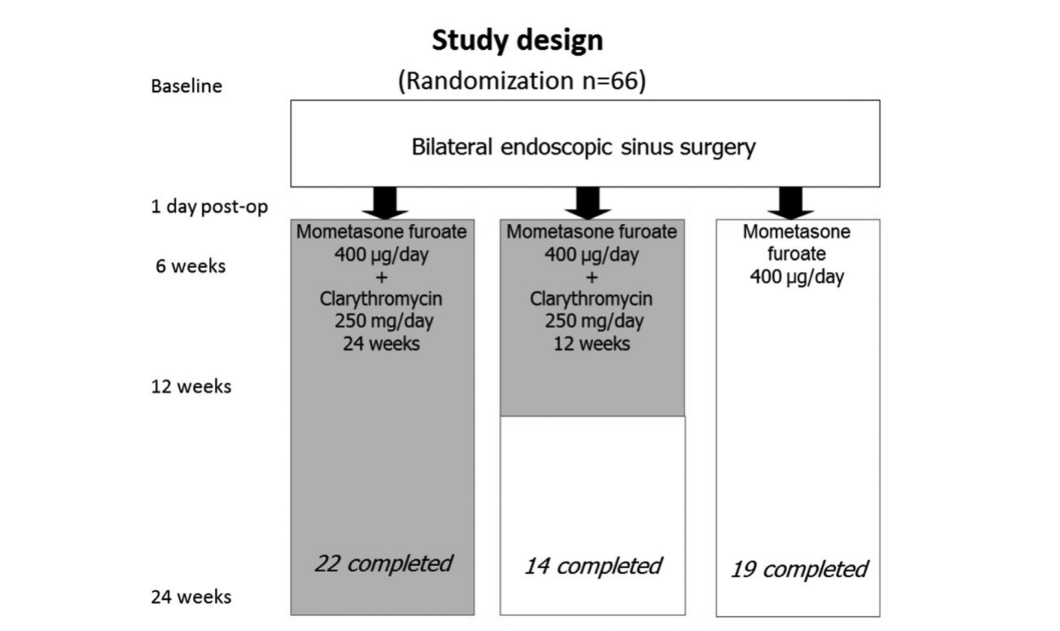
Trinta e cinco pacientes tinham BA, e 27 desses 35 pacientes apresentaram AERD. A atopia foi confirmada por testes de picada na pele em 19 dos 66 pacientes iniciais. Não houve diferenças significativas entre os 3 grupos em relação à idade, sexo, presença de atopia, gravidade da doença e número de cirurgias anteriores, assim como todos os outros parâmetros iniciais que examinamos. As características basais de cada um dos 3 grupos de tratamento: grupo 1 (antibióticos por 24 semanas), grupo 2 (antibióticos por 12 semanas) e grupo 3 (controle sem antibióticos) estão apresentadas na Tabela 1.
Os resultados do tratamento foram melhores para os pacientes que completaram o curso de tratamento com claritromicina a longo prazo no grupo 1 (antibióticos por 24 semanas) e no grupo 2 (antibióticos por 12 semanas) em comparação com os pacientes no grupo 3 (controle sem antibióticos).
Diferenças estatisticamente significativas (p < 0.05) foram obtidas para todos os parâmetros (mas não em todas as visitas) entre os grupos de medicação do estudo 1 e 2 e o grupo 3 (controle sem antibióticos), com a única exceção sendo para VAS e AR, onde evidências estatisticamente significativas não foram alcançadas.
SNOT-20
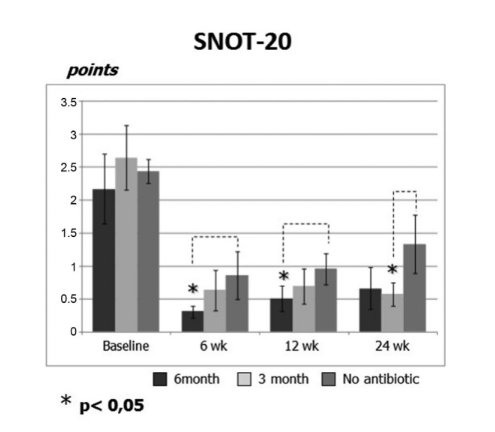
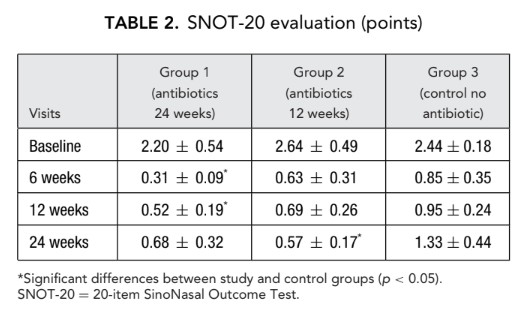
Os escores iniciais do SNOT-20 foram 2.20 ± 0.54 no grupo 1 (antibióticos por 24 semanas), 2.64 ± 0.49 no grupo 2 (antibióticos por 12 semanas) e 2.44 ± 0.18 no grupo 3 (controle sem antibióticos). Após a FESS, a QoL melhorou e a gravidade dos sintomas de rinossinusite foi aliviada em todos os sujeitos do estudo. No entanto, os escores do SNOT-20 dos pacientes no grupo 1 (antibióticos por 24 semanas) nas visitas de 6 semanas e 12 semanas após a FESS (0.31 ± 0.09 e 0.52 ± 0.19, respectivamente), assim como os escores do SNOT-20 dos pacientes no grupo 2 (antibióticos por 12 semanas) na visita final (0.57 ± 0.17) foram significativamente melhores do que os pacientes no grupo 3 (controle sem antibióticos) nas mesmas visitas; 0.85 ± 0.35, 0.95 ± 0.24 e 1.33 ± 0.44, respectivamente (p < 0.05), (Fig. 2, Tabela 2).
Escores VAS
As diferenças nas mudanças dos escores VAS entre o estudo (grupos 1 e 2) e o grupo controle (grupo 3 sem antibióticos) não alcançaram significância estatística (Tabela 3).
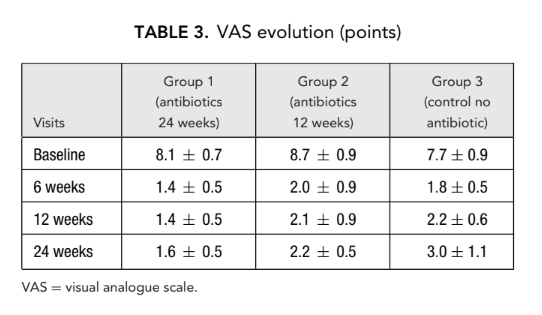
Teste olfativo
Uma disfunção olfativa severa foi detectada em todos os sujeitos do estudo antes da FESS. A perda completa ou quase completa da capacidade de identificar odores (anosmia) foi observada quando o nariz estava totalmente obstruído (bloqueado) por pólipos nasais difusos. Nenhum desses 66 pacientes recebeu esteroides sistêmicos antes da FESS. Nas segunda e terceira visitas, a olfação melhorou significativamente em todos os 3 grupos de pacientes, embora nenhum paciente tenha alcançado valores normais. Uma diferença estatisticamente significativa no número médio de respostas corretas (p < 0.05) foi revelada apenas entre o grupo 1 (antibióticos por 24 semanas) (9.5 ± 1.3) e o grupo 3 (controle sem antibióticos) (4.4 ± 0.5) na segunda visita 6 semanas após a cirurgia (Tabela 4).
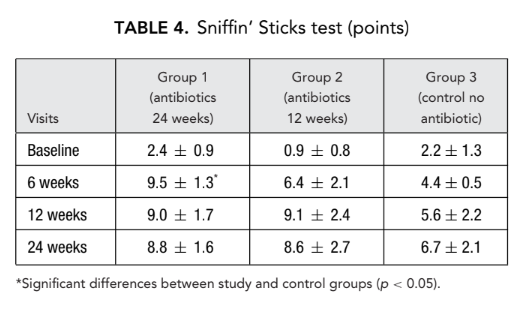
Tempo de trânsito da sacarina
Da mesma forma, 12 semanas após a cirurgia, uma redução significativa (melhora) do tempo de trânsito da sacarina foi observada no grupo 1 (antibióticos por 24 semanas) (13,6 ± 3,0 minutos) em comparação com o grupo 3 (controle sem antibióticos) (21,0 ± 4,1 minutos) (Tabela 5).
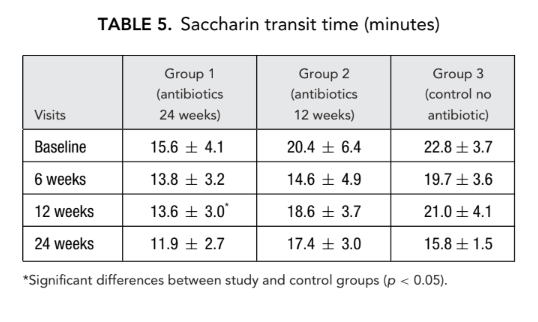
AR e AAR
Não houve diferença significativa nos parâmetros de rinometria acústica (volume da cavidade nasal, área mínima de seção transversal) entre todos os grupos. No entanto, a resistência nasal medida pela rinomanometria anterior no grupo 1 (antibióticos por 24 semanas) e no grupo 2 (antibióticos por 12 semanas) foi significativamente menor (melhor respiração) (0.23 ± 0.02 e 0.19 ± 0.02 Pa/cm3/segundo, respectivamente) do que no grupo 3 (controle sem antibióticos) (1.94 ± 1.50 Pa/cm3/segundo) no ponto final (Tabelas 6 e 7).
Tomografias computadorizadas
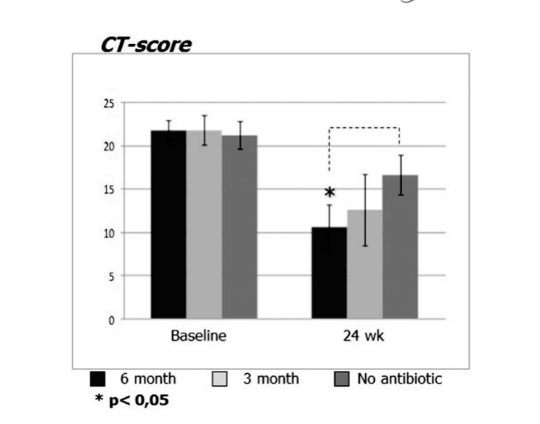
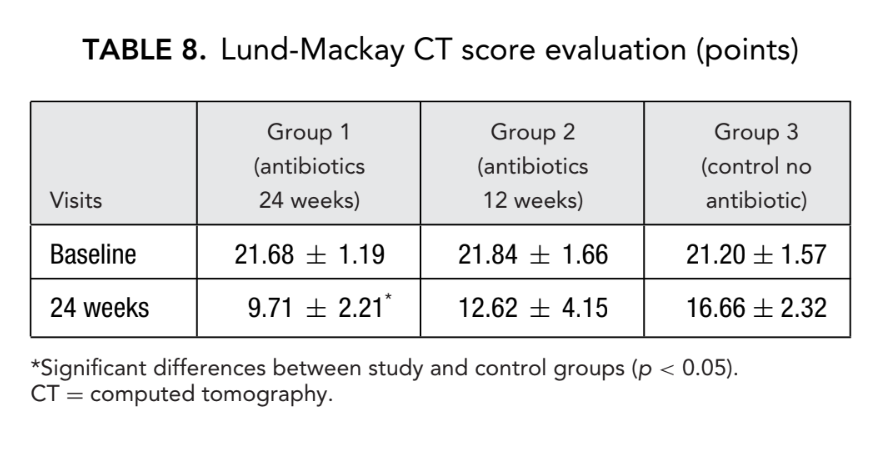
Antes do início do tratamento, os valores médios para o escore de Lund-Mackay nos primeiros, segundos e terceiros grupos de pacientes não diferiram significativamente, sendo 21,68 ± 1,20, 21,84 ± 1,66 e 21,2 ± 1,57, respectivamente. O escore médio de opacificação dos seios paranasais nas tomografias computadorizadas diminuiu dramaticamente (melhorou) em todos os 3 grupos 6 meses após a FESS. No entanto, uma diferença significativa foi observada apenas entre o grupo 1 (antibióticos por 24 semanas) com um escore médio de 9,71 ± 2,21, e o grupo 3 (controle sem antibióticos) com um escore médio de 16,66 ± 2,32 (p < 0,05). No grupo 2 (antibióticos por 12 semanas), o escore médio foi de 12,62 ± 4,15, mas essa diferença não alcançou significância estatística (Fig. 3, Tabela 8).
Endoscopia nasal
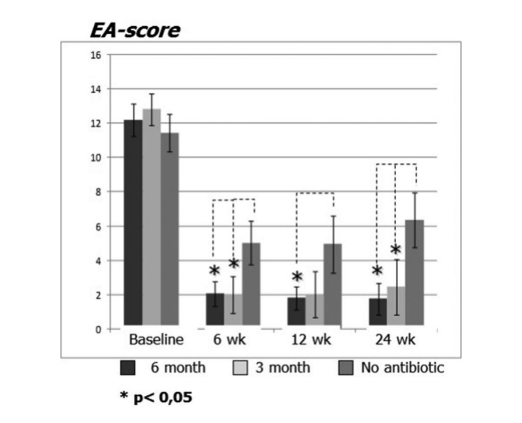
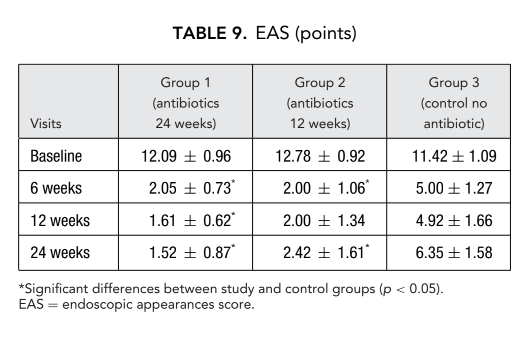
Pacientes em terapia com claritromicina no grupo 1 (antibióticos por 24 semanas) e no grupo 2 (antibióticos por 12 semanas) mostraram melhor EAS em cada visita quando comparados aos pacientes do grupo 3 que não tomaram antibióticos (Fig. 4, Tabela 9). Vinte e quatro semanas após a cirurgia, a média de EAS foi: 1.52 ± 0.87 no grupo 1 (antibióticos por 24 semanas) e 2.42 ± 1.61 no grupo 2 (antibióticos por 12 semanas), e esses resultados foram significativamente melhores do que o grupo 3 (controle sem antibióticos) 6.35 ± 1.58 (p < 0.05) (Fig. 4, Tabela 9). Um dos casos mais impressionantes que demonstram a eficácia da terapia macrolídeo a longo prazo pós-operatória é apresentado na Figura 5.
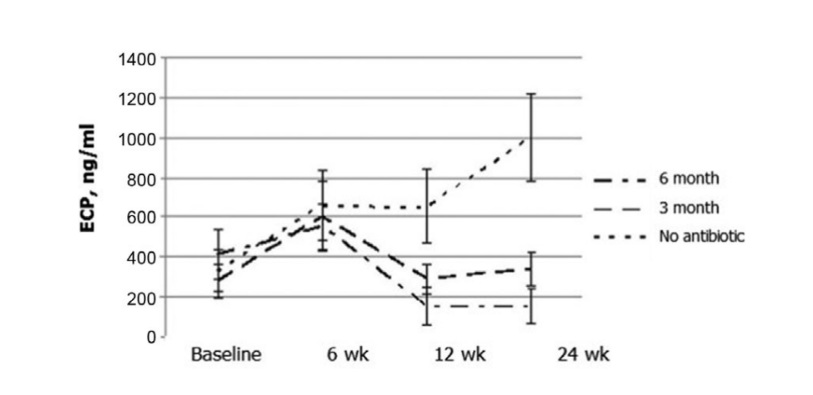
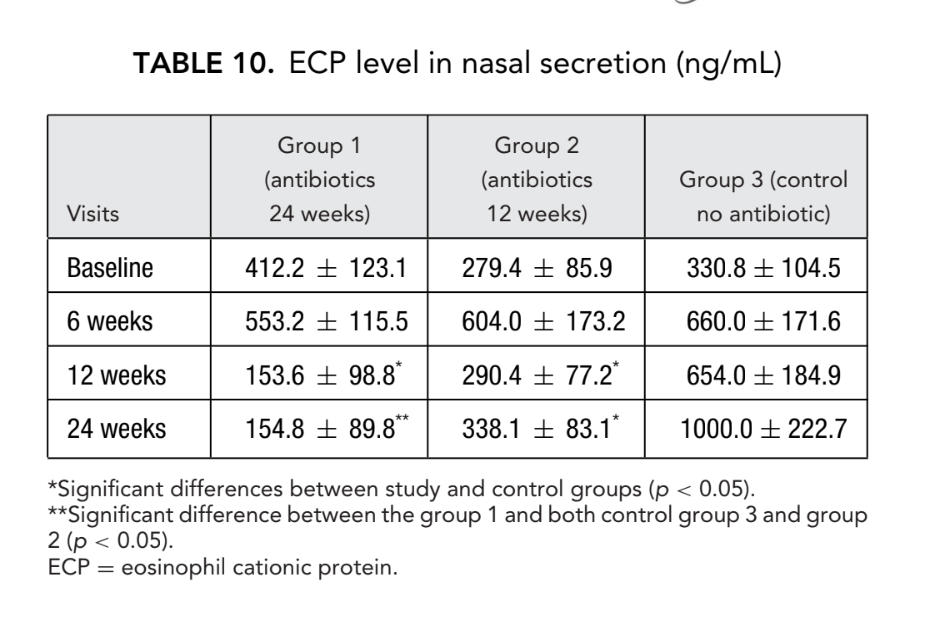
Os resultados mais notáveis ocorreram na avaliação da concentração de ECP no pós-operatório. Antes da cirurgia, os valores medianos das concentrações de ECP em todos os 3 grupos de pacientes não diferiram significativamente, sendo 412,2 ± 123,1, 279,4 ± 85,9 e 330,8 ± 104,5, respectivamente. Seis semanas após a cirurgia, o nível de ECP na secreção nasal aumentou em todos os pacientes do estudo, sendo 553,2 ± 115,5, 604,0 ± 173,2 e 660,0 ± 171,6 ng/mL nos grupos 1, 2 e 3, respectivamente. Doze semanas após a FESS, uma diminuição significativa do nível de ECP na secreção nasal foi claramente observada no grupo 1 (antibióticos por 24 semanas): 153,6 ± 98,8 ng/mL (p = 0,028), e no grupo 2 (antibióticos por 12 semanas): 290,4 ± 77,2 ng/mL (p = 0,036). O nível de ECP na secreção nasal dos pacientes do grupo 3 (controle sem antibióticos) não mudou significativamente e foi registrado como 654,0 ± 184,9 ng/mL (p = 0,25). Somente no grupo 1 (antibióticos por 24 semanas) a concentração de ECP permaneceu no mesmo nível baixo (154,8 ± 89,8 ng/mL) às 24 semanas. No grupo 2 (antibióticos por 12 semanas), houve um leve aumento dos níveis de ECP para 338,1 ± 83,1 ng/mL (p = 0,084) quando esses pacientes foram estudados às 24 semanas (3 meses após a interrupção dos antibióticos); no entanto, com um valor de p de 0,084, a diferença não foi estatisticamente significativa. O nível médio de ECP na secreção nasal do grupo 3 (controle sem antibióticos) aumentou significativamente para 1000,0 ± 222,7 ng/mL (p = 0,041) (Fig. 6, Tabela 10).
É importante notar que o nível de ECP em pacientes tratados com macrolídeos ao longo de 6 meses (grupo 1) foi significativamente mais baixo do que em aqueles pacientes do grupo 2, que interromperam a terapia antibiótica após 3 meses de tratamento.
Efeitos colaterais foram incomuns, com a descontinuação da terapia antibiótica necessária em apenas 3 pacientes. Os níveis de enzimas hepáticas (alanina transaminase [ALT], aspartato aminotransferase [AST] e fosfatase alcalina [ALP]) permaneceram normais em todos os pacientes.
O estudo microbiológico dos swabs do meato médio revelou um amplo espectro de bactérias. O organismo mais comum foi Staphylococcus aureus (30% dos pacientes), seguido por Staphylococcus epidermidis (25%), Streptococcus haemolyticus (11%), Escherichia coli (9%), Pseudomonas aeruginosa (6%) e Enterobacter aerogenes (6%). O espectro bacteriano mudou significativamente após a cirurgia, mas a proporção entre cepas resistentes à claritromicina (13%) e cepas sensíveis à claritromicina (87%) permaneceu a mesma. Ao final do estudo, algumas cepas bacterianas sensíveis a macrolídeos adquiriram resistência à claritromicina. Curiosamente, um fenômeno oposto também ocorreu; inicialmente, algumas cepas bacterianas resistentes a macrolídeos foram substituídas por algumas cepas bacterianas sensíveis a macrolídeos. Em geral, o número de cepas resistentes à claritromicina (13%) permaneceu constante ao longo do tratamento prolongado com claritromicina.
Discussão
A evidência atual apoia a ideia de que o tratamento a longo prazo com macrolídeos em baixa dose é eficaz quando reservado para pacientes com CRS não atópico recalcitrante nos quais os esteroides nasais tópicos e as irrigacões salinas falharam em controlar os sintomas. Em pacientes com CRSwNP atópico, a terapia com macrolídeos para BA e AERD não tem sido útil.
Na literatura mais recente, a terapia com macrolídeos em baixa dose a longo prazo foi relatada como eficaz em CRS, incluindo aqueles pacientes com níveis elevados de imunoglobulina E (IgE) e BA. Um estudo prospectivo recente demonstrou que um tratamento de 8 semanas com claritromicina foi igualmente eficaz em pacientes atópicos e não atópicos com polipose nasal. Em um estudo retrospectivo, pacientes com CRS e atopia responderam bem ao tratamento prolongado com macrolídeos, enquanto pacientes que fumavam tiveram o pior resultado do tratamento.
Os resultados do nosso estudo demonstraram que a terapia com macrolídeos em baixa dose a longo prazo previne a recorrência precoce de pólipos nasais após FESS, incluindo pacientes com atopia e BA. Houve uma clara correlação entre atopia e a gravidade da doença, pois nossos pacientes atópicos apresentaram escores VAS mais altos (coeficiente de correlação de posto de Spearman 0.332; p = 0.01). A presença de atopia correlacionou-se com níveis mais altos de ECP na secreção nasal (0.834; p = 0.01). Esses achados sugerem que a gravidade dos sintomas está diretamente relacionada à intensidade da inflamação eosinofílica. Infelizmente, não investigamos os níveis totais de IgE na maioria dos pacientes; portanto, a análise de subgrupo daqueles pacientes com baixos níveis de IgE não foi possível.
Uma descoberta de estudo mais notável foi a mudança nos níveis de ECP nas secreções nasais após a FESS e durante o período pós-operatório com terapia com macrolídeos. No grupo 3 (controle sem antibióticos), notamos um aumento de quase 3 vezes no nível médio de ECP 6 semanas após a cirurgia. Essa descoberta de um nível elevado de ECP após a FESS nesses pacientes do grupo 3 reflete uma exacerbação da inflamação eosinofílica causada pela cirurgia que não pôde ser adequadamente controlada apenas com esteroides tópicos intranasais. Por outro lado, nos grupos de tratamento 1 (antibióticos por 24 semanas) e 2 (antibióticos por 12 semanas), houve uma diminuição gradual dos níveis de ECP com o tratamento de claritromicina em baixa dose a longo prazo, refletindo controle e redução da inflamação eosinofílica.
Um dos objetivos deste trabalho foi estudar a eficácia de um curso de tratamento mais longo (6 meses) em comparação com o curso relativamente curto (3 meses) de terapia com macrolídeos em baixa dose. Os dados sugeriram algum benefício de um curso de antibióticos mais longo, mas a diferença entre o grupo 1 (antibiótico por 24 semanas) e o grupo 2 (antibiótico por 12 semanas) não alcançou significância estatística na maioria dos pacientes. No entanto, há algumas evidências de que uma duração mais longa do tratamento no grupo 1 (antibióticos por 24 semanas) parece ser mais eficaz do que um curso mais curto observado no grupo 2 (antibióticos por 12 semanas).
Os escores de TC para o grupo 1 (antibióticos por 24 semanas) foram de 9,71 ± 2,21, que foi significativamente menor do que no grupo 3 (controle sem antibióticos), com leituras de 16,66 ± 2,32 no ponto final. A diferença entre o grupo 2 (antibióticos por 12 semanas) e o grupo 3 (controle sem antibióticos) não alcançou significância estatística (Tabela 8). Houve diferenças significativas nos níveis médios de ECP nos grupos
1 e 2 no ponto final, confirmando indiretamente que um curso de antibióticos de 6 meses reduz a inflamação eosinofílica, prevenindo assim a recorrência precoce de pólipos nasais. Obviamente, o uso de esteroides orais certamente seria considerado o padrão de atendimento nos Estados Unidos e em alguns outros países ocidentais, especialmente no contexto de uma recaída de inflamação eosinofílica pós-operatória. No entanto, em países como a Rússia, onde a terapia com corticosteroides sistêmicos em CRSwNP é extremamente incomum, a terapia com macrolídeos a longo prazo pode ser uma opção alternativa, pois apresenta menos risco de efeitos colaterais sistêmicos.
Não encontramos um aumento nas culturas bacterianas resistentes a macrolídeos do meato médio após um tratamento de longo prazo com baixa dose de 250 mg/dia de terapia com claritromicina, concordando com estudos anteriores que também não encontraram microrganismos resistentes após tratamento prolongado com azitromicina e eritromicina. Claro, o risco de desenvolver cepas de bactérias resistentes a antibióticos induzidas pela terapia prolongada com macrolídeos é sempre possível.
Embora um braço placebo não tenha sido projetado em nosso protocolo e os pacientes não tenham sido cegados ao receber terapia adicional, avaliamos 6 métodos objetivos diferentes em todos os 3 grupos de estudo. Todos os investigadores estavam cegados ao avaliar e classificar os resultados da endoscopia nasal, tomografias computadorizadas e todos os outros testes. Um futuro estudo randomizado, duplo-cego e controlado por placebo, com um grande tamanho de amostra, seria necessário para determinar a eficácia da terapia prolongada com macrolídeos, particularmente na prevenção da recorrência de pólipos nasais após FESS. Além disso, tal estudo poderia, esperançosamente, prever quais pacientes com CRSwNP se beneficiariam do tratamento antibiótico a longo prazo e se esse tratamento aumenta o risco de induzir resistência bacteriana significativa.
Conclusão
Os resultados deste estudo demonstraram a eficácia e a segurança relativa da terapia de macrolídeos (claritromicina) em baixa dose (250 mg/dia) a longo prazo (6 meses) para prevenir a recorrência precoce de pólipos nasais em pacientes com CRSwNP após FESS. Apesar dos dados clínicos limitados, nossas evidências sugerem que pacientes com CRSwNP recorrente (falhas cirúrgicas) merecem uma tentativa de tratamento com claritromicina em baixa dose (250 mg diariamente por 3-6 meses), que pode ser iniciada imediatamente após a FESS juntamente com a terapia de manutenção usando esteroides nasais tópicos.
Referências
- Hedman J, Kaprio J, Poussa T, Nieminen MM. Prevalência de asma, intolerância à aspirina, pólipos nasais e doença pulmonar obstrutiva crônica em um estudo populacional. Int J Epidemiol. 1999;28:717–722.
- Settipane G. Epidemiologia dos pólipos nasais. In: Settipane G, Lund VJ, Bernstein JM, Tos M, eds. Pólipos Nasais: Epidemiologia, Patogênese e Tratamento. Providence, RI: Oceanside Publications; 1997:17– 24.
- Ogino S, Harada T, Okawachi I, Irifune M, Matsunaga T, Nagano T. Asma induzida por aspirina e pólipos nasais. Acta Otolaryngol Suppl. 1986;430:21– 27.
- Fokkens W, Lund V, Mullol J. Grupo do Documento de Posição Europeu sobre Rinossinusite e Pólipos Nasais. Documento de Posição Europeu sobre Rinossinusite e Pólipos Nasais 2007. Rhinol Suppl. 2007;(20):1–136.
- Desrosiers MY, Kilty SJ. Alternativas de tratamento para rinossinusite crônica persistente após ESS: o que fazer quando antibióticos, esteroides e cirurgia falham. Rhinology. 2008;46:3–14.
- Kudoh S, Uetake T, Hagiwara K, et al. Efeito clínico da quimioterapia com eritromicina em baixa dose e a longo prazo na bronquiolite pan-difusa (Resumo em inglês). Jpn J Thorac Dis. 1984;25:632–642.
- Kudoh S, Asuma A, Yamamoto M, Izumi T, Ando M. Melhora da sobrevida em pacientes com bronquiolite pan-difusa tratados com eritromicina em baixa dose. Am J Respir Crit Care Med. 1998;157:1829– 1832.
- Cervin A, Wallwork B. Terapia com macrolídeos para rinossinusite crônica. Rhinology. 2007;45:259– 267.
- Cervin A, Wallwork B, Mackay-Sim A, Coman WB, Greiff L. Efeitos do tratamento prolongado com claritromicina em marcadores de inflamação no líquido de lavagem em rinossinusite crônica. Clin Physiol Funct Imaging. 2009;29:136–142.
- Stjarne P, Ollson P, Alenius M. Uso de furoato de mometasona para prevenir a recorrência de pólipos após cirurgia endoscópica dos seios. Arch Otolaryngol Head Neck Surg. 2009;135:296–302.
- Piccirillo J, Merritt M, Richards M. Validade psicométrica e clinimétrica do Teste de Resultado Sino-Nasal de 20 itens (SNOT-20). Otolaryngol Head Neck Surg. 2001;126:41–47.
- Hummel T, Kobal G, Gudziol H, Mackay-Sim A. Dados normativos para os “Sniffin’ Sticks” incluindo testes de identificação de odores, discriminação de odores e limiares olfativos: uma atualização baseada em um grupo de mais de 3.000 sujeitos. Eur Arch Otorhinolaryngol. 2007;264:237–243.
- Lund VJ, Mackay IS. Estadiamento na rinossinusite. Rhinology. 1993;31:183–184.
- Fokkens WJ, Lund VJ, Mullol J, et al. Documento de Posição Europeu sobre Rinossinusite e Pólipos Nasais 2012.
- Rhinol Suppl. 2012;(23):3 p antes da tabela de conteúdos, 1–298.
- Wallwork B, Coman W, Mackay-Sim A, Greiff L, Cervin A. Um ensaio clínico duplo-cego, randomizado e controlado por placebo de macrolídeo no tratamento da rinossinusite crônica. Laryngoscope. 2006;116:189– 193.
- Haruna S, Shimada C, Ozawa M, Fukami S, Moriyama H. Um estudo de respondentes pobres para administração de macrolídeos em baixa dose a longo prazo para sinusite crônica. Rhinology. 2009;47:66–71.
- Videler WJ, Badia L, Harvey RJ, et al. Falta de eficácia de azitromicina em baixa dose a longo prazo na rinossinusite crônica: ensaio controlado randomizado. Allergy. 2011;66:1457–1468.
- Peric A, Vojvodic D, Baletic N, Peric A, Miljanovic O. Influência da alergia nos efeitos imunomodulatórios e clínicos do tratamento com macrolídeos em baixa dose a longo prazo para pólipos nasais. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub. 2010;154:327–334.
- Videler WJ, van Hee SM, Reinartz C, Georgalas FW, Meulen K, Fokkens WJ. Antibióticos em baixa dose a longo prazo na rinossinusite crônica recalcitrante: uma análise retrospectiva. Rhinology. 2012;50:45–55.
- Cervin A, Kalm O, Sandkull P, Lindberg S. Tratamento com eritromicina em baixa dose por um ano de sinusite crônica persistente após cirurgia de seios: resultado clínico e efeitos em parâmetros mucociliares e óxido nítrico nasal. Otolaryngol Head Neck Surg. 2002;126:481–489.
