Uma avaliação histológica comparativa da biocompatibilidade de materiais utilizados na cirurgia apical
Tradução automática
O artigo original está escrito em EN language (link para lê-lo) .
Resumo
Objetivo: Avaliar as propriedades biológicas de uma variedade de materiais que poderiam ser utilizados na cirurgia apical.
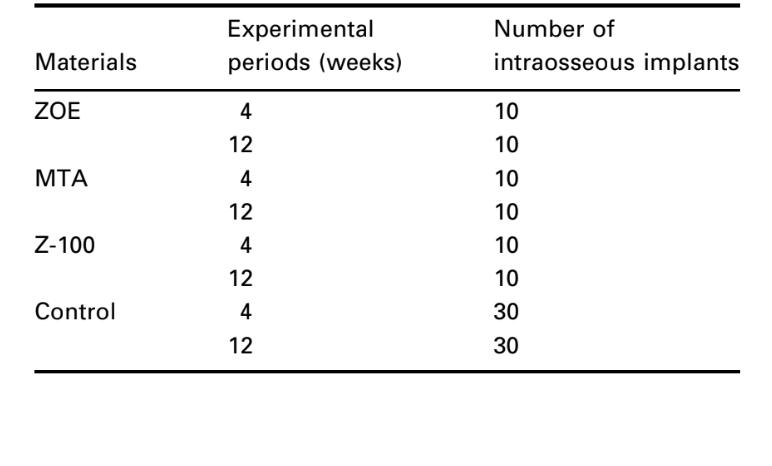
Metodologia: A técnica de implante intraósseo recomendada pela FDI (1980) e ADA (1982) foi utilizada para testar os seguintes materiais: óxido de zinco-eugenol (ZOE), agregado mineral de trióxido (MTA) e resina composta fotopolimerizável Z-100. Trinta cobaias, 10 para cada material, divididas em períodos experimentais de 4 e 12 semanas, receberam um implante de cada lado da sínfise da mandíbula inferior. A resposta do tecido conjuntivo ao longo da parede lateral fora da cavidade serviu como controle negativo para a técnica. Ao final dos períodos de observação, os animais foram sacrificados e os espécimes preparados para exame histológico rotineiro para avaliar sua biocompatibilidade.
Resultados: A reação do tecido aos materiais diminuiu com o tempo. O cimento ZOE foi altamente tóxico durante o período experimental de 4 semanas, mas esse perfil mudou significativamente após 12 semanas, quando apresentou características biocompatíveis. O MTA e o Z-100 mostraram biocompatibilidade neste modelo de teste em ambos os períodos de tempo.
Conclusões: MTA e o compósito Z-100 foram biocompatíveis em 4 e 12 semanas neste modelo experimental.
Introdução
O sucesso no tratamento de canal radicular depende da remoção do conteúdo infectado do canal, seguido pelo preenchimento do canal utilizando um material de compatibilidade adequada para evitar irritação aos tecidos periapicais. Apesar da constante evolução dos conceitos, novas técnicas endodônticas e o desenvolvimento de materiais e instrumentos mais eficazes, a resolução da patologia periapical às vezes só é alcançada por meio de procedimentos cirúrgicos (Tassery et al. 1999).
A cirurgia apical, no entanto, deve ser realizada apenas quando o tratamento convencional de canal radicular falhou. O material ideal para o preenchimento do ápice radicular deve ter características biocompatíveis, estabilidade dimensional, adesividade, baixa solubilidade e a capacidade de criar um selamento do terço apical do canal para isolar o sistema de canal radicular da região periapical (Gartner & Dorn 1992). A biocompatibilidade tem se mostrado um dos fatores mais importantes (Pascon et al. 2001).
Ao considerar as propriedades biológicas dos materiais endodônticos, há uma ampla gama de características que devem ser consideradas. As metodologias para avaliar esses parâmetros compreendem testes iniciais, testes secundários e estudos de uso. A avaliação inicial deve incluir métodos básicos in vitro de avaliação das propriedades biológicas. As avaliações secundárias devem ser realizadas in vivo em animais de laboratório e podem incluir experimentos de implantação. Os estudos de uso são realizados em primatas ou seres humanos (Spångberg 1969, Stanley 1985).
Um grande número de materiais foi recomendado para o preenchimento apical do canal radicular. O objetivo deste estudo foi avaliar a reação tecidual de uma variedade de materiais potencialmente úteis usados como preenchimento do canal radicular, utilizando o modelo experimental recomendado pela FDI (1980) e ADA (1982).
Materiais e métodos
Os materiais avaliados foram óxido de zinco-eugenol (ZOE) (S.S.White, Rio de Janeiro, Brasil), agregado mineral trióxido (MTA) (ProRootTM MTA; Dentsply Endodontics, Tulsa, OK, EUA) e resina composta fotopolimerizável Z-100 (3M, St Paul, MN, EUA). Todos os materiais foram preparados da maneira aconselhada pelo fabricante para seu uso clínico e carregados em suportes de Teflon® (Politetrafluoretileno; DuPont, HABIA, Knivsta, Suécia), garantindo que o ar não fosse aprisionado.
O implante intraósseo na mandíbula do porquinho-da-índia (Spångberg 1969) e os métodos padronizados para avaliar as reações biológicas recomendados pela FDI (1980) e ADA (1982) foram utilizados. Trinta porquinhos-da-índia (pesando ~800 g) foram selecionados e cada animal recebeu dois implantes do mesmo material. Dez espécimes foram utilizados para cada material e período de observação (Tabela 1). Além disso, a resposta do tecido conjuntivo ao longo da parede lateral fora do copo de Teflon® serviu como controle negativo para a técnica.
Os animais foram anestesiados intraperitonealmente com 0,6 mL de cetamina (100 mg mL–1), contendo acepromazina (0,5 mg mL–1). Na dobra mucobucal da região dos incisivos mandibulares, 0,6 mL de xilocaína 2% com epinefrina (1 : 100 000) foi injetado, para prevenir desconforto local. Os porquinhos-da-índia foram depilados na área submandibular, e a pele desinfetada com 5% de tintura de iodo. A região simfisária ventral distal da mandíbula foi exposta cirurgicamente sob condições assépticas através de uma incisão na pele e no tecido muscular. O osso mandibular em ambos os lados da sínfise foi exposto, e buracos cilíndricos alargados para um diâmetro de 2 mm e uma profundidade de 2 mm foram preparados com brocas sob irrigação de solução salina fisiológica estéril. Copos cilíndricos de Teflon® esterilizados, abertos em uma extremidade e com suas superfícies externas roscadas para proporcionar sulcos de retenção, foram preenchidos sob condições estéreis com os materiais e inseridos nas cavidades ósseas de tal forma que os materiais de preenchimento estivessem em contato com o tecido ósseo. Os cilindros foram
2,0 mm de comprimento e tinha um diâmetro interno de 1,3 mm e um diâmetro externo de 2,0 mm. Quando os copos estavam no lugar, os tecidos moles foram reposicionados e suturados independentemente com um material reabsorvível 3-0. Os períodos de observação foram de 4 e 12 semanas, quando os porquinhos-da-índia foram sacrificados, a mandíbula foi dissecada e o osso adjacente aos copos in situ foi seccionado em blocos de 10 mm. Os espécimes foram imersos em solução de formalina tamponada a 10% e preparados para exame histológico de rotina. Seções seriadas (5 lm de espessura) foram cortadas e coradas com hematoxilina-eosina (H & E) para reconhecimento celular.
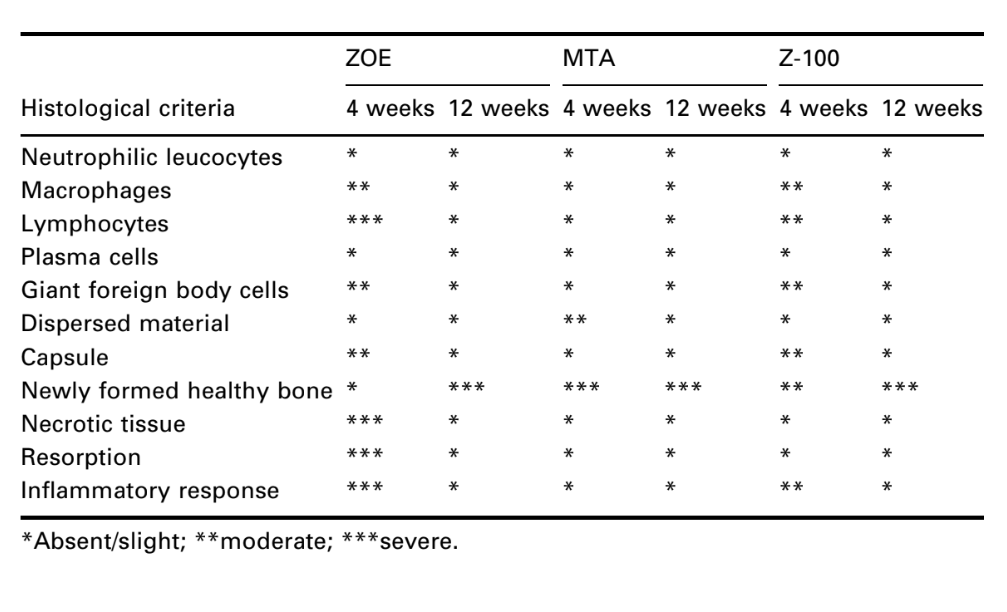
A interface na abertura do copo, entre o material e o osso, foi examinada e avaliada quanto à intensidade da inflamação. Dez critérios histológicos foram utilizados para determinar os níveis inflamatórios – presença ou ausência de leucócitos neutrofílicos, macrófagos, linfócitos, células plasmáticas, células gigantes de corpo estranho, material disperso, cápsula, osso saudável recém-formado, tecido necrótico e reabsorção.
Dois observadores independentes foram utilizados para avaliar as reações teciduais. O nível geral da reação tecidual foi então classificado como nenhuma a leve, moderada e severa, de acordo com os critérios histológicos definidos anteriormente. Foi considerado biologicamente aceitável que o material mostrasse nenhuma a leve reação em ambos os períodos experimentais de 4 e 12 semanas, ou uma reação moderada em 4 semanas que diminuísse em 12 semanas.
Resultados
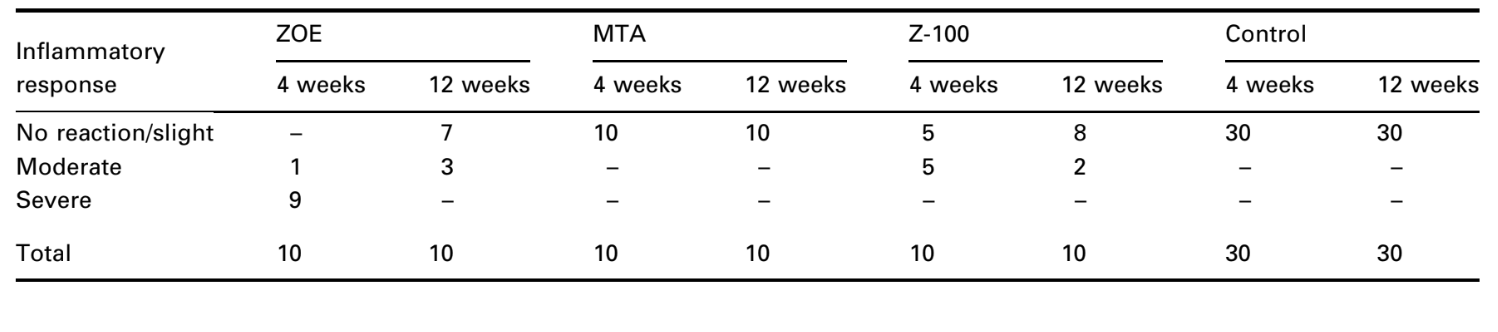
O número de implantes intraósseos e a intensidade da resposta inflamatória estão apresentados na Tabela 2. As avaliações histológicas dos materiais em 4 e 12 semanas estão resumidas na Tabela 3.
Observações de quatro semanas
Controle negativo
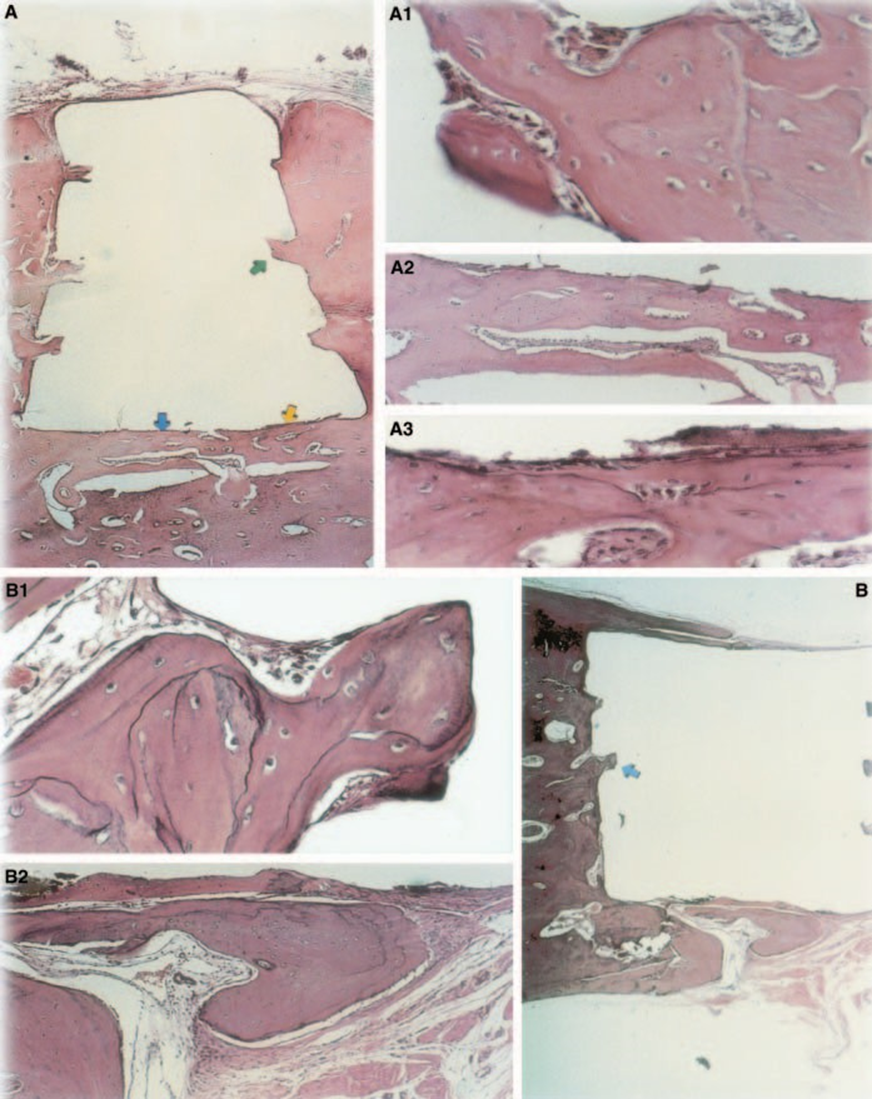
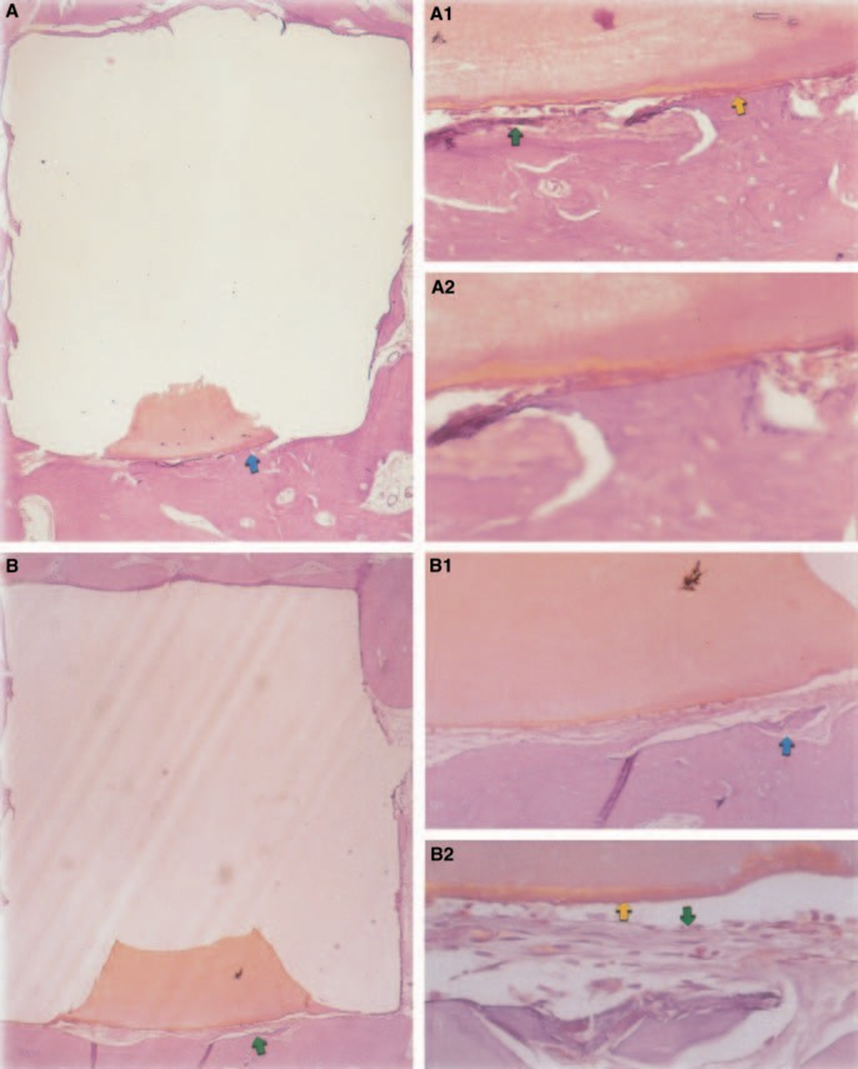
A resposta do tecido conjuntivo ao longo da parede lateral fora das copos de Teflon® de todos os espécimes serviu como controle negativo para a técnica. Os sulcos na superfície externa dos copos foram preenchidos com novo tecido ósseo, e camadas finas de tecido conjuntivo sem reação inflamatória puderam ser vistas entre o copo e o osso em todos os períodos de observação em todos os espécimes (Fig. 6A1,A2).
Óxido de zinco-eugenol
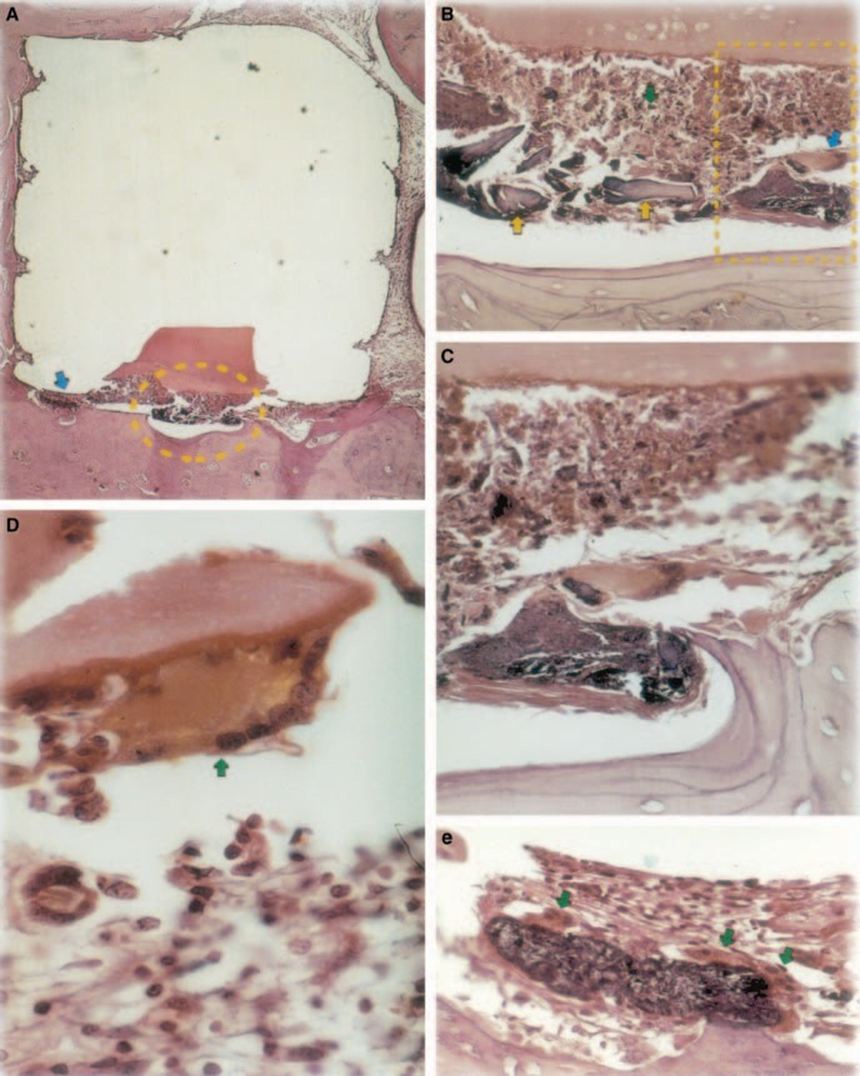
A reação foi severa com necrose óssea, reabsorção, infiltrado inflamatório mononuclear demonstrado pela presença de linfócitos, macrófagos e células gigantes de corpo estranho (Fig. 1C). A presença de aglomerados de células gigantes de corpo estranho contendo material no citoplasma e tecido necrótico eram comuns (Fig. 1D). Houve maior deposição de fibras de colágeno mais próximas do tecido ósseo do que do material e baixa presença de células inflamatórias (Fig. 1B).
Agregado de trióxido mineral
A resposta inflamatória foi classificada como nenhuma a leve. Houve formação de osso saudável em estreito contato com o material (Fig. 3).
Z-100
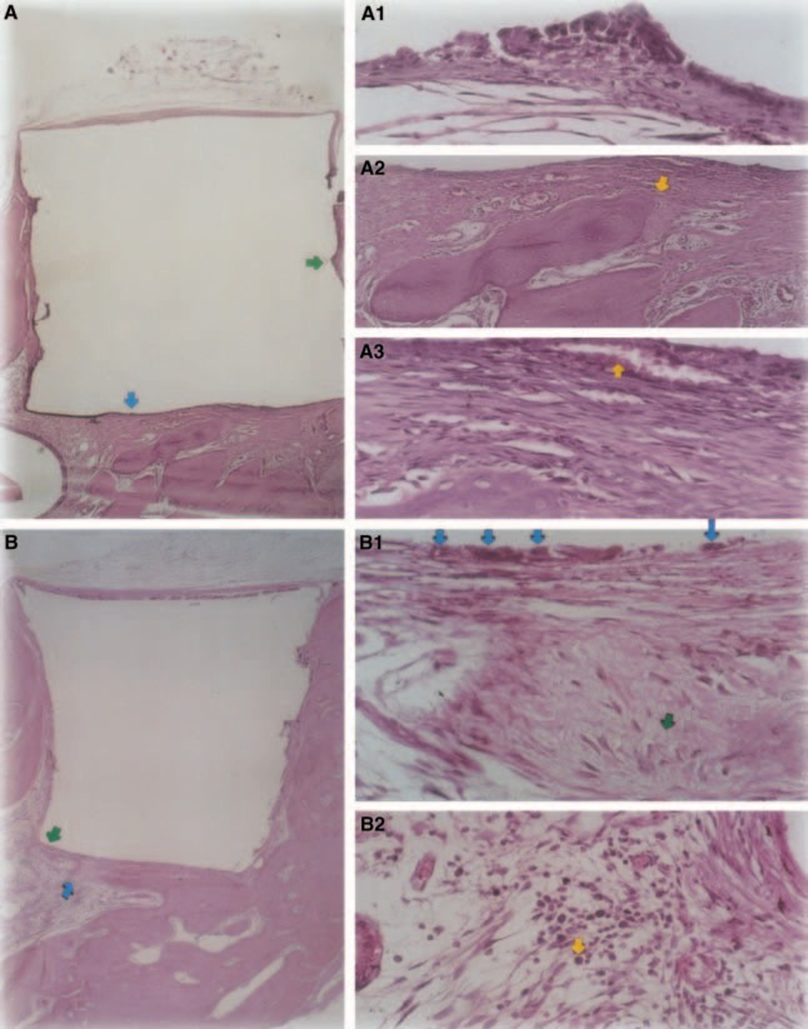
Uma resposta inflamatória leve a moderada foi observada com formação de tecido conjuntivo denso na interface material/tecido ósseo (Fig. 5A2,B1). Este tecido conjuntivo fibroso era rico em fibroblastos; vasos, sem infiltrado inflamatório, e deposição de tecido mineral puderam ser observados, demonstrando formação óssea (Fig. 5A3). A presença de macrófagos e células gigantes de corpo estranho perto do material foi uma constatação constante (Fig. 5A1,B1). Um infiltrado inflamatório crônico moderado perto do material foi observado (Fig. 5B2).
Observações de doze semanas
Controle negativo
A resposta do tecido conjuntivo ao longo da parede lateral fora dos copos de Teflon® de todos os espécimes serviu como controle negativo para a técnica. Foi possível observar que os sulcos na superfície externa dos copos estavam preenchidos com novo tecido ósseo, e uma fina camada de tecido conjuntivo sem reação inflamatória podia ser vista entre o copo e o osso em todos os períodos de observação em todos os espécimes (Fig. 6A1,A2).
Óxido de zinco-eugenol
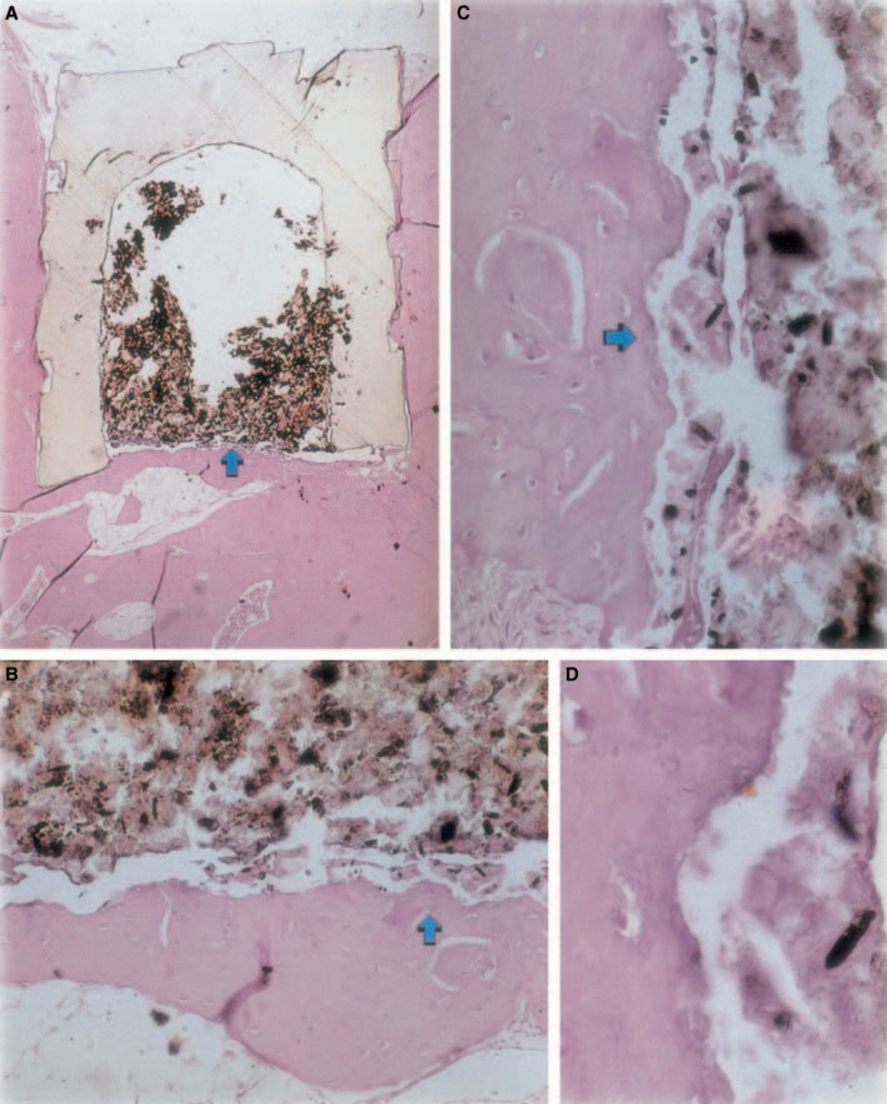
A reação inflamatória variou de nenhuma a leve durante o período experimental. Houve formação óssea na interface (Fig. 2A,B). O osso ao redor do copo estava saudável e o cobria completamente. Em alguns casos, havia uma camada estreita de tecido conjuntivo entre o material implantado e o novo tecido ósseo (Fig. 2A1,A2,B1). No entanto, ainda havia alguma reabsorção presente (Fig. 2B2).
Agregado de trióxido mineral
Um novo tecido ósseo havia se formado na interface material/tecido. Não houve reação inflamatória significativa e, quando presente, macrófagos e células gigantes de corpo estranho estavam na região periférica, em estreito contato com o copo de Teflon®. Também foi observado osso saudável contendo osteoblastos em estreito contato com o material (Fig. 4C).
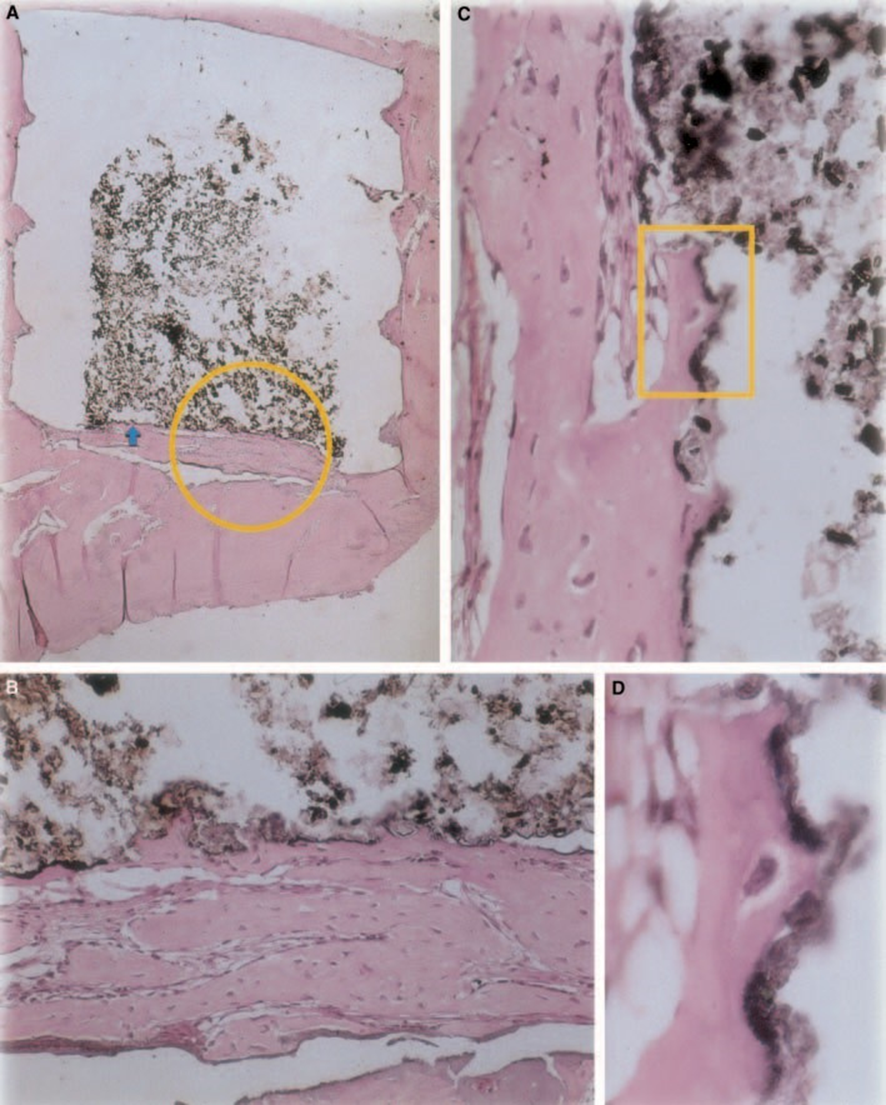
Z-100
A espessura do tecido conjuntivo foi significativamente reduzida na interface (Fig. 6A,B). A presença de células inflamatórias foi baixa, exceto para células gigantes de corpo estranho (Fig. 6A3).
Discussão
A biocompatibilidade é uma das propriedades mais importantes de um material utilizado no preenchimento apical do ápice radicular, pois estará em contato permanente com tecidos vivos na região periapical. Um dos objetivos da cirurgia perirradicular é criar uma barreira entre a região periapical e quaisquer agentes físicos e/ou bacterianos dentro do sistema de canal radicular. O uso de um material de preenchimento do ápice radicular não compatível interferirá na cicatrização naquela área. Os materiais utilizados no preenchimento apical do ápice radicular, além dos testes preliminares necessários, devem ter suas características de biocompatibilidade investigadas (Torabinejad & Pitt Ford 1996).
O teste de implante em tecido ósseo de porquinho-da-índia recomendado pela FDI (1980) permite testar o material como ele é utilizado no ambiente clínico, preparado de acordo com a recomendação do fabricante. Embora os resultados não possam ser extrapolados diretamente para seres humanos, o teste é padronizado e permite a comparação direta entre materiais. A literatura nesta área fornece resultados em vários laboratórios utilizando os mesmos materiais para permitir a comparação de dados (Pascon et al. 1987, Andreana et al. 1989, Pascon & Langeland 1989, Barbosa et al. 1993). Os resultados obtidos neste estudo confirmaram as descobertas de outros que qualquer material colocado em contato com tecidos provoca uma reação de corpo estranho (Figs 1D, 5B1 e 6A3).
As reações ao longo da periferia externa do copo de Teflon® refletem o trauma causado pelos procedimentos cirúrgicos necessários para a introdução do Teflon® e seu conteúdo. O Teflon® em si causa irritação insignificante nos tecidos (Stanley 1985) e foi utilizado como transportador devido à sua biocompatibilidade (Spångberg 1969, ADA 1982). Isso foi confirmado pela ausência de reações inflamatórias na parede lateral dos transportadores em ambos os períodos de observação.
A resposta inflamatória ao ZOE foi significativamente maior do que a dos outros materiais em ambos os períodos de observação (Figs 1 e 2). Essa resposta severa ao ZOE foi descrita na literatura (Pascon & Langeland 1989, Gulati et al. 1991, Guigand et al. 1999). Também foi demonstrado que qualquer material que contenha eugenol provoca uma reação tecidual severa devido à depressão da respiração celular (Hume 1984). Serene et al. (1988) descobriram que os selantes de ZOE ativaram o sistema complemento e, assim, uma reação inflamatória. A resposta inflamatória prolongada ao ZOE ocorre porque a reação entre o material e os fluidos teciduais acaba liberando eugenol do material.
Os resultados apresentados confirmaram as descobertas relatadas por Torabinejad et al. (1997, 1998) sobre a resposta inflamatória do MTA (Figs 3 e 4). Esses autores testaram este material nas tíbias e mandíbulas de cobaias, e como um material de preenchimento apical em macacos, e relataram sua biocompatibilidade. Nenhuma resposta inflamatória significativa foi observada.
Stabholz et al. (1985) introduziram resinas compostas como materiais de preenchimento apical e compararam suas propriedades físicas com a amálgama de prata, Cavit e fosfato de zinco. No entanto, não houve preocupações sobre a resposta tecidual em seu trabalho. Quando as resinas foram usadas como materiais apicais, os resultados variaram de inflamação severa (Bruce et al. 1993) a um alto grau de cicatrização (Rud et al. 1991).
Os resultados do presente estudo são semelhantes aos de Rud et al. (1991), que sugeriram que as composições tinham biocompatibilidade promissora. Embora fosse uma descoberta rotineira, o crescimento ósseo em estreito contato com o Z-100 ocorreu, provavelmente como resultado de seu baixo grau de toxicidade (Fig. 6A2,B2).
Conclusões
- O nível de toxicidade dos materiais testados diminuiu com o tempo.
- O cimento à base de ZOE foi altamente tóxico durante o período experimental de 4 semanas, mas esse perfil mudou significativamente após 12 semanas, quando apresentou características biocompatíveis.
- Todos os materiais estudados, com exceção do ZOE, apresentaram níveis de biocompatibilidade aceitáveis, dentro dos dois períodos analisados.
- O MTA apresentou excelentes qualidades biológicas com crescimento ósseo em contato próximo com o material e sem tecido conjuntivo interposto.
- O MTA e o Z-100 indicaram biocompatibilidade neste teste secundário.
Autores: C. J. A. Sousa, A. M. Loyola, M. A. Versiani, J. C. G. Biffi, R. P. Oliveira, E. A. Pascon
Referências
- ADA (1982) Avaliação Biológica de Materiais Dentários. American Dental Association, Nova York, Documento No. 41.
- Andreana S, Pascon EA, Langeland K (1989) Resposta do tecido ósseo à hemofibrina [Resumo]. Journal of Dental Research 68, 381.
- Barbosa SV, Araki K, Spångberg LS (1993) Citotoxicidade de alguns selantes de canal radicular modificados e seus componentes solúveis. Oral Surgery, Oral Medicine and Oral Pathology 75, 357–61.
- Bruce GR, McDonald NJ, Sydiskis RJ (1993) Citotoxicidade de materiais de retropreenchimento. Journal of Endodontics 19, 288–92.
- FDI (1980) Práticas Padrão Recomendadas para a Avaliação Biológica de Materiais Dentários. Federation Dentaire Internationale, Londres, Relatório Técnico nº 9.
- Gartner AH, Dorn, SO (1992) Avanços na cirurgia endodôntica. Dental Clinics of North America 36, 357–78.
- Guigand M, Pellen-Mussi P, LeGolff A, Vulcain J-M, Bonnaure-Mallet M (1999) Avaliação da cito compatibilidade de três materiais endodônticos. Journal of Endodontics 25, 419– 23.
- Gulati N, Chandra S, Aggarwal PK, Jaiswal JN, Singh M (1991) Citotoxicidade do eugenol em selante contendo óxido de zinco. Endodontics and Dental Traumatology 7, 181–5.
- Hume WR (1984) Efeito do eugenol na respiração e divisão em polpa humana, fibroblastos de camundongo e células hepáticas in vitro. Journal of Dental Research 63, 1262–5.
- Pascon EA, Langeland K (1989) Citotoxicidade de um novo selante endodôntico [Resumo]. Journal of Dental Research 68, 244.
- Pascon EA, Spångberg L, Langeland K (1987) Citotoxicidade de selantes endodônticos [Resumo]. Journal of Dental Research 66, 200.
- Pascon EA, Sousa CJA, Langeland K (2001) Biocompatibilidade de materiais endodônticos: citotoxicidade de uma resina de poliuretano derivada do óleo de mamona. Brazilian Endodontic Journal 5, 5–12.
- Rud J, Munksgaard EC, Andreasen JO, Rud V, Asmussen E (1991) Preenchimento radicular retrógrado com compósito e um agente de ligação ao dentina. Parte 1. Endodontics and Dental Traumatology 7, 118–25.
- Serene TP, Vesely J, Boackle RJ (1988) Ativação do complemento como uma possível indicação in vitro do potencial inflamatório de materiais endodônticos. Oral Surgery, Oral Medicine and Oral Pathology 65, 354–7.
- Spångberg L (1969) Efeitos biológicos de materiais de preenchimento de canal radicular. Parte 7. Reação do tecido ósseo ao material de preenchimento de canal radicular implantado em porquinhos-da-índia. Odontologisk Tidskrift 77, 133–59.
- Stabholz A, Friedman S, Abed J (1985) Adaptação marginal de preenchimentos retrógrados e sua correlação com a selabilidade. Journal of Endodontics 11, 218–23.
- Stanley HR (1985) Teste de Toxicidade de Materiais Dentários, 1ª ed. Miami, FL, EUA: CRC Press.
- Tassery H, Pertot WJ, Camps J, Proust JP, Déjou J (1999) Comparação de dois locais de implantação para teste de biocompatibilidade intraóssea. Journal of Endodontics 25, 615–8.
- Torabinejad M, Pitt Ford TR (1996) Materiais de preenchimento de extremidade radicular: uma revisão. Endodontics and Dental Traumatology 12, 161– 78.
- Torabinejad M, Pitt Ford TR, McKendry DJ, Abedi HR, Miller DA, Kariyawasam SP (1997) Avaliação histológica do agregado mineral trióxido como preenchimento de extremidade radicular em macacos. Journal of Endodontics 23, 225–8.
- Torabinejad M, Pitt Ford TR, Abedi, HR, Kariyawasam SP, Tang HM (1998) Reação tecidual a materiais de preenchimento de extremidade radicular implantados na tíbia e mandíbula de porquinhos-da-índia. Journal of Endodontics 24, 468–71.
