Comparação in vivo da biocompatibilidade de dois selantes de canal radicular implantados no tecido conjuntivo subcutâneo de ratos
Tradução automática
O artigo original está escrito em EN language (link para lê-lo).
Objetivo. Avaliar a biocompatibilidade subcutânea de 2 selantes de canal radicular.
Desenho do estudo. A técnica de implante subcutâneo recomendada pela Fédération Dentaire International (FDI) foi utilizada para testar os selantes de canal radicular Endométhasone e EndoREZ. Esses materiais foram colocados em tubos de Teflon, com 1 mm de diâmetro e 10 mm de comprimento, e implantados em 2 bolsas criadas nas costas de 40 Calomys callosus roedores, 20 para cada material. Biópsias de tecido foram coletadas e examinadas histologicamente 15, 30, 60 e 90 dias após o procedimento de implantação. O nível geral da resposta inflamatória do tecido foi classificado como nenhuma, leve, moderada ou severa na interface selante–tecido conjuntivo nas extremidades abertas dos tubos. A resposta do tecido conjuntivo ao longo da parede lateral fora de cada tubo serviu como controle negativo.
Resultados. A reação do tecido ao Endométhasone diminuiu com o tempo. O selante EndoREZ foi altamente tóxico durante todos os períodos experimentais.
Conclusão. O selante de canal radicular Endométhasone apresentou biocompatibilidade dentro dos períodos analisados, enquanto o EndoREZ não mostrou comportamento biocompatível e causou reação hipersensível tardia. (Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2007;103:e88-e94)
O sucesso da terapia endodôntica depende de diagnósticos corretos, limpeza eficaz, eliminação da infecção e obturação adequada dos canais radiculares. A reação do tecido periapical após o tratamento de canal radicular pode ser influenciada por vários fatores, dependendo da natureza química do selante endodôntico. Atualmente, os selantes endodônticos utilizados na prática clínica são à base de resina, óxido de zinco-eugenol, ionômero de vidro, silicone e hidróxido de cálcio. Os selantes à base de resina estão ganhando cada vez mais popularidade, mas estudos demonstraram que alguns desses selantes apresentam toxicidade e mutagenicidade. Apesar da grande variedade de selantes disponíveis, ainda não foi encontrado um selante de canal radicular que possua todas as propriedades físicas e biológicas desejáveis. A biocompatibilidade é uma das propriedades mais importantes dos materiais de preenchimento radicular8, uma vez que a liberação de certas substâncias pelos selantes pode gerar diferentes reações nos tecidos periapicais. As reações teciduais causadas por materiais endodônticos são normalmente investigadas por estudos histológicos após a implantação do material em tecido animal. Endométhasone (Spécialities Septodont, Saint-Maur-des-Fossés, França) é um selante à base de óxido de zinco-eugenol que foi previamente avaliado em vários estudos sobre suas propriedades biológicas. Recentemente, um novo selante endodôntico à base de metacrilato, EndoREZ (Ultradent Products Inc., South Jordan, UT, EUA), foi introduzido e suas propriedades biológicas foram pouco investigadas.
O objetivo deste estudo foi avaliar a reação do tecido conjuntivo subcutâneo aos selantes de canal radicular EndoREZ e Endométhasone, seguindo os requisitos recomendados pela FDI.
Métodos
O protocolo para este experimento foi aprovado pelo Comitê de Ética em Pesquisa da Universidade de Uberlândia, e o experimento foi realizado de acordo com a Política do Serviço de Saúde Pública dos EUA sobre Cuidado e Uso Humanitário de Animais de Laboratório. Quarenta roedores machos Calomys callosus (Rodentia, Cricetidae), pesando de 150 a 200 g, foram utilizados. Os espécimes foram divididos em 2 grupos de 20 animais cada para os selantes de canal radicular Endométhasone e EndoREZ. A Tabela I mostra os materiais, fabricantes e principais componentes.
Todos os materiais foram preparados da maneira aconselhada pelos fabricantes para seu uso clínico e carregados em suportes de Teflon autoclavados (politetrafluoretileno, Du-Pont, Habia, Knivsta, Suécia), com 10 mm de comprimento, um único lúmen e um diâmetro interno de 1 mm, garantindo que o ar não fosse aprisionado.
Os animais foram anestesiados intraperitonealmente com 0,2 mL de cetamina contendo acepromazina em uma proporção de 1:1. A pele dorsal foi raspada, desinfetada com 5% de tintura de iodo, e pequenas incisões, aproximadamente 15 mm de comprimento, foram feitas com uma lâmina, em ambos os lados do dorso. Dois bolsos separados foram criados por dissecação romba para implantar os tubos no tecido subcutâneo a uma profundidade de ~15 mm. Os tubos contendo selantes recém-misturados foram então colocados nos bolsos direito e esquerdo preparados em cada animal. Cuidado foi tomado para evitar o derramamento dos materiais no tecido. Após a implantação, as feridas foram suturadas.
Os animais foram sacrificados em grupos de 5 após 15, 30, 60 e 90 dias por meio de sufocação com dióxido de carbono, garantindo mínimo desconforto e estresse. Os tubos foram excisados juntamente com a pele e o tecido conjuntivo ao redor deles. As amostras foram imersas em formalina a 10% em solução tampão fosfato 0,1 mol/L por 24 horas, desidratadas em soluções de etanol graduadas à temperatura ambiente e incorporadas em metacrilato de glicol (Historesin; Leica Microsystems, Nussloch GmbH, Alemanha). Para a seção transversal, os blocos foram orientados paralelamente ao eixo longo do tubo. As seções foram cortadas com uma espessura de 3 µm e coradas com azul de toluidina a 1%. As seções histológicas foram analisadas em diferentes ampliações sob um microscópio de luz, observando as reações do tecido na interface selante–tecido conjuntivo nas extremidades abertas dos tubos. A resposta do tecido conjuntivo ao longo da parede lateral fora dos tubos serviu como controle negativo.
A interface na abertura do copo entre o material e o osso foi examinada e avaliada quanto à intensidade da inflamação. A avaliação dos critérios da Fédération Dentaire International (FDI) é exclusivamente qualitativa, e nenhum índice de pontuação foi utilizado. Assim, o nível geral da reação tecidual foi classificado como nenhum, leve, moderado ou severo, dependendo da presença ou ausência de leucócitos neutrofílicos, macrófagos, linfócitos, células plasmáticas, células gigantes de corpo estranho, material disperso, cápsula, osso saudável recém-formado, tecido necrótico e reabsorção. O nível geral da resposta tecidual inflamatória foi classificado da seguinte forma: 1) nenhum/leve: espessura da zona de reação semelhante ou apenas ligeiramente mais ampla do que a espessura ao longo do tubo lateral, com poucas ou nenhuma célula inflamatória; 2) moderado: zona de reação aumentada na qual macrófagos, células plasmáticas ou ambos estão presentes; e 3) severo: zona de reação aumentada na qual macrófagos e células plasmáticas e focos ocasionais de granulócitos neutrofílicos, linfócitos ou ambos estão presentes.
As interpretações dos resultados foram baseadas nos seguintes critérios da FDI: reação nenhuma a leve em 2 e 12 semanas é aceitável; reação nenhuma a leve em 2 semanas que aumenta para reação moderada ou severa em 12 semanas não é aceitável; reação moderada em 2 e 12 semanas não é aceitável; reação moderada em 2 semanas que diminui em 12 semanas é aceitável; e uma reação severa em qualquer período é inaceitável.
Resultados
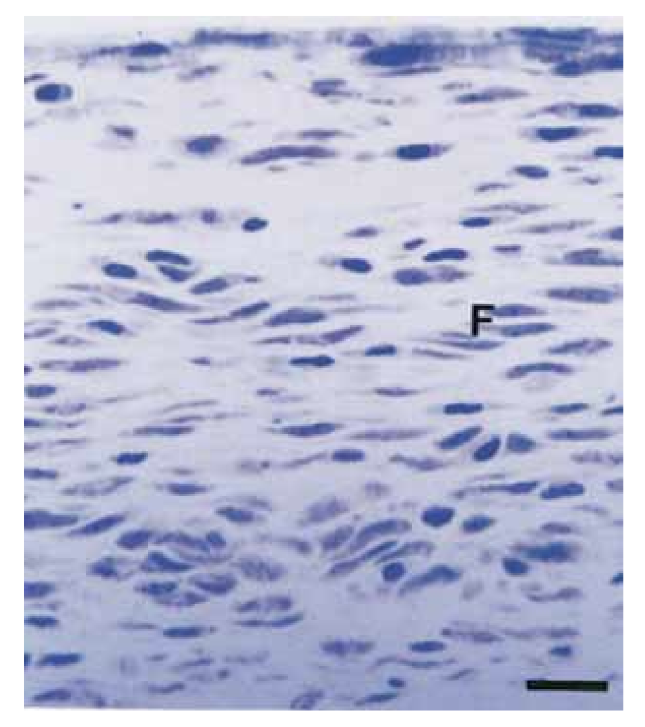
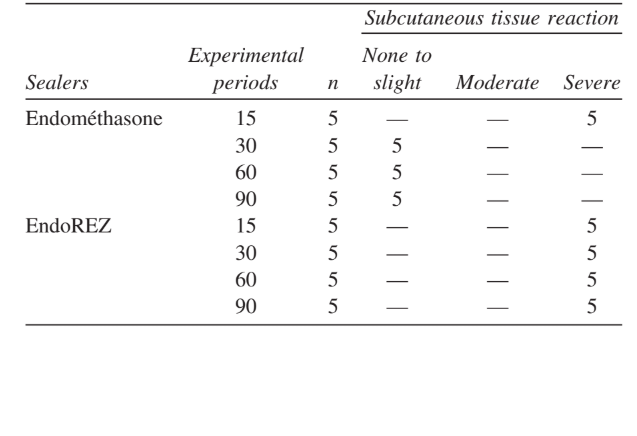
A intensidade da resposta inflamatória em todos os períodos experimentais de ambos os selantes foi analisada. A resposta do tecido conjuntivo ao longo da parede lateral fora dos tubos de Teflon serviu como controle negativo para a técnica e não mostrou reação inflamatória em todos os períodos de experimentação (Fig. 1). Os números das amostras em cada categoria inflamatória nos diferentes períodos de tempo para os 2 tipos de selantes estão apresentados na Tabela II.
Endométhasone
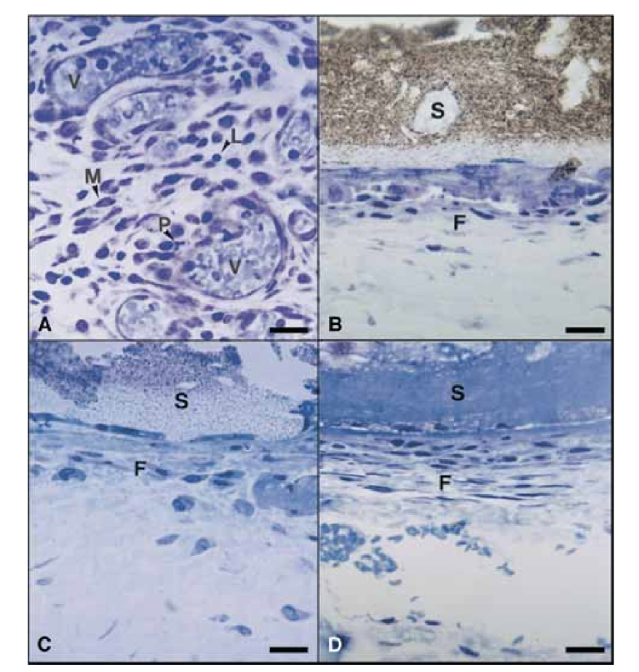
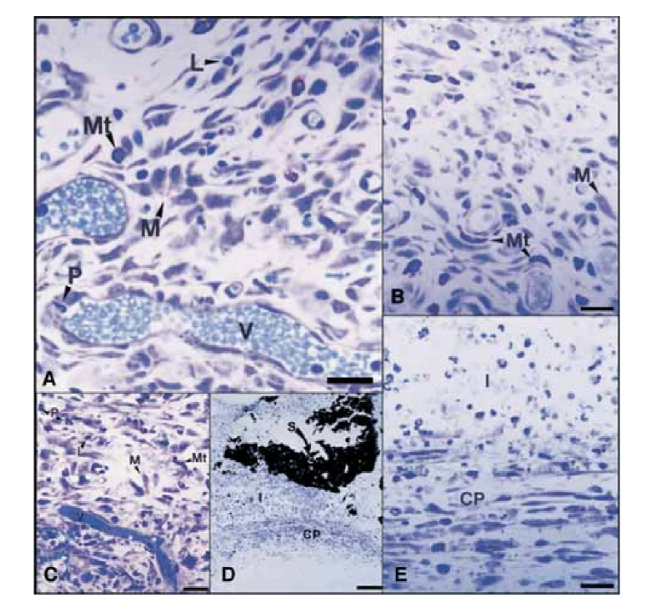
No 15º dia, uma reação inflamatória moderada a severa foi observada. O tecido estava infiltrado predominantemente com macrófagos e linfócitos. A presença de leucócitos polimorfonucleares, hiperemia e uma matriz extracelular morfologicamente alterada também foi observada (Fig. 2, A). No 30º, 60º e 90º dias, o tecido conjuntivo não apresentou reação inflamatória (Fig. 2, B, C e D).
EndoREZ
No 15º dia, uma reação inflamatória moderada a severa foi observada. O tecido estava infiltrado predominantemente com macrófagos, alguns leucócitos polimorfonucleares e linfócitos. Hiperemia vascular e uma matriz extracelular reduzida e morfologicamente alterada também foram observadas (Fig. 3, A). A partir do 30º dia, uma reação inflamatória severa foi observada e um infiltrado inflamatório consistindo predominantemente de leucócitos polimorfonucleares, linfócitos e macrófagos parecia estar invadindo o lúmen dos tubos de Teflon. Além disso, na interface entre o selante e o tecido conjuntivo, vasos sanguíneos rodeados por células mastocitárias foram observados (Fig. 3, B). No 60º dia, uma reação inflamatória severa com macrófagos, linfócitos e leucócitos polimorfonucleares ainda persistia. Na abertura dos tubos de Teflon, o selante foi substituído por um infiltrado inflamatório com macrófagos e linfócitos predominantes. Vasos sanguíneos congestos rodeados por células mastocitárias foram observados (Fig. 3, C). Uma proliferação fibroblástica consistente ao redor do tecido inflamatório também foi detectada. No 90º dia, um infiltrado inflamatório severo consistindo de macrófagos, linfócitos, leucócitos polimorfonucleares, células vermelhas e células mortas invaginou-se no lúmen dos tubos de Teflon, substituindo o selante, foi observado. Na extremidade de abertura dos tubos, o tecido granulomatoso foi isolado por encapsulamento fibroso (Fig. 3, D e E).
Discussão
Quando um novo material é introduzido no mercado, ou um material existente é proposto para uma aplicação diferente, suas propriedades devem ser investigadas e os resultados comparados com os de outros autores. Nos Estados Unidos, a Food and Drug Administration (FDA) é responsável por avaliar e avaliar os efeitos biológicos de todos os medicamentos, materiais e dispositivos utilizados em seres humanos, incluindo a maioria dos produtos e dispositivos dentais. A FDA também prevê o reconhecimento de padrões estabelecidos por organizações privadas, como a ANSI/ADA. A revisão das primeiras Práticas Padrão Recomendadas para Avaliação Biológica de Materiais Dentais foi adiada para incorporar os elementos essenciais das recomendações da FDA. Este novo documento não tinha a intenção de desencorajar o desenvolvimento industrial de novos e melhores produtos dentais ao exigir testes biológicos excessivos, mas, nesta era de preocupação com perigos químicos, um perfil de toxicidade para todos os novos e melhorados materiais deve ser desenvolvido para obter dados relevantes sobre segurança e eficácia. Embora nenhum estudo experimental possa garantir segurança absoluta para qualquer substância, investigações toxicológicas fornecem dados a partir dos quais projeções e previsões razoáveis podem ser feitas sobre as condições sob as quais o agente pode ser usado com segurança.
Embora muitos testes, como citotoxicidade, hemólise, teste de Ame, transformação celular de Styles, implantações subcutâneas e ósseas, sensibilização e uso endodôntico, estejam listados para vários níveis de teste, nem todos são necessários para cada produto. Um julgamento deve ser feito quanto a quais testes são relevantes. Os testes iniciais têm como objetivo fornecer um perfil de toxicidade em um sistema biológico, de modo que, em uma base de comparação, o fabricante tenha uma apreciação e realização aproximadas de onde o produto se encontra. Para a FDA, dispositivos regulamentados se enquadram em 3 classes, no entanto, a maioria dos dispositivos e aparelhos dentais não estaria sujeita a definição de padrões para autorização pré-mercado. Em outras palavras, às vezes, até mesmo testes básicos de segurança não são necessários antes que os produtos possam ser promovidos para uso clínico.
A biocompatibilidade dos materiais dentais é um requisito importante porque os componentes tóxicos presentes nesses materiais podem produzir irritação ou até mesmo degeneração dos tecidos circundantes, especialmente quando acidentalmente extrudados nos tecidos perirradiculares. A implantação de tecido conjuntivo subcutâneo em animais é um dos métodos mais confiáveis para avaliar a biocompatibilidade dos materiais dentais, pois reações inflamatórias são características de todos os tecidos conjuntivos. O roedor selvagem semelhante a um camundongo Calomys callosus é comumente usado para investigar infecção experimental e resposta imune humoral e foi utilizado no presente estudo devido à sua reprodutibilidade como um modelo estabelecido amplamente aceito na literatura.
As amostras foram embutidas em metacrilato de glicol devido às suas vantagens em comparação com a parafina, como produzir menos distorção, fornecer seções finas que oferecem boa definição celular, permitir a preparação de seções sem remoção dos tubos e coloração com boa qualidade e poucos artefatos técnicos, favorecendo uma avaliação mais precisa da reação inflamatória.
No presente estudo, o tecido conjuntivo ao longo da parede lateral serviu como controle negativo e não apresentou reações inflamatórias (Fig. 1), demonstrando a biocompatibilidade do Teflon e que a reação inflamatória na abertura do tubo estava relacionada ao material estudado.
As propriedades biológicas da Endométhasone, um selante de canal radicular à base de óxido de zinco–eugenol (ZOE), foram previamente estudadas em relação à atividade antibacteriana, citotoxicidade e biocompatibilidade tecidual. O eugenol (4-alil-2-metoxifenol) é um extrato de óleo de cravo amplamente utilizado na odontologia como agente terapêutico, mais comumente como componente do cimento de óxido de zinco–eugenol aplicado como base ou curativo temporário para a dentina ou como selante de canal radicular. Vários estudos foram relatados sobre a influência histopatológica dos selantes de canal radicular à base de ZOE nos tecidos. O eugenol que se infiltra dos selantes de canal radicular à base de ZOE pode participar do desenvolvimento de inflamação periapical ou da continuidade de uma lesão periapical pré-existente.
No presente estudo, as reações inflamatórias do tecido subcutâneo ao Endométhasone diminuíram com o tempo, de forma semelhante aos resultados obtidos por Kaplan et al., provavelmente devido à neutralização do eugenol liberado no início e pela liberação local de corticoides como a dexametasona e a hidrocortisona. Muitos investigadores sugeriram que a capacidade irritativa dos selantes à base de ZOE poderia ser atribuída principalmente ao eugenol e secundariamente aos íons de zinco. O eugenol pode inibir a função dos macrófagos e pode influenciar as reações inflamatórias nos tecidos periapicais. O paraformaldeído demonstrou causar reações alérgicas e necrose do tecido conjuntivo. No entanto, apesar da alta concentração de paraformaldeído no selante Endométhasone, no presente estudo tais achados não foram observados.
Recentemente, um novo selante endodôntico à base de metacrilato foi introduzido como um selante de canal radicular. EndoREZ é um material hidrofílico, de 2 componentes, de configuração química contendo óxido de zinco, sulfato de bário, resinas e pigmentos em uma matriz de resina de dimetacrilato de urethane.
As propriedades biológicas do EndoREZ foram previamente investigadas em relação à sua citotoxicidade e biocompatibilidade tecidual. Estudos sobre a biocompatibilidade tecidual de selantes à base de resina mostraram reações inflamatórias moderadas a severas. No presente estudo, o EndoREZ causou reações inflamatórias severas em todos os períodos experimentais. Como a vida média de um neutrófilo fora do vaso sanguíneo é de 7 dias, a presença de células polimorfonucleares em todos os períodos experimentais sugere um comportamento tóxico deste material. Usando células cultivadas, foi demonstrado que o EndoREZ se tornou mais citotóxico com o tempo de exposição e apresentou riscos citotóxicos significativos quando recém misturado. A reação do tecido conjuntivo a tubos de silicone preenchidos com EndoREZ implantados no tecido subcutâneo de ratos mostrou uma reação severa que alterou significativamente seu perfil após 30 dias, com uma reação moderada após 3 meses e ausência de inflamação após 4 meses. No entanto, também foi relatado que, em alguns animais, a resposta inflamatória persistiu em todos os períodos experimentais. Considerou-se que, após a implantação subcutânea de EndoREZ fresco, componentes como zinco e bário estavam em contato direto com o tecido e causaram a severa reação inicial. Em contraste com os resultados da presente pesquisa, Zmener et al. demonstraram uma resposta satisfatória do tecido ósseo no período de observação de 60 dias do EndoREZ implantado nas tíbias de ratos. A lenta degradação do selante EndoREZ, ilustrada pelo material disperso, e a subsequente endocitose por macrófagos, podem ter sido a causa de tal inflamação crônica persistente. Além disso, a terapia de canal radicular realizada com cones de guta-percha condensados lateralmente em conjunto com EndoREZ parece apresentar uma boa taxa de sucesso geral após avaliação de 14-24 meses.
Além disso, no presente estudo, foi observada a presença de muitas células mastocitárias no tecido conjuntivo, principalmente na área circundante dos vasos sanguíneos, nos períodos de 30, 60 e 90 dias, sugerindo uma reação hipersensível tardia aos componentes do EndoREZ. Embora a reação hipersensível tardia a materiais endodônticos não seja frequentemente relatada, essas reações sistêmicas adversas, que ocorrem com mais frequência do que relatado na literatura, não devem ser descartadas. De acordo com Bratel et al., materiais endodônticos podem induzir uma reação hipersensível tardia mesmo em concentrações sub-tóxicas.
Conclusão
De acordo com os critérios da FDI, os resultados obtidos no presente estudo permitiram a conclusão de que o selante de canal radicular Endométhasone apresentou biocompatibilidade dentro dos períodos analisados, enquanto o EndoREZ não mostrou comportamento biocompatível e uma sugestão de reação hipersensível tardia.
Autores: Edilson José Zafalon, Marco Aurélio Versiani, Cássio José Alves de Souza, Camila Christian Gomes Moura, Paula Dechichi
Referências:
- Bernath M, Szabo J. Reação tecidual iniciada por diferentes selantes. Int Endod J 2003;36:256-61.
- Bouillaguet S, Wataha JC, Lockwood PE, Galgano C, Golay A, Krejci I. Citotoxicidade e propriedades de selagem de quatro classes de selantes endodônticos avaliadas pela atividade da desidrogenase succínica e microscopia de varredura a laser confocal. Eur J Oral Sci 2004; 112:182-7.
- Kaplan AE, Ormaechea MF, Picca M, Canzobre MC, Ubios AM. Propriedades reológicas e biocompatibilidade de selantes endodônticos. Int Endod J 2003;36:527-32.
- Hauman CH, Love RM. Biocompatibilidade de materiais dentários usados na terapia endodôntica contemporânea: uma revisão. Parte 2. Materiais de preenchimento de canal radicular. Int Endod J 2003;36:147-60.
- Gençoĝlu N, Turkmen C, Ahiskali R. Um novo selante de canal radicular à base de silício (Roekoseal-Automix). J Oral Rehabil 2003;30:753-7.
- Zmener O, Banegas G, Pameijer CH. Resposta do tecido ósseo a um selante endodôntico à base de metacrilato: um estudo histológico e histométrico. J Endod 2005;31:457-9.
- Huang TH, Yang JJ, Li H, Kao CT. A avaliação da biocompatibilidade de selantes de canal radicular à base de resina epóxi in vitro. Biomaterials 2002;23:77-83.
- Ozbas H, Yaltirik M, Bilgic B, Issever H. Reações do tecido conjuntivo a compômeros, compósitos e materiais de preenchimento de raiz. Int Endod J 2003;36:281-7.
- Ho Y-C, Huang F-M, Chang Y-C. Mecanismos de citotoxicidade do eugenol em células osteoblásticas humanas in vitro. Int Endod J 2006;39:389-93.
- Hauman CH, Love RM. Biocompatibilidade de materiais dentários usados na terapia endodôntica contemporânea: uma revisão. Parte 1. Medicamentos e substâncias intracanais. Int Endod J 2003;36:75-85.
- Sousa CJ, Loyola AM, Versiani MA, Biffi JC, Oliveira RP, Pascon EA. Uma avaliação histológica comparativa da biocompatibilidade de materiais usados em cirurgia apical. Int Endod J 2004;37:738-48.
- Tepel J, Darwisch el Sawaf M, Hoppe W. Reação do tecido periapical inflamado a medicamentos intracanais e selantes de canal radicular. Endod Dent Traumatol 1994;10:233-8.
- Gerosa R, Menegazzi G, Borin M, Cavalleri G. Avaliação da citotoxicidade de 6 selantes de canal radicular. J Endod 1995;21:446-8.
- Vajrabhaya L, Sithisarn P. Culturas celulares em múltiplas camadas e monocamadas em um ensaio de citotoxicidade de selantes de canal radicular. Int Endod J 1997;30:141-4.
- Bratel J, Jontell M, Dahlgren U, Bergenholtz G. Efeitos de selantes de canal radicular em células imunocompetentes in vitro e in vivo. Int Endod J 1998;31:178-88.
- Serper A, Ucer O, Onur R, Etikan I. Efeitos neurotóxicos comparativos de materiais de preenchimento de canal radicular no nervo ciático de ratos. J Endod 1998;24:592-4.
- Ersev H, Schmalz G, Bayirli G, Schweikl H. Potências citotóxicas e mutagênicas de vários materiais de preenchimento de canal radicular em células eucarióticas e procarióticas in vitro. J Endod 1999;25:359-63.
- Telli C, Serper A, Dogan AL, Guc D. Avaliação da citotoxicidade de selantes de canal radicular à base de fosfato de cálcio pelo ensaio MTT. J Endod 1999;25:811-3.
- Huang FM, Tai KW, Chou MY, Chang YC. Citotoxicidade de selantes de canal radicular à base de resina, óxido de zinco-eugenol e hidróxido de cálcio em células do ligamento periodontal humano e células V79 permanentes. Int Endod J 2002;35:153-8.
- Schwarze T, Fiedler I, Leyhausen G, Geurtsen W. A compatibilidade celular de cinco selantes endodônticos durante o período de endurecimento. J Endod 2002;28:784-6.
- Schwarze T, Leyhausen G, Geurtsen W. Citocompatibilidade a longo prazo de vários selantes endodônticos usando um novo modelo de canal radicular. J Endod 2002;28:749-53.
- Gomes BP, Pedroso JA, Jacinto RC, Vianna ME, Ferraz CC, Zaia, AA, et al. Avaliação in vitro da atividade antimicrobiana de 5 selantes de canal radicular. Braz Dent J 2004;15:30-5.
- Perassi FT, Filho IB, Berbert FL, Carlos IZ, de Toledo Leonardo R. Secreção de fator de necrose tumoral-alfa por macrófagos peritoneais de camundongos na presença de selantes dentários, sealapex e endométhasone. J Endod 2004;30:534-7.
- Pizzo G, Giammanco GM, Cumbo E, Nicolosi G, Gallina G. Atividade antibacteriana in vitro de selantes endodônticos. J Dent 2006; 34:35-40.
- Zmener O. Resposta tecidual a um novo selante de canal radicular à base de metacrilato: observações preliminares no tecido conjuntivo subcutâneo de ratos. J Endod 2004;30:348-51.
- Zmener O, Pameijer CH. Avaliação clínica e radiográfica de um selante de canal radicular à base de resina. Am J Dent 2004;17:19-22.
- Louw NP, Pameijer CH, Norval G. Avaliação histopatológica de um selante de canal radicular em primatas subhumanos [resumo]. J Dent Res 2001;80:654.
- Fédération Dentaire International, Comissão de Materiais Dentários, Instrumentos, Equipamentos e Terapias. Práticas padrão recomendadas para avaliação biológica de materiais dentários. Int Dent J 1980;30:140-88.
- National Institutes of Health. Política do Serviço de Saúde Pública sobre cuidados e uso humanitário de animais de laboratório, 2006. Disponível em: http://grants.nih.gov/grants/olaw/references/phspol.htm.
- National Institutes of Health. Política do Serviço de Saúde Pública sobre cuidados e uso humanitário de animais de laboratório, esclarecimento sobre o uso de dióxido de carbono para eutanásia de pequenos animais de laboratório, 2006. Disponível em: http://grants.nih.gov/grants/olaw/ Compilation_of_Guidance.doc.
- Stanley HR. Testes de toxicidade de materiais dentários. 1ª ed. Miami: CRC Press; 1985.
- Sousa CJA, Montes CRM, Pascon EA, Loyola AM, Versiani MA. Comparação da biocompatibilidade intraóssea de selantes de canal radicular AH Plus, Endo-REZ e Epiphany. J Endod 2006;32:656-62.
- Huang FM, Tsai CH, Yang SF, Chang YC. Indução da expressão gênica de interleucina-6 e interleucina-8 por selantes de canal radicular em células osteoblásticas humanas. J Endod 2005;31:679-83.
- Olsson B, Sliwkowski A, Langeland K. Implantação subcutânea para a avaliação biológica de materiais endodônticos. J Endod 1981;7:355-67.
- de Oliveira L, Borges MM, Leal RC, Assreuy J, Kloetzel JK. Envolvimento do óxido nítrico na infecção experimental de Trypanosoma cruzi em Calomys callosus e camundongos suíços. Parasitol Res 1997;83:762-770.
- Tanisaki M, Ogawa K, Lapa SRC, Da Silva PMC, Watanabe I. Estudo morfométrico e de microscopia eletrônica de varredura de alta resolução do nervo palatino maior de Calomys callosus. Int J Morphol 2005;23:13-8.
- Dost CK, Saraiva J, Zentgraf U, Monesi N, Engels W, Albuquerque S. O óxido nítrico está envolvido na tolerância de Calomys callosus como um hospedeiro reservatório em relação à infecção por Trypanosoma cruzi? J Infect 2006;52:49-55.
- Taniwaki NN, Andreoli WK, Calabrese KS, da Silva S, Mortara RA. Disrupção de proteínas miofibrilares no músculo cardíaco de Calomys callosus cronicamente infectado com Trypanosoma cruzi e tratado com agente imunossupressor. Parasitol Res 2005;97:323-31.
- Martinez M, Milton FA, de Oliveira SA, de Lima NF, Segatelli TM, Pinheiro PF, et al. Alterações ultraestruturais na mucosa palatina dura de Calomys callosus após 120 dias de alcoolismo crônico experimental. J Submicrosc Cytol Pathol 2005;37:59-65.
- Carroll DS, Mills JN, Montgomery JM, Bausch DG, Blair PJ, Burans JP, et al. Síndrome pulmonar por hantavírus no centro da Bolívia: relações entre hospedeiros reservatórios, habitats e genótipos virais. Am J Trop Med Hyg 2005;72:42-6.
- Gomes-Filho JE, Gomes BP, Zaia AA, Novaes PD, Souza-Filho FJ. Metacrilato de etileno: um método alternativo para embutir implantes subcutâneos. J Endod 2001;27:266-8.
- Pascon EA, Leonardo MR, Safavi K, Langeland K. Reação tecidual a materiais endodônticos: métodos, critérios, avaliação e observações. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1991;72:222-37.
- Holland R, Otoboni Filho JA, Bernabé PF, Nery MJ, de Souza V, Berbert A. Efeito do estado do canal radicular na cicatrização periodontal após lesão cirúrgica em cães. Endod Dent Traumatol 1994;10:77-82.
- Hume WR. Efeito do eugenol na respiração e divisão da polpa humana, fibroblastos de camundongo e células hepáticas in vitro. J Dent Res 1984;63:1262-5.
- Gulati N, Chandra S, Aggarwal PK, Jaiswal JN, Singh M. Citotoxicidade do eugenol em selante contendo óxido de zinco. Endod Dent Traumatol 1991;7:181-5.
- Neff T, Layman D, Jeansonne BG. Avaliação da citotoxicidade in vitro de selantes endodônticos expostos ao calor antes do ensaio. J Endod 2002;28:811-4.
- Ioannis K, Nikolaos E. Comparação in vivo da biocompatibilidade de 2 selantes de canal radicular implantados no tecido conjuntivo subcutâneo de ratos. J Endod 1998;24:82-5.
- Nikolaos E, Ioannis K. Estudo experimental da biocompatibilidade de quatro selantes de canal radicular e sua influência no conteúdo de zinco e cálcio de vários tecidos. J Endod 1995;21:122-7.
- Segura JJ, Jimenez-Rúbio A. Efeito do eugenol na adesão de macrófagos in vivo a superfícies plásticas. Endod Dent Traumatol 1998;14:72-4.
- de Oliveira Mendes ST, Ribeiro Sobrinho AP, de Carvalho AT, de Souza Cortes MI, Vieira LQ. Avaliação in vitro da citotoxicidade de dois selantes de canal radicular na atividade de macrófagos. J Endod 2003;29:95-9.
- Di Felice R, Lombardi T. Necrose gengival e do osso mandibular causada por uma pasta contendo paraformaldeído. Endod Dent Traumatol 1998;14:196-198.
- Cotran RS, Kumar V, Robbins SL. Base patológica da doença: eventos celulares. 5ª ed. Philadelphia: Saunders; 1994.
- el Sayed F, Seite-Bellezza D, Sans B, Bayle-Lebey P, Marguery MC, Bazex J. Urticária de contato por formaldeído em uma pasta dentária de canal radicular. Contact Dermatitis 1995;33:353.
- Ebner H, Kraft D. Anaphylaxis induzida por formaldeído após tratamento dentário? Contact Dermatitis 1991;24:307-9.
Para continuar aprendendo e ter acesso a todos os outros artigos, entre ou crie uma conta
Ou faça login / crie uma conta aqui:

/social-network-service/media/default/6758/89a8282e.png)