Impacto da profundidade de inserção da agulha na remoção de detritos de tecido duro
Tradução automática
O artigo original está escrito em EN language (link para lê-lo).
Resumo
Objetivo: Avaliar o efeito da profundidade de inserção da ponta da agulha de irrigação na remoção de detritos de tecido duro usando imagem de microtomografia computadorizada (micro-CT).
Metodologia: Vinte raízes mesiais de molares mandibulares contendo istmo foram pareadas anatomicamente com base em dimensões morfológicas semelhantes usando avaliação de micro-CT e atribuídas a dois grupos (n = 10), de acordo com a profundidade da ponta da agulha de irrigação durante a preparação biomecânica: 1 ou 5 mm antes do comprimento de trabalho (WL). A preparação foi realizada com o arquivo Reciproc R25 (tamanho da ponta 25, .08 taper) e 5,25% de NaOCl como irrigante. A lavagem final foi com 17% de EDTA seguida de água bidistilada. Em seguida, as amostras foram escaneadas novamente, e as imagens pareadas dos canais, antes e depois da preparação, foram examinadas para quantificar a quantidade de detritos de tecido duro, expressa como o volume percentual do volume inicial do canal radicular. Os dados foram comparados estatisticamente usando o teste U de Mann–Whitney.
Resultados: Nenhuma das profundidades de inserção da agulha testadas resultou em canais radiculares completamente livres de detritos de tecido duro. A profundidade de inserção exerceu uma influência significativa na remoção de detritos, com uma redução significativa no volume percentual de detritos de tecido duro quando a agulha foi inserida 1 mm antes do WL (P < 0,05).
Conclusões: A profundidade de inserção das agulhas de irrigação influenciou significativamente a remoção de detritos de tecido duro. A ponta da agulha posicionada 1 mm antes do WL resultou em níveis percentuais de remoção de detritos de tecido duro quase três vezes maiores do que quando posicionada a 5 mm do WL.
Introdução
Um passo importante para o sucesso do tratamento de canal radicular é a remoção de detritos orgânicos e inorgânicos que, em um sistema de canal radicular infectado, podem conter bactérias e servir como um nidus para reinfecção (Versiani et al. 2016). Esse objetivo pode ser alcançado pela combinação de preparação mecânica com irrigação química para controlar ou eliminar os agentes causadores da periodontite apical (Kahn et al. 1995, Lee et al. 2004). No entanto, grandes áreas de paredes de canal não tocadas (Peters et al. 2001) e acúmulo de detritos de tecido duro em fins, istmos, irregularidades e ramificações foram relatados por vários autores como um efeito indesejável da preparação mecânica (Paqué et al. 2009, De-Deus et al. 2015, Versiani et al. 2016). Portanto, a irrigação minuciosa do sistema de canal radicular é de extrema importância para remover detritos infectados (Haapasalo et al. 2010, Boutsioukiset al. 2014).
A principal limitação das técnicas de irrigação atuais é a dificuldade de espalhar e enxaguar a solução em estruturas anatômicas limitadas e estreitas do sistema de canal radicular, como istmos ou barbatanas (Versiani et al. 2015). A eficácia da dinâmica dos fluidos da solução irrigante durante a preparação quimomecânica depende de muitas variáveis, como a anatomia do canal, o sistema de entrega, volume, fluxo e tipo de agente irrigante, bem como o tipo e diâmetro da agulha de irrigação (Abou-Rass & Piccinino 1982,Kahn et al. 1995). Apesar de extensas pesquisas sobre técnicas de irrigação e agitação, a seringa e agulha convencionais ainda são o método de irrigação mais comumente utilizado (Shen et al. 2010, Thomas et al. 2014). Nesta técnica, o reabastecimento e a troca de irrigantes dependem da profundidade da agulha, o que também pode afetar a remoção de detritos duros acumulados (Abou-Rass & Piccinino 1982,Chow 1983, Albrecht et al. 2004, Sedgley et al. 2005, Hsieh et al. 2007). No entanto, permanece incerto qual deve ser a profundidade ideal de penetração da agulha para alcançar uma estratégia de desbridamento segura e eficaz e estabelecer diretrizes baseadas em evidências para a irrigação do canal radicular.
Recentemente, vários autores se concentraram no estudo de detritos de tecido duro acumulados em recessos, istmos, irregularidades e ramificações usando imagens de microtomografia computadorizada (micro-CT) (Paqué et al. 2009, 2011, 2012, Robinson et al.
2013, De-Deus et al. 2015, Versiani et al. 2016); no entanto, nenhum deles avaliou o efeito da profundidade de inserção da ponta da agulha na remoção de detritos de tecido duro. Assim, o presente estudo foi projetado para avaliar o efeito da posição da ponta da agulha de irrigação na remoção de detritos de tecido duro em canais radiculares mesiais de molares mandibulares usando micro-CT. A imagem de micro-CT permite monitorar o acúmulo e a remoção de estruturas radiopacas no espaço principal do canal radicular e seus recessos e istmos durante e após a instrumentação (Robinson et al. 2012, De-Deus et al. 2014, 2015) enquanto preserva a integridade da amostra. A hipótese testada foi que a profundidade de inserção da ponta da agulha de irrigação não tem um impacto significativo na remoção de detritos de tecido duro.
Materiais e métodos
Estimativa do tamanho da amostra
Um a priori teste de Wilcoxon–Mann–Whitney foi selecionado da família dos testes t no software G*Power 3.1 para Mac (Heinrich Heine, Universität Düsseldorf). Com base em dados de um estudo anterior avaliando a acumulação de detritos de tecido duro após procedimentos de irrigação (Versiani et al. 2016), o tamanho do efeito para este estudo foi estabelecido (=1,87). Um erro tipo alfa de 0,05, potência beta de 0,95 e razão de alocação N2/N1 de 1 também foram especificados. Um total de 18 amostras (nove por grupo) foi indicado como o tamanho ideal necessário para observar diferenças significativas.
Seleção de espécimes
Este estudo foi revisado e aprovado pelo Comitê de Ética, Núcleo de Estudos em Saúde Coletiva (protocolo n° 2223 – CEP/HUPE). Cento e seis primeiros e segundos molares humanos mandibulares com raízes mesiais moderadamente curvadas (10–20°) foram selecionados de um conjunto de dentes extraídos e armazenados em uma solução de timol a 0,1% a 5 °C. Radiografias digitais tiradas em direção bucolingual foram usadas para calcular o ângulo da curvatura usando o software AxioVision 4.5 (Carl Zeiss Vision GmbH, Hallbergmoos, Alemanha), de acordo com o método de Schneider (Schneider 1971).
Os dentes foram pré-escanados em um dispositivo de micro-CT (SkyScan 1173; Bruker micro-CT, Kontich, Bélgica) usando uma resolução isotrópica de 70 lm a 70 kV e 114 mA para obter um contorno pré-tratamento dos canais radiculares. Seguindo Fan et al. (2010), 20 espécimes com raízes mesiais com istmos tipo I (fita estreita e conexão completa existente entre dois canais) ou III (istmo incompleto existente acima ou abaixo de um istmo completo) foram selecionados. Em seguida, os espécimes foram escaneados novamente com uma resolução isotrópica aumentada de 14,16 lm através de uma rotação de 360° ao redor do eixo vertical com um passo de rotação de 0,5°, tempo de exposição da câmera de 7000 milissegundos e média de quadros de 5, usando um filtro de alumínio de 1,0 mm de espessura. As imagens adquiridas foram reconstruídas em cortes transversais com o software NRecon v.1.6.9 (Bruker micro-CT) usando parâmetros padronizados para endurecimento do feixe (40%), correção de artefato de anel (10) e limites de contraste semelhantes. O volume de interesse foi selecionado para se estender do nível de furca até o ápice da raiz, resultando na aquisição de 700–800 cortes transversais por dente.
Subsequentemente, raízes mesiais foram emparelhadas para criar dois grupos de 10 raízes cada, com base na configuração do canal radicular, aspectos morfológicos tridimensionais (3D) dos canais (volume e área de superfície), grau de curvatura e comprimento da raiz. Uma raiz de cada grupo foi atribuída aleatoriamente a um dos dois grupos (n = 10) de acordo com a profundidade de inserção da agulha de irrigação: 1 ou 5 mm abaixo do comprimento de trabalho (WL). Após verificar a suposição de normalidade (teste de Shapiro–Wilk) e homogeneidade (teste de Levene) dos grupos em relação ao volume do canal radicular e área de superfície, grau de curvatura e comprimento da raiz, o emparelhamento anatômico entre os grupos foi estatisticamente confirmado (P > 0.05; teste t para amostras independentes).
Preparação do canal radicular
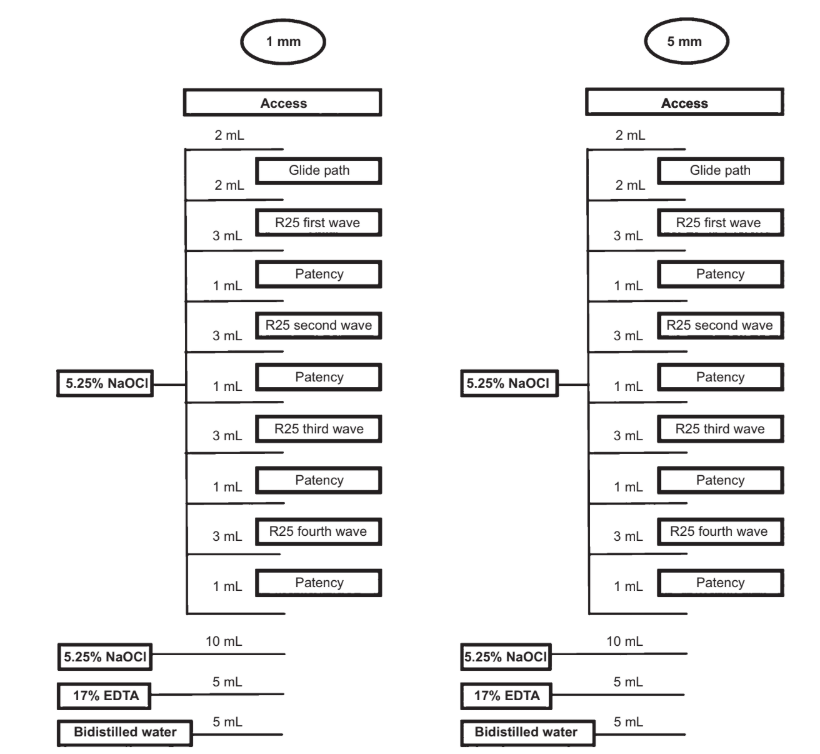
Um único operador experiente realizou todos os procedimentos. Após a preparação da cavidade de acesso, o WL foi determinado passando um K-file tamanho 10 (Dentsply Maillefer, Ballaigues, Suíça) através do forame maior e retirando-o 1,0 mm. Em seguida, o forame apical de cada raiz foi selado com cola quente e embutido em polissiloxano para criar um sistema de extremidade fechada (Susin et al. 2010). Um caminho de deslizamento foi estabelecido ao explorar um K-file de aço inoxidável tamanho 15 (Dentsply Maillefer) até o WL. Então, os canais radiculares foram preparados com o arquivo Reciproc R25 tamanho 25, .08 taper (VDW, Munique, Alemanha), acionado por um motor elétrico (motor VDW Silver; VDW) de acordo com as instruções do fabricante. Cada instrumento foi utilizado para ampliar quatro canais radiculares, e quatro ondas de instrumentação foram realizadas para preparar cada canal radicular. O WL foi alcançado na quarta onda para todos os canais.
Durante a preparação biomecânica, um total de 30 mL de NaOCl a 5,25% foi entregue a uma taxa de fluxo de 2 mL min—1 por uma bomba peristáltica VATEA (ReDent-Nova, Ra’anana, Israel) conectada a uma agulha ventosa lateral de 30 gauge (Maxi-Probe; Dentsply Rinn, Elgin, IL, EUA) colocada sem obstrução até 1 ou 5 mm abaixo do WL, de acordo com cada grupo. Cada canal radicular foi irrigado com 2 mL de NaOCl após os procedimentos de acesso e de caminho de deslizamento, respectivamente. Em seguida, 3 mL de NaOCl foram utilizados após cada onda de instrumentação e 1 mL de NaOCl após a patente. Após a preparação, uma enxaguagem adicional com 10 mL de NaOCl foi realizada, seguida por 5 mL de EDTA a 17% (pH = 7,7) entregues a uma taxa de fluxo de 1 mL min—1 por 5 min. Finalmente, uma enxaguagem de 5 min com 5 mL de água bidistilada foi utilizada na irrigação final para eliminar o EDTA.
Assim, o volume total de soluções irrigantes por canal foi de 40 mL, em um tempo total de 25 min (Fig. 1). A aspiração do irrigante foi realizada no nível dos orifícios dos canais radiculares com um SurgiTip (Ultradent Products Inc., South Jordan, UT, EUA) conectado a uma bomba de sucção de alta velocidade. Em seguida, os canais foram secos com pontos de papel absorvente (Dentsply Maillefer), reimagens foram feitas com um sistema de micro-CT e reconstruídas com os mesmos parâmetros utilizados nas varreduras pré-tratamento.
Análise tridimensional quantitativa
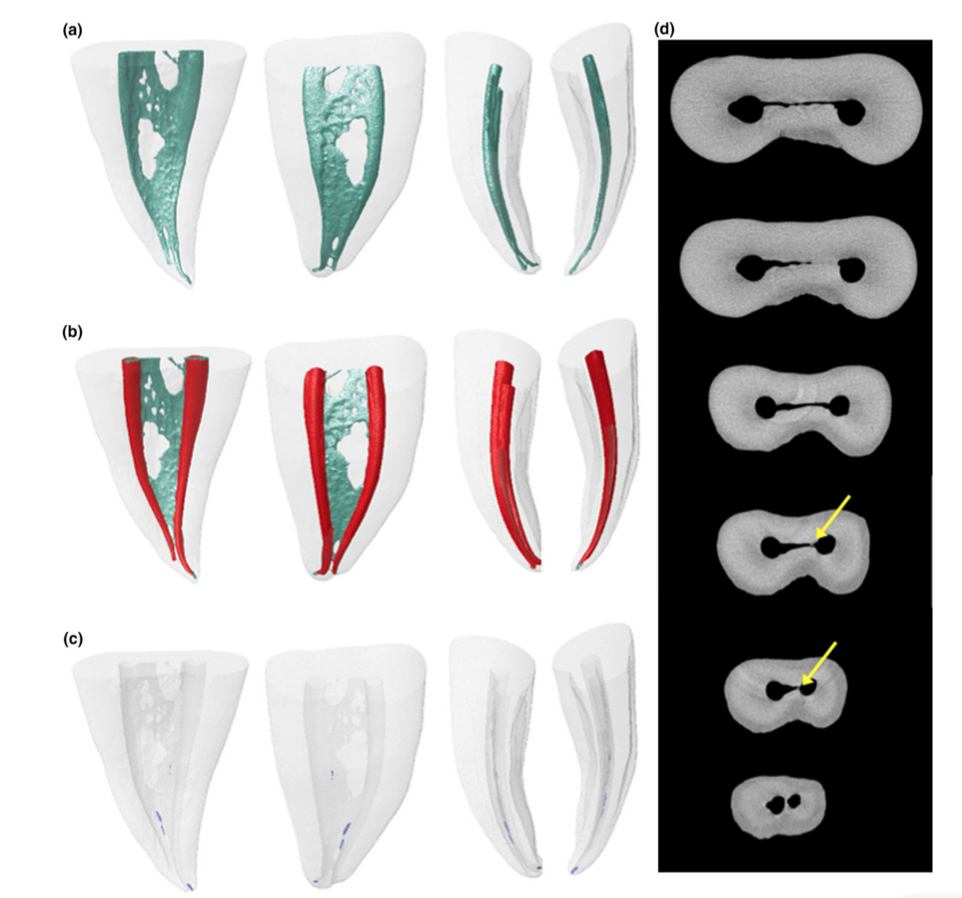
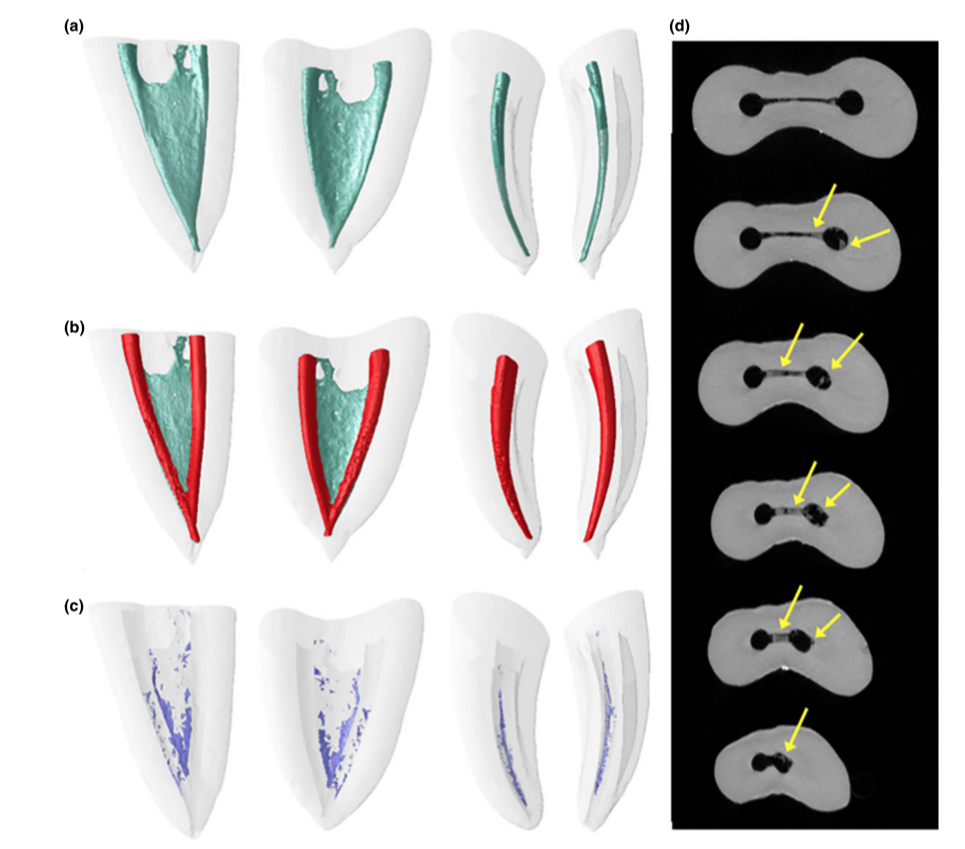
As pilhas de imagens dos espécimes após a preparação foram renderizadas e co-registradas com seus respectivos conjuntos de dados pré-operatórios usando um algoritmo afim do software 3D Slicer 4.4.0 (disponível em http://www.slicer.org) (Fedorov et al. 2012). Imagens correspondentes dos canais foram examinadas para calcular o volume usando o software ImageJ v.1.49 (Schneideret al. 2012). Em seguida, a quantificação de detritos de tecido duro foi realizada conforme descrito anteriormente (Neves et al. 2014) e expressa como a porcentagem do volume do canal radicular inicial para cada espécime. Detritos foram considerados como o material com densidade semelhante à da dentina em regiões anteriormente ocupadas por ar no espaço do canal radicular não preparado e quantificados pela interseção entre imagens antes e depois da instrumentação do canal (Robinson et al. 2012, De-Deus et al. 2014). Subsequentemente, modelos de canal radicular pré e pós-operatórios codificados por cor e detritos foram renderizados e avaliados qualitativamente usando os plugins 3D Viewer e 3D Object Counter, respectivamente, no software ImageJ (Schmid et al. 2010, Schneider et al. 2012).
Análise estatística
Os dados referentes aos detritos de tecido duro acumulados criados após a preparação do canal radicular foram calculados como a porcentagem do volume inicial do canal radicular e inseridos para estatísticas. Os dados apresentaram assimetria (teste de Shapiro-Wilk) e, portanto, foram comparados usando o teste U de Mann–Whitney, com o erro tipo alfa definido em 0,05.
Resultados
A irrigação dos canais radiculares usando a ponta da agulha 1 mm abaixo do WL deixou uma média de 0,92% (± 1,68) do volume total do sistema de canal radicular preenchido com detritos de tecido duro acumulados. Por outro lado, após a irrigação usando a ponta da agulha 5 mm abaixo do WL, 2,43% (± 2,22) do volume total do canal foi preenchido com detritos de tecido duro acumulados. A diferença entre os grupos foi significativa (teste U de Mann–Whitney, P = 0,019) (Tabela 1).
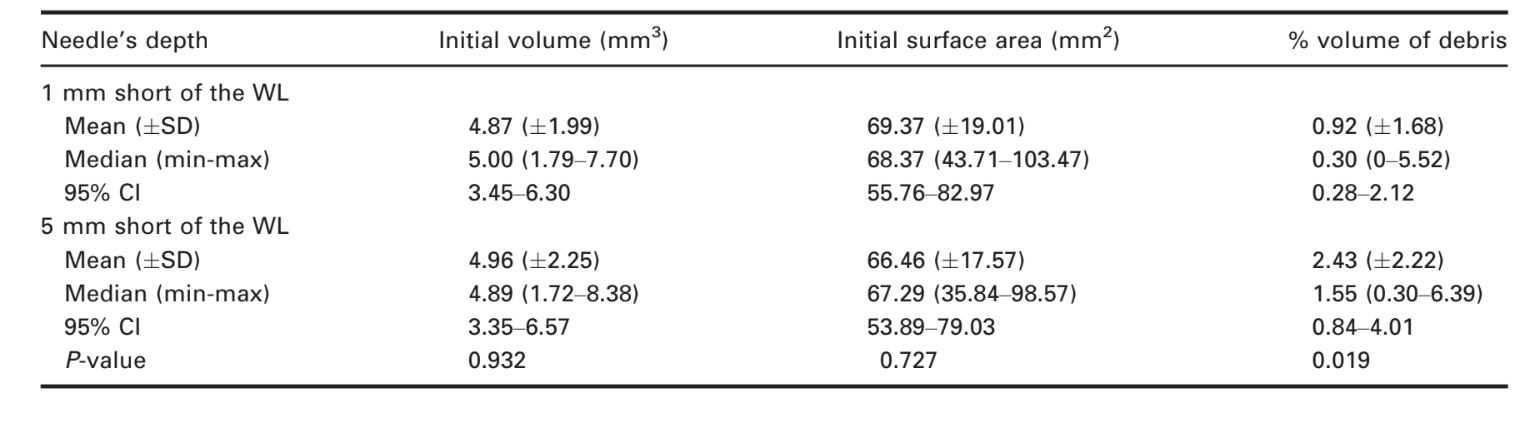
Modelos 3D representativos e cortes transversais nas Figuras 2 e 3 mostram a distribuição dos detritos de tecido duro acumulados após a preparação do canal radicular irrigado com a ponta da agulha posicionada a 1 ou 5 mm abaixo do WL nas raízes mesiais dos molares mandibulares.
Discussão
Foi hipotetizado que partículas de dentina cortadas das paredes do canal por instrumentos rotatórios eram ativamente compactadas em restos de tecido mole dentro do espaço do canal radicular e se tornavam mais resistentes à remoção por irrigação convencional com seringa e agulha (Paqué et al. 2009, 2012, Endal et al. 2011). Esse debris compactado pode potencialmente interferir na desinfecção, impedindo o fluxo do irrigante e neutralizando os efeitos antibacterianos da solução irrigante (Paqué et al. 2012). Portanto, o debris gerado durante a preparação mecânica deve ser removido pela lavagem da solução irrigante. No entanto, foi demonstrado que vários fatores podem afetar a eficiência da irrigação durante a preparação quimio-mecânica (Abou-Rass & Piccinino 1982). No presente estudo, a profundidade de inserção da agulha de irrigação foi escolhida como uma variável independente a ser testada na redução do debris de tecido duro acumulado, considerando a falta de informações sobre este assunto na literatura, utilizando uma abordagem metodológica de micro-CT. Além disso, raízes mesiais de molares mandibulares foram selecionadas devido à alta incidência de istmos em comparação com raízes de outros grupos de dentes (Weller et al. 1995, Mannocci et al. 2005, Harris et al. 2013), o que torna sua desbridagem um desafio laborioso. Vários autores defenderam que os procedimentos de irrigação devem proporcionar uma desbridagem eficaz do espaço do canal radicular (Chow 1983, Sedgley et al. 2005, Hsieh et al. 2007, Boutsioukis et al. 2010); no entanto, a literatura tem informações limitadas associando a profundidade de inserção da agulha e a remoção de debris. Estudos anteriores utilizando abordagens metodológicas destrutivas relataram que a proximidade da agulha de irrigação ao ápice desempenhou um papel importante na remoção de debris (Brown & Doran 1975, Abou-Rass & Piccinino 1982,Chow 1983). Da mesma forma, Sedgley et al. (2005) mostrou que a profundidade da agulha teve um efeito significativo na remoção mecânica de bactérias do espaço do canal radicular. Um estudo anterior de dinâmica de fluidos computacional avaliando o efeito da profundidade de inserção da agulha no fluxo do irrigante recomendou que agulhas com ventilação lateral deveriam ser posicionadas a 1 mm do WL, se possível, porque a substituição do irrigante alcançou o WL apenas quando a agulha com ventilação lateral foi colocada nessa posição (Boutsioukis et al. 2010).
Mais recentemente, vários estudos avaliando o acúmulo de detritos de tecido duro em recessos, istmos, irregularidades e ramificações usando micro-CT foram publicados (Paqué et al. 2009, 2011, 2012, Robinson et al. 2013, De-Deus et al. 2015, Versiani et al. 2016). Esta tecnologia quantificou o acúmulo e a remoção de detritos radiopacos em várias áreas do sistema de canais radiculares (Robinson et al. 2012, De-Deus et al. 2014, 2015). Esta é uma tecnologia não destrutiva que permite que os mesmos espécimes sejam avaliados após diferentes etapas de tratamento para observar tanto quantitativa quanto qualitativamente os detritos de tecido duro. Uma desvantagem deste método é que não é possível analisar o tecido mole remanescente (Paqué et al. 2009). No geral, estudos anteriores com micro-CT revelaram que procedimentos de irrigação sequenciais ou suplementares durante ou após a preparação do canal radicular resultaram em menos detritos de tecido duro em sistemas de canais radiculares contendo istmos, o que está de acordo com os resultados presentes. Neste estudo, uma redução significativa no volume de detritos de tecido duro foi observada quando a ponta da agulha foi colocada 1 mm abaixo do WL, rejeitando assim a hipótese testada. Em contraste, canais radiculares nos quais a agulha estava 5 mm abaixo do WL exibiram quase um aumento de três vezes no volume percentual de detritos. No entanto, ambos os protocolos de irrigação não conseguiram tornar os sistemas de canais radiculares mesiais livres de detritos de tecido duro. Assim, na irrigação convencional com seringa–agulha, a otimização do processo de irrigação pode estar relacionada à profundidade da penetração da agulha (Siu & Baumgartner 2010).
No estudo atual, uma agulha de 30-G com ventilação lateral foi utilizada em ambos os grupos. Esta agulha possui um lúmen na superfície lateral localizado a 2 mm da ponta romba e produz uma pressão apical menor do que uma agulha de ponta aberta (Boutsioukis et al. 2007); no entanto, sua extremidade fechada é importante para evitar o deslocamento inadvertido de NaOCl para os tecidos periapicais. Embora a solução irrigante utilizada com a técnica convencional de seringa–agulha de ponta aberta não alcance mais do que 1 mm apicalmente da ponta da agulha (Ram 1977), foi relatado que 42% dos endodontistas na América do Norte tiveram pelo menos um acidente com a extrusão de NaOCl (Kleier et al. 2008). Consequentemente, quanto mais profunda a penetração da agulha, maior é o risco de extrusão do irrigante (Psimma et al. 2013). Esse histórico de longa data explica por que alguns profissionais evitam alcançar o WL enquanto irrigam com a solução de NaOCl. O uso de uma profundidade de penetração distante do WL pode ser protetivo contra a extrusão apical, no entanto, de acordo com os resultados presentes, isso resultará em uma quantidade significativamente maior de detritos de tecido duro remanescente nas raízes mesiais de molares mandibulares que contêm istmo.
Para ajudar a disseminar o conceito de irrigação próxima ao WL, conforme demonstrado pelo presente estudo, é importante evitar incidentes com a solução de NaOCl, como usar uma baixa taxa de fluxo e pressão na entrega do irrigante e prevenir a ligação da agulha às paredes do canal, pois isso pode agir como um pistão, forçando a solução além do ápice. Além disso, o uso de uma agulha de irrigação do tipo com ventilação lateral permite um movimento turbulento ascendente ao redor e além da extremidade da sonda, que irriga completamente o sistema de canal radicular e previne que a solução e os detritos sejam extrudados através do forame apical (Kahn et al. 1995, Sainiet al. 2013).
Conclusões
Nenhuma das abordagens de irrigação conseguiu tornar o sistema de canal radicular mesial contendo istmo livre de detritos de tecido duro acumulados; no entanto, a profundidade de inserção da agulha influenciou significativamente a remoção dos detritos de tecido duro. A ponta da agulha posicionada 1 mm abaixo do WL resultou em níveis percentuais de remoção de detritos de tecido duro quase três vezes maiores do que quando posicionada no nível de 5 mm. Dentro das condições deste estudo, pode-se concluir que quanto mais próxima a agulha estiver do WL, mais eficiente é a remoção dos detritos de tecido duro. Este resultado enfatiza que a escolha de uma agulha adequada posicionada em um nível apropriado é um passo importante para otimizar a qualidade geral do procedimento de irrigação.
Autores: R. Perez, A. A. Neves, F. G. Belladonna, E. J. N. L. Silva, E. M. Souza, S. Fidel, M. A. Versiani, I. Lima, C. Carvalho, G. De-Deus
Referências:
- Abou-Rass M, Piccinino MV (1982) A eficácia de quatro métodos clínicos de irrigação na remoção de detritos do canal radicular. Cirurgia Oral, Medicina Oral, Patologia Oral e Endodontia 54, 323–8.
- Albrecht LJ, Baumgartner JC, Marshall JG (2004) Avaliação da remoção de detritos apicais usando vários tamanhos e afunilamentos de arquivos ProFile GT. Jornal de Endodontia 30, 425–8.
- Boutsioukis C, Lambrianidis T, Kastrinakis E, Bekiaroglou P (2007) Medição da pressão e das taxas de fluxo durante a irrigação de um canal radicular ex vivo com três agulhas endodônticas. Jornal Internacional de Endodontia 40, 504–13.
- Boutsioukis C, Lambrianidis T, Verhaagen B et al. (2010) O efeito da profundidade de inserção da agulha no fluxo do irrigante no canal radicular: avaliação usando um modelo de dinâmica de fluidos computacional não estacionário. Jornal de Endodontia 36, 1664–8.
- Boutsioukis C, Psimma Z, Kastrinakis E (2014) O efeito da taxa de fluxo e da técnica de agitação na extrusão do irrigante ex vivo. Jornal Internacional de Endodontia 47, 487–96.
- Brown JI, Doran JE (1975) Uma avaliação in vitro da capacidade de flutuação de partículas de várias soluções irrigantes. Jornal da Associação Dental da Califórnia 3, 60–3.
- Chow TW (1983) Eficácia mecânica da irrigação do canal radicular. Jornal de Endodontia 9, 475–9.
- De-Deus G, Marins J, Neves Ade A et al. (2014) Avaliação de detritos duros acumulados usando micro-tomografia computadorizada e software livre para processamento e análise de imagens. Jornal de Endodontia 40, 271–6.
- De-Deus G, Marins J, Silva EJ et al. (2015) Detritos duros acumulados produzidos durante a preparação de canais com níquel-titânio reciprocante e rotatório. Jornal de Endodontia 41, 676–81.
- Endal U, Shen Y, Knut A, Gao Y, Haapasalo M (2011) Um estudo tomográfico de alta resolução das mudanças na área do istmo do canal radicular por instrumentação e preenchimento radicular. Jornal de Endodontia 37, 223–7.
- Fan B, Pan Y, Gao Y, Fang F, Wu Q, Gutmann JL (2010) Análise morfológica tridimensional dos istmos nas raízes mesiais dos molares mandibulares. Jornal de Endodontia 36, 1866–9.
- Fedorov A, Beichel R, Kalpathy-Cramer J et al. (2012) 3D Slicer como uma plataforma de computação de imagem para a Rede de Imagem Quantitativa. Imagem por Ressonância Magnética 30, 1323–41.
- Haapasalo M, Shen Y, Qian W, Gao Y (2010) Irrigação em endodontia. Clínicas Dentárias da América do Norte 54, 291–312.
- Harris SP, Bowles WR, Fok A, McClanahan SB (2013) Uma investigação anatômica do primeiro molar mandibular usando micro-tomografia computadorizada. Jornal de Endodontia 39, 1374–8.
- Hsieh YD, Gau CH, Kung Wu SF, Shen EC, Hsu PW, Fu E (2007) Registro dinâmico da distribuição do fluido irrigante em canais radiculares usando análise de imagem térmica. Jornal Internacional de Endodontia 40, 11–7.
- Kahn FH, Rosenberg PA, Gliksberg J (1995) Uma avaliação in vitro das características de irrigação de peças de mão ultrassônicas e subsônicas e agulhas e sondas de irrigação. Jornal de Endodontia 21, 277–80.
- Kleier DJ, Averbach RE, Mehdipour O (2008) O acidente com hipoclorito de sódio: experiência de diplomados do Conselho Americano de Endodontia. Jornal de Endodontia 34, 1346–50.
- Lee SJ, Wu MK, Wesselink PR (2004) A eficácia da irrigação com seringa e ultrassom para remover detritos de irregularidades simuladas dentro das paredes do canal radicular preparado. Jornal Internacional de Endodontia 37, 672–8.
- Mannocci F, Peru M, Sherriff M, Cook R, Pitt Ford TR (2005) Os istmos da raiz mesial dos molares mandibulares: um estudo de micro-tomografia computadorizada. Jornal Internacional de Endodontia 38, 558–63.
- Neves AA, Silva EJ, Roter JM et al. (2014) Explorando o potencial de software livre para avaliar os resultados da preparação biomecânica do canal radicular através de imagens de micro-CT. Jornal Internacional de Endodontia 48, 1033–42.
- Paqué F, Laib A, Gautschi H, Zehnder M (2009) Análise da acumulação de detritos duros por meio de tomografias computadorizadas de alta resolução. Jornal de Endodontia 35, 1044–7.
- Paqué F, Boessler C, Zehnder M (2011) Níveis de detritos duros acumulados nas raízes mesiais dos molares mandibulares após etapas sequenciais de irrigação. Jornal Internacional de Endodontia 44, 148–53.
- Paqué F, Rechenberg DK, Zehnder M (2012) Redução da acumulação de detritos duros durante a instrumentação rotatória do canal radicular por ácido etidrônico em um irrigante de hipoclorito de sódio. Jornal de Endodontia 38, 692–5.
- Peters OA, Scho€nenberger K, Laib A (2001) Efeitos de quatro técnicas de preparação em Ni-Ti na geometria do canal radicular avaliados por micro tomografia computadorizada. Jornal Internacional de Endodontia 34, 221–30.
- Psimma Z, Boutsioukis C, Kastrinakis E, Vasiliadis L (2013) Efeito da profundidade de inserção da agulha e da curvatura do canal radicular na extrusão do irrigante ex vivo. Jornal de Endodontia 39, 521–4.
- Ram Z (1977) Eficácia da irrigação do canal radicular. Cirurgia Oral, Medicina Oral, Patologia Oral e Endodontia 44, 306–12.
- Robinson JP, Lumley PJ, Claridge E et al. (2012) Uma metodologia analítica de micro CT para quantificar detritos inorgânicos de dentina após preparação interna do dente. Jornal de Odontologia 40, 999–1005.
- Robinson JP, Lumley PJ, Cooper PR, Grover LM, Walmsley AD (2013) A técnica de canal radicular reciprocante induz maior acumulação de detritos do que uma técnica rotatória contínua, conforme avaliado por micro-tomografia computadorizada tridimensional. Jornal de Endodontia 39, 1067–70.
- Saini M, Kumari M, Taneja S (2013) Avaliação comparativa da eficácia de três dispositivos de irrigação diferentes na remoção de detritos do canal radicular em dois níveis diferentes: um estudo in vitro. Jornal de Odontologia Conservadora 16, 509–13.
- Schmid B, Schindelin J, Cardona A, Longair M, Heisenberg M (2010) Uma API de visualização 3D de alto nível para Java e ImageJ. BMC Bioinformatics 11, 274.
- Schneider SW (1971) Uma comparação de preparações de canais em canais radiculares retos e curvos. Cirurgia Oral, Medicina Oral, Patologia Oral e Endodontia 32, 271–5.
- Schneider CA, Rasband WS, Eliceiri KW (2012) NIH Image para ImageJ: 25 anos de análise de imagem. Nature Methods 9, 671–5.
- Sedgley CM, Nagel AC, Hall D, Applegate B (2005) Influência da profundidade da agulha irrigante na remoção de bactérias bioluminescentes inoculadas em canais radiculares instrumentados usando imagem em tempo real in vitro. Jornal Internacional de Endodontia 38, 97–104.
- Shen Y, Gao Y, Qian W et al. (2010) Simulação numérica tridimensional do fluxo do irrigante do canal radicular com diferentes agulhas de irrigação. Jornal de Endodontia 36, 884–9.
- Siu C, Baumgartner JC (2010) Comparação da eficácia de desbridamento do sistema de irrigação EndoVac e irrigação convencional com agulha do canal radicular in vivo. Jornal de Endodontia 36, 1782–5.
- Susin L, Liu Y, Yoon JC et al. (2010) Eficácias de desbridamento do canal e do istmo de duas técnicas de agitação de irrigantes em um sistema fechado. Jornal Internacional de Endodontia 43, 1077–90.
- Thomas AR, Velmurugan N, Smita S, Jothilatha S (2014) Avaliação comparativa da eficácia de desbridamento do istmo do canal da técnica modificada EndoVac com diferentes sistemas de irrigação. Jornal de Endodontia 40, 1676–80.
- Versiani MA, De-Deus G, Vera J et al. (2015) Mapeamento 3D das áreas irrigadas do espaço do canal radicular usando micro-tomografia computadorizada. Investigações Orais Clínicas 19, 859–66.
- Versiani MA, Alves FR, Andrade-Junior CV et al. (2016) Avaliação de micro-CT da eficácia da remoção de tecido duro da área do canal radicular e do istmo por sistemas de irrigação de pressão positiva e negativa. Jornal Internacional de Endodontia doi: 10.1111/iej.12559 [Epub ahead of print].
- Weller RN, Niemczyk SP, Kim S (1995) Incidência e posição do istmo do canal. Parte 1. Raiz mesiobucal do primeiro molar maxilar. Jornal de Endodontia 21, 380–3.


