Passos Suplementares para Remover Detritos de Tecido Duro de Sistemas de Canal com Istmo
Tradução automática
O artigo original está escrito em EN language (link para lê-lo) .
Resumo
Introdução: O objetivo deste estudo ex vivo foi avaliar a redução percentual de detritos duros acumulados (AHTD) no sistema de canal radicular mesial de molares mandibulares sob diferentes regimes de irrigação final por meio de imagens de microtomografia computadorizada.
Métodos: Sessenta raízes mesiais curvas de molares mandibulares com 2 canais independentes unidos apicalmente por um istmo (tipo II de Vertucci) foram selecionadas. As amostras foram escaneadas com uma resolução de 12,5 mm, anatomicamente pareadas e distribuídas em 3 grupos (n = 20) de acordo com o protocolo de preparação: Sistema de Arquivo Autoajustável (SAF; ReDent Nova, Ra’anana, Israel), Reciproc (VDW GmbH, Munique, Alemanha) e Revo-S (Micro-Mega, Besançon, França). Em seguida, cada grupo foi subdividido em 2 subgrupos (n = 10) de acordo com o protocolo de irrigação final com o sistema SAF ou EndoVac (Discus Dental, Culver City, CA). O volume percentual e a redução percentual de AHTD após a preparação do canal radicular e os protocolos de irrigação final foram comparados estatisticamente usando análise de variância de 1 via, o teste de amostras pareadas e os testes t de Student independentes. O nível de significância foi estabelecido em 5%.
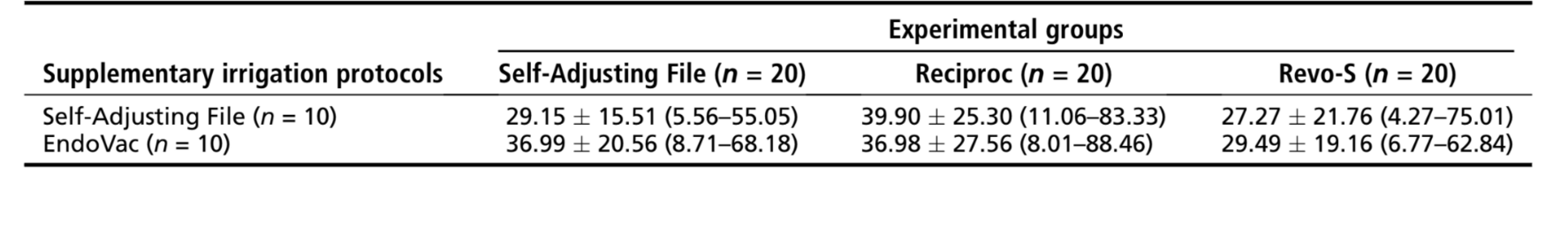
Resultados: Dentro dos grupos, o volume percentual médio foi significativamente reduzido após os procedimentos de irrigação final, tanto no subgrupo SAF (de 1,52%–1,78% para 1,01%–1,20%) quanto no subgrupo EndoVac (de 2,11%–2,23% para 1,31%–1,52%) (P < .05). Nos grupos experimentais, a redução percentual média de AHTD variou de 29,15%–39,90% após os protocolos de irrigação, sem diferença estatística entre os grupos (P > .05).
Conclusões: Nenhuma das abordagens de irrigação conseguiu tornar o sistema de canal radicular mesial livre de AHTD. Uma redução percentual semelhante de AHTD foi alcançada após os protocolos de irrigação final utilizando tanto o sistema SAF quanto o EndoVac. (J Endod 2016;42:1677–1682)
O resultado do tratamento endodôntico depende do controle eficaz da infecção intracanal por meio do uso de protocolos quimio-mecânicos eficazes. Com o advento de instrumentos rotatórios e reciprocantes de níquel-titânio, várias deficiências dos procedimentos de preparação convencionais que poderiam afetar negativamente a terapia endodôntica foram superadas. No entanto, estudos utilizando tecnologia de microtomografia computadorizada de alta resolução (micro-CT) mostraram que os detritos criados pela ação de corte dos instrumentos na dentina durante a preparação mecânica podem ser compactados nas complexidades anatômicas do sistema de canal radicular, impedindo a ação hidrodinâmica do fluxo do irrigante. Consequentemente, os procedimentos de desinfecção podem ser comprometidos, e microrganismos persistentes nessas áreas podem desenvolver ou manter a periodontite apical.
Nos últimos anos, vários esforços foram feitos para o desenvolvimento de abordagens adjuntas para melhorar a desinfecção do canal radicular. Entre as abordagens suplementares mais utilizadas para impulsionar irrigantes nas complexidades anatômicas do sistema de canal radicular estão os dispositivos sônicos, técnicas ultrassônicas e o Sistema EndoVac (Discus Dental, Culver City, CA). O Arquivo Autoajustável (SAF; ReDent Nova, Ra’anana, Israel) também se mostrou eficaz na redução de detritos de tecido duro acumulados (AHTD) durante ou após a preparação do canal radicular. Apesar do fato de que estudos recentes mostraram a eficácia dessas abordagens como potenciais adjuntos de irrigação para remoção de detritos após a preparação do canal radicular, ainda falta um conhecimento abrangente sobre a ativação de irrigantes em diferentes protocolos de irrigação final para remover detritos de tecido duro da área do istmo. Portanto, este estudo ex vivo teve como objetivo avaliar a porcentagem de redução de AHTD em canais radiculares mesiais contendo istmo de molares mandibulares sob diferentes regimes de irrigação final por meio de imagens de micro-CT. A hipótese nula era que não há diferença na redução de AHTD entre os protocolos de irrigação testados.
Materiais e Métodos
Estimativa do Tamanho da Amostra
O tamanho da amostra foi calculado após a estimativa do tamanho do efeito do volume percentual de AHTD conforme relatado por Paqué et al. Nesse estudo, o volume percentual de AHTD após a preparação SAF foi de 1,7%. Uma análise a priori de variância (ANOVA) (efeitos fixos, omnibus, 1 via) foi selecionada da família do teste F no software G*Power 3.1.7 para Macintosh (Heinrich Heine, Universität Düsseldorf, Düsseldorf, Alemanha).
Seleção de Amostras de Dentes
Após a aprovação do comitê de ética em pesquisa local (protocolo nº 2013/145), 250 raízes mesiais de molares mandibulares foram obtidas de um conjunto de dentes. O gênero e a idade dos pacientes eram desconhecidos. Para evitar a introdução de variáveis de confusão, as raízes distais foram seccionadas e os dentes foram decoronados ~3 mm acima da junção cemento-esmalte. Cada raiz mesial foi inicialmente inspecionada com a ajuda de um estereomicroscópio sob ampliação de 12× e radiografada nas direções bucolingual e mesiodistal para detectar qualquer possível obstrução do canal radicular. Os critérios de inclusão compreendiam apenas dentes apresentando raízes mesiais com curvatura moderada (15◦– 20◦) e um ápice totalmente formado. Os critérios de exclusão foram tratamento de canal anterior e a presença de defeitos dentinários na face externa das raízes. Como resultado, 160 raízes mesiais foram selecionadas e imagens separadas foram obtidas em uma resolução isotrópica de 12,5 mm usando um dispositivo de micro-CT (SkyScan 1172; Bruker-microCT, Kontich, Bélgica). Os parâmetros do scanner foram definidos em 80 kV, 124 mA, rotação de 180◦ ao redor do eixo vertical, um passo de rotação de 0,48◦, e um tempo de exposição da câmera de 620 milissegundos usando um filtro de alumínio de 0,5 mm de espessura. Em seguida, 60 raízes mesiais moderadamente curvadas e totalmente formadas de molares mandibulares com 2 canais independentes unidos apicalmente por um istmo (configuração tipo II de Vertucci) foram selecionadas.
As imagens de projeção adquiridas foram reconstruídas (software NRecon v.1.6.9, Bruker-microCT), resultando na aquisição de 1000 a 1200 seções transversais por raiz. O volume de interesse foi selecionado, estendendo-se do nível de furcação até o ápice, definido pela integração de todas as seções transversais. Para o propósito deste estudo, a região de interesse em cada fatia compreendia a área dos canais mesiais e do istmo. Modelos tridimensionais pré-operatórios dos sistemas de canais radiculares mesiais foram gerados (CTVol v.2.2.1, Bruker micro-CT), e parâmetros morfológicos da área do istmo (comprimento, volume e área de superfície) e de todo o sistema de canais radiculares (volume e área de superfície) foram calculados (software CTAn v.1.14.4, Bruker-microCT). Com o objetivo de aumentar a validade interna do experimento, os canais mesiais foram agrupados para criar 20 grupos de 3 com base nos aspectos morfológicos do canal. Em seguida, 1 raiz de cada grupo foi aleatoriamente atribuída a 1 dos 3 grupos experimentais (n = 20) de acordo com o protocolo de preparação: sistemas SAF, Reciproc (VDW GmbH, Munique, Alemanha) e Revo-S (Micro-Mega, Besançon, França). Após verificar a suposição de normalidade (teste de Shapiro-Wilk) e a igualdade de variâncias (teste de Levene), o grau de homogeneidade (linha de base) dos grupos em relação a cada um dos parâmetros morfológicos foi confirmado (teste AN-OVA de 1 via, P > .05) (Tabela 1).
Preparação do Canal Radicular
Após os ápices das raízes mesiais serem selados com resina epóxi de secagem rápida para criar um sistema de extremidade fechada, os canais foram acessados e o terço coronal foi progressivamente alargado com brocas Gates Glidden tamanhos 2 e 3 (Dentsply Maillefer, Baillagues, Suíça), seguido de irrigação com 3 mL de hipoclorito de sódio (NaOCl) a 2,5%. A patente foi confirmada pela inserção de um K-file tamanho 10 (Dentsply Maillefer) através do forame apical antes e após a conclusão da preparação do canal. Para todos os grupos, um caminho de deslizamento foi criado ao explorar um K-file de aço inoxidável tamanho 15 (Dentsply Maillefer) até o comprimento de trabalho (WL), que foi estabelecido subtraindo 1 mm do comprimento do canal. Em seguida, os canais radiculares em cada grupo foram preparados de acordo com os seguintes protocolos (Fig. 1):
- O sistema SAF (n = 20): Um instrumento SAF de 1,5 mm foi operado usando uma cabeça RDT3-NX (ReDent Nova) adaptada a uma peça de mão de baixa rotação (NSK, Tóquio, Japão) operada a 5000 rpm por 4 minutos. O SAF foi inserido gradualmente no canal e utilizado até o WL com um movimento de picote. Irrigação contínua a uma taxa de fluxo de 5 mL/min com NaOCl a 2,5% foi aplicada durante todo o procedimento usando um aparelho de irrigação especial (VATEA, ReDent-Nova).
- O sistema Reciproc (n = 20): O instrumento R25 (tamanho 25, 0,08 de afunilamento nos primeiros 3 mm) foi introduzido no canal até que a resistência fosse sentida e, em seguida, ativado em movimento reciprocante usando o motor VDW Silver (VDW GmbH). O instrumento foi movido lentamente na direção apical usando um movimento de picote suave de entrada e saída de cerca de 3 mm de amplitude. Após 3 movimentos de picote, o instrumento foi removido do canal e limpo. Cada vez que o instrumento Reciproc era removido, 2 mL de NaOCl a 2,5% eram aplicados usando uma agulha de ponta fechada 27-G adaptada a uma seringa plástica descartável e colocada 1 mm abaixo do WL.
- Sistema Revo-S (n = 20): Instrumentos rotatórios de níquel-titânio Revo-S SC1 (tamanho 25, 0,06 de afunilamento), SC2 (tamanho 25, 0,04 de afunilamento) e SU (tamanho 25, 0,06 de afunilamento) foram utilizados a 300 rpm de maneira crown-down até o WL usando um movimento de picote suave de entrada e saída. A irrigação seguiu o mesmo protocolo que no grupo Reciproc.
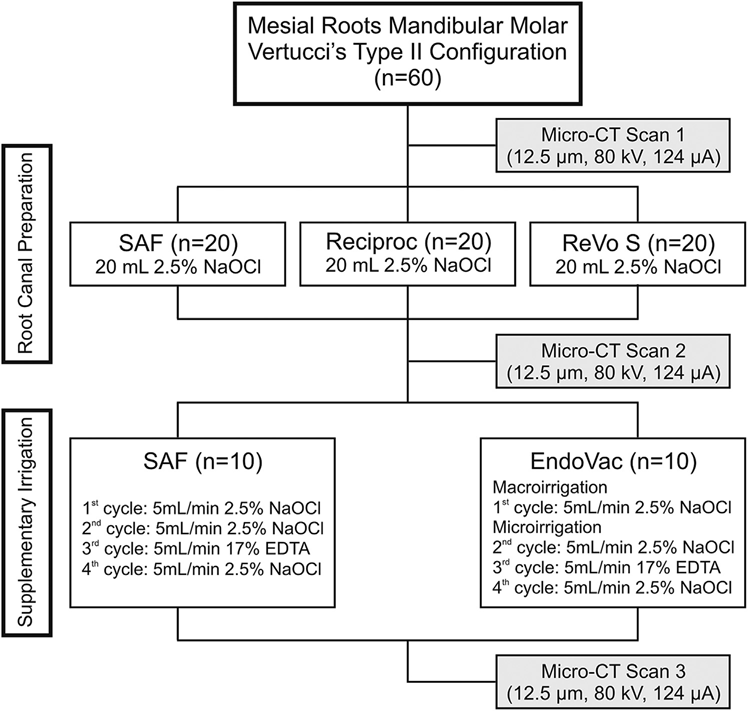
Em todos os grupos, a preparação foi realizada em 4 minutos utilizando um total de 20 mL de NaOCl 2,5% por canal. Após a preparação, uma lavagem final com 5 mL de EDTA 17% (pH = 7,7) administrada a uma taxa de 1 mL/min por 5 minutos, seguida de uma lavagem de 5 minutos com 5 mL de água bidestilada, foi realizada em cada canal com a ponta da agulha 27-G posicionada 1 mm abaixo do WL. Em seguida, os canais foram levemente secos com pontos de papel absorvente e as raízes submetidas a uma nova varredura, aplicando os parâmetros de configuração mencionados anteriormente (Fig. 1).
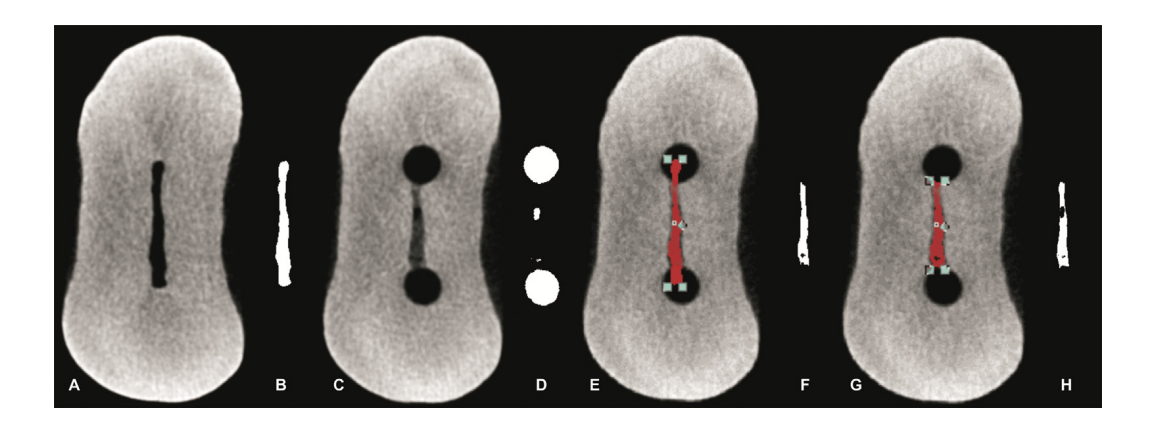
As digitalizações pós-operatórias foram coregistradas com seus respectivos conjuntos de dados pré-operatórios usando o módulo de registro rígido do software 3D Slicer 4.3.1 (disponível em http://www.slicer.org). A quantificação da AHTD foi realizada pela diferença entre o espaço do canal radicular não preparado e o preparado, utilizando procedimentos de pós-processamento com o software Fiji (Fiji v.1.47n; Fiji, Madison, WI). A sequência de imagens resultante dessa operação foi utilizada para identificar a AHTD por meio de operações morfológicas (Fig. 2) conforme descrito em detalhes em outro lugar. A presença de um material com densidade semelhante à da dentina em regiões anteriormente ocupadas por ar no espaço do canal radicular não preparado foi considerada detrito e quantificada pela interseção entre imagens antes e depois da instrumentação do canal. O volume total de AHTD foi calculado em milímetros cúbicos (mm3) e expresso como a porcentagem do volume total do sistema do canal após a preparação (%vol) (Tabela 1).
Para os próximos procedimentos experimentais, uma banda automatrix plástica transparente foi adaptada à parte coronal das raízes. Em seguida, os espécimes foram pareados em cada grupo com relação ao %vol de AHTD adquirido na varredura pós-preparação, e 1 raiz de cada par foi aleatoriamente atribuída a 1 de 2 subgrupos (n = 10) de acordo com o seguinte protocolo de irrigação suplementar (Fig. 1):
- O sistema SAF (n = 10): Os canais radiculares foram irrigados em 4 ciclos de 60 segundos usando um instrumento SAF de 1,5 mm conectado ao aparelho de irrigação VATEA. No primeiro ciclo, o SAF foi inserido até a WL e movido para cima e para baixo com um fluxo contínuo de irrigante de 2,5% NaOCl a uma taxa de fluxo de 5 mL/min. Depois disso, o SAF foi removido do canal, e o irrigante foi deixado em repouso por 60 segundos. Este ciclo foi repetido. Em seguida, nos terceiros e quartos ciclos, o SAF foi utilizado com irrigação contínua de 5 mL/min 17% EDTA (pH = 7,7) e 5 mL/min 2,5% NaOCl, respectivamente.
- O sistema EndoVac (n = 10): Os canais radiculares foram irrigados em 4 ciclos de 60 segundos usando o Sistema EndoVac. No primeiro ciclo, a macroirrigação com 5 mL de 2,5% NaOCl foi realizada usando uma macrocânula inserida no canal e movida para cima e para baixo a partir de um ponto onde ela se limitava às paredes do canal. Em seguida, o irrigante foi deixado em repouso por 60 segundos. Depois disso, 3 ciclos de microirrigação foram seguidos. A microcânula foi inserida 1 mm abaixo da WL e mantida por 60 segundos, enquanto 5 mL do irrigante eram constantemente repostos. A microcânula foi removida, e o irrigante foi deixado em repouso por 60 segundos. Nos próximos 2 ciclos de microirrigação, 5 mL/min 17% EDTA (pH = 7,7) e 5 mL/min 2,5% NaOCl foram utilizados, respectivamente.
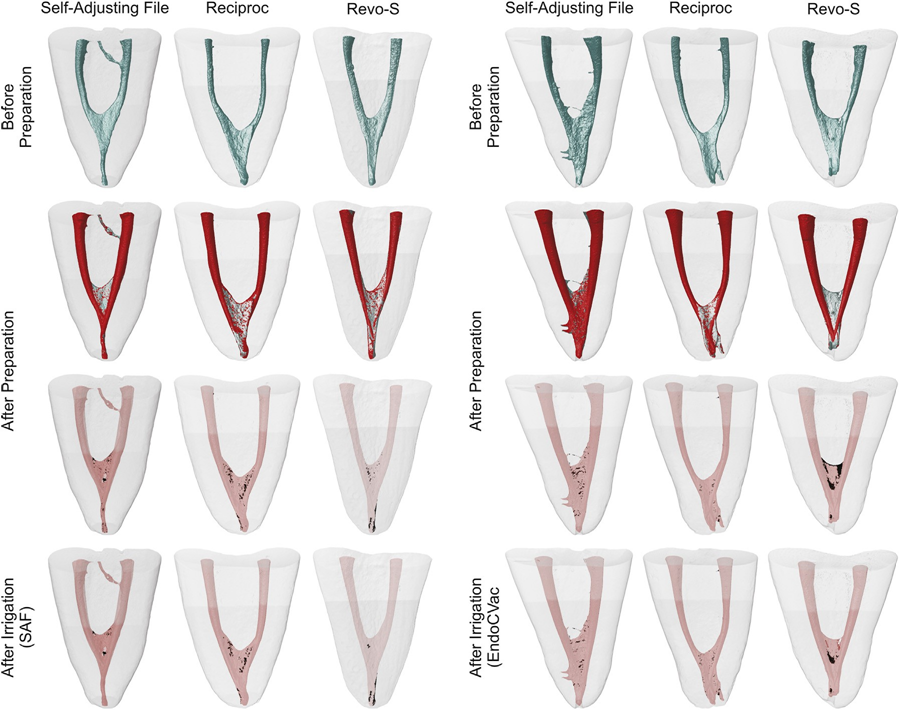
Após os procedimentos de irrigação suplementar, os canais foram levemente secos com pontos de papel absorvente, e uma varredura final foi realizada (Fig. 1). Os conjuntos de dados foram registrados com seus respectivos correspondentes, e o %vol de AHTD em cada canal foi calculado. Em seguida, a redução percentual (%red) do AHTD foi obtida de acordo com a seguinte fórmula: 100 — ([VAF × 100]/VBF), onde VBF e VAF são o volume de AHTD antes e depois dos protocolos de irrigação, respectivamente. Modelos de canais radiculares codificados por cores (cores verde e vermelha indicando superfícies de canal pré e pós-operatórias, respectivamente) e detritos (na cor preta) permitiram a comparação qualitativa dos canais radiculares correspondentes antes e depois dos procedimentos experimentais.
Análise Estatística
Os dados foram distribuídos normalmente (teste de Shapiro-Wilk) e homocedasticamente (teste de Levene). Portanto, os resultados foram expressos como média e desvio padrão e comparados entre grupos usando ANOVA de 1 via e dentro do grupo por amostras pareadas e testes t de Student independentes, com um nível de significância estabelecido em 5% (SPSS v17.0; SPSS Inc, Chicago, IL).
Resultados
A estimativa do tamanho da amostra mostrou que 9 amostras por grupo foram indicadas como o tamanho ideal da amostra (erro tipo alfa <0,05 e poder beta de 99%). Pré e pós-operatório, o grau de homogeneidade (linha de base) dos grupos e subgrupos foi confirmado em relação aos parâmetros morfológicos analisados dos canais radiculares, bem como o % vol de AHTD após a preparação (P > .05) (Tabela 1).
O %vol médio e %red de AHTD avaliados antes e após os procedimentos de irrigação suplementar estão detalhados em Tabelas 2 e 3, respectivamente. Dentro dos grupos, o %vol médio de AHTD foi significativamente reduzido após os procedimentos de irrigação final com os sistemas SAF (de 1,52%–1,78% para 1,01%–1,20%) ou EndoVac (de 2,11%–2,23% para 1,31%–1,52%) (P < .05) (Tabela 2). No geral, o % red médio de AHTD variou de 29,15%–39,90% sem diferença estatística entre os grupos experimentais (P > .05) (Tabela 3). Portanto, a hipótese nula foi confirmada. Modelos tridimensionais de canais radiculares mesiais representativos em cada grupo experimental mostram a distribuição do AHTD após a preparação quimio-mecânica e os protocolos de irrigação suplementar (Fig. 3). No geral, os detritos residuais após os protocolos de irrigação final foram observados principalmente no terço apical e na área do istmo.
Discussão
De modo geral, a desinfecção do canal radicular foi avaliada por meio de métodos convencionais, como seccionamento radicular, microscopia eletrônica de varredura e histologia. Mais recentemente, a tecnologia de micro-CT não destrutiva foi utilizada como uma ferramenta precisa para a avaliação quantitativa tridimensional de detritos de tecido duro acumulados em recessos durante a preparação do canal. Evidências desses estudos indicam que partículas de dentina cortadas das paredes do canal pelos instrumentos endodônticos podem ser ativamente empacotadas nas complexidades anatômicas do sistema de canal, tornando-se mais resistentes à remoção. Apesar do fato de que é difícil tirar conclusões confiáveis da literatura sobre o protocolo de irrigação mais eficaz para superar esse problema, existe um consenso geral sobre os benefícios de ativar o irrigante durante e após os procedimentos de preparação. No geral, estudos anteriores mostraram que o uso de abordagens de irrigação suplementares após a preparação do canal resulta em menos detritos dentro das complexidades do sistema de canal radicular, como mostrado no presente estudo.
O SAF é um instrumento oco de níquel-titânio em forma de rede que limpa as paredes do canal por meio de vibrações verticais e permite a irrigação simultânea e contínua durante a preparação mecânica do canal radicular. Até o momento, apenas 2 estudos tentaram quantificar o volume de detritos de tecido duro acumulados na área do istmo das raízes mesiais dos molares mandibulares após o uso do sistema SAF. Em um deles, o SAF foi utilizado como um instrumento de acabamento após a preparação do canal radicular e deixou 4,3% do volume do canal preenchido com AHTD. Este resultado foi mais do que o dobro do relatado por Paqué et al e os resultados encontrados no presente estudo, mas pode ser explicado porque o protocolo do SAF foi modificado e aplicado por apenas 1 minuto em cada canal para igualar os grupos experimentais em termos de tempo de preparação e quantidade de irrigante. Portanto, pode ser aconselhável que estudos utilizando o SAF como uma etapa suplementar para a limpeza do canal radicular sigam seu protocolo completo, como utilizado aqui. No entanto, apesar do fato de que o SAF foi comprovado como eficiente como um potencial adjunto de irrigação para a remoção de detritos, deve-se destacar que este instrumento é incapaz de remover todo o conteúdo de AHTD do canal porque, durante seu uso, continua a limpar as paredes do canal, produzindo mais detritos dentinários. Além disso, embora o SAF se adapte à forma do canal, ele não pode entrar na área do istmo. Consequentemente, sua eficácia no presente estudo pode ser atribuída ao fluxo contínuo com uma substituição de irrigante fresco e totalmente ativo.
O sistema EndoVac compreende um regime de irrigação diferente que envolve pressão negativa apical e utiliza uma ponta mestre para entregar e evacuar o irrigante concomitantemente no nível da câmara pulpar, enquanto microcânulas são usadas profundamente no canal. Na literatura, a comparação dos efeitos de limpeza e desinfecção do EndoVac e da irrigação convencional alcançou resultados inconclusivos. Embora alguns estudos tenham mostrado eliminação bacteriana superior e melhor limpeza usando o sistema EndoVac, outros autores não encontraram diferenças significativas entre essas técnicas. Recentemente, 2 estudos avaliaram a eficácia do EndoVac para remover detritos de tecido duro acumulados em canais radiculares mesiais contendo istmo de molares mandibulares. Foi relatado que o volume percentual mediano de AHTD foi reduzido para 2,12% e 3,4% após o uso do sistema EndoVac como protocolo final de irrigação, o que está de acordo com os resultados presentes. No entanto, é importante ressaltar que a configuração do canal radicular das amostras selecionadas aqui e nesses estudos (Vertucci tipo II) pode favorecer a eficácia do sistema EndoVac quando comparado a outras abordagens de irrigação. Neste tipo de configuração em que os canais radiculares estão conectados por um istmo, a ação de lavagem mecânica do EndoVac produz um fluxo de corrente do irrigante em direção ao terço apical em ambos os canais radiculares simultaneamente. Consequentemente, esse fluxo constante de irrigante pode deslocar os detritos de tecido duro da área do istmo favorecendo sua remoção, o que pode explicar esses resultados.
Embora um protocolo final de irrigação com SAF e EndoVac tenha resultado em uma redução significativa no conteúdo de detritos, o que pode ser traduzido em uma melhoria na limpeza do sistema de canal radicular, sua relevância clínica permanece incerta, e mais estudos são necessários para avaliar seu impacto na taxa de sucesso do tratamento de canal radicular. Também vale a pena mencionar que os grupos experimentais neste estudo diferiram não apenas no modo de entrega do irrigante, mas também no protocolo de entrega; o sistema EndoVac entrega o irrigante na câmara pulpar e não no sistema de canal radicular. No entanto, essas diferenças não pareceram influenciar negativamente os resultados, provavelmente devido à abordagem de distribuição da amostra utilizada aqui, que foi baseada nos aspectos morfológicos tanto dos canais radiculares quanto da área do istmo (Tabela 1). Este passo metodológico é fundamental para reduzir os potenciais vieses anatômicos significativos que poderiam interferir nos resultados, aumentando a validade interna do experimento.
Apesar dos achados deste estudo revelarem que os protocolos de irrigação adjuntos com os sistemas SAF ou EndoVac não conseguiram tornar o sistema de canal radicular mesial contendo istmo dos dentes molares mandibulares livre de AHTD, sua eficácia na redução dos detritos criados pelos instrumentos durante os procedimentos de limpeza e modelagem foi demonstrada.
Autores: Ali Keleş, Hatice Alçin, Manoel D. Sousa-Neto, Marco A. Versiani
Referências:
Siqueira JF Jr, Alves FRF, Versiani MA, et al. Análise bacteriológica e microtomográfica correlativa dos canais mesiais de molares mandibulares preparados por Self-Adjusting File, Reciproc e Twisted File. J Endod 2013;39:1044–50.
Siqueira JF Jr. Reação dos tecidos perirradiculares ao tratamento de canal radicular: benefícios e desvantagens. Endod Topics 2005;10:123–47.
Hülsmann M, Peters OA, Dummer PMH. Preparação mecânica de canais radiculares: objetivos de modelagem, técnicas e meios. Endod Topics 2005;10: 30–76.
Versiani MA, Pécora JD, Sousa-Neto MD. Preparação de canal radicular oval plano com instrumento de arquivo autoajustável: um estudo de microtomografia computadorizada. J Endod 2011;37: 1002–7.
De-Deus G, Marins J, Silva EJ, et al. Detritos de tecido duro acumulados produzidos durante a preparação de canais com níquel-titânio reciprocante e rotativo. J Endod 2015;41: 676–81.
De-Deus G, Roter J, Reis C, et al. Avaliando detritos de tecido duro acumulados usando microtomografia computadorizada e software livre para processamento e análise de imagens. J Endod 2014;40:271–6.
Freire LG, Iglecias EF, Cunha RS, et al. Avaliação microtomográfica da remoção de detritos de tecido duro após diferentes métodos de irrigação e sua influência no preenchimento de canais curvados. J Endod 2015;41:1660–6.
Paqué F, Al-Jadaa A, Kfir A. Acúmulo de detritos de tecido duro criado pela instrumentação rotativa convencional versus arquivo autoajustável em sistemas de canal radicular mesial de molares mandibulares. Int Endod J 2012;45:413–8.
Paqué F, Boessler C, Zehnder M. Níveis de detritos de tecido duro acumulados nas raízes mesiais de molares mandibulares após etapas sequenciais de irrigação. Int Endod J 2011; 44:148–53.
Paqué F, Laib A, Gautschi H, Zehnder M. Análise do acúmulo de detritos de tecido duro por meio de tomografias computadorizadas de alta resolução. J Endod 2009;35: 1044–7.
Paqué F, Peters OA. Avaliação microtomográfica da preparação de canais radiculares longos e ovais em molares mandibulares com o arquivo autoajustável. J Endod 2011;37:517–21.
Paqué F, Rechenberg DK, Zehnder M. Redução do acúmulo de detritos de tecido duro durante a instrumentação rotativa de canais radiculares por ácido etidrônico em um irrigante de hipoclorito de sódio. J Endod 2012;38:692–5.
Versiani MA, Alves FRF, Andrade Junior CV, et al. Avaliação de micro-CT da eficácia da remoção de tecido duro da área do canal radicular e do istmo por sistemas de irrigação de pressão positiva e negativa. Int Endod J. 2015 Oct 13. http://dx.doi.org/10.1111/iej.12559. [Epub ahead of print].
Ricucci D, Siqueira JF Jr, Bate AL, Pitt Ford TR. Investigação histológica de dentes tratados com canal radicular com periodontite apical: um estudo retrospectivo de vinte e quatro pacientes. J Endod 2009;35:493–502.
Siqueira JF Jr, Rôças IN. Otimizando a desinfecção em uma única visita com abordagens suplementares: uma busca por previsibilidade. Aust Endod J 2011;37:92–8.
Adorno CG, Fretes VR, Ortiz CP, et al. Comparação de dois sistemas de pressão negativa e irrigação com seringa para irrigação de canal radicular: um estudo ex vivo. Int Endod J 2016; 49:174–83.
Leoni GB, Versiani MA, Silva Sousa YT, et al. Avaliação ex vivo de quatro protocolos de irrigação final na remoção de detritos de tecido duro do sistema de canal radicular mesial de molares mandibulares. Int Endod J. 2016 Mar 18. http://dx.doi.org/ 10.1111/iej.12630. [Epub ahead of print].
Susin L, Liu Y, Yoon JC, et al. Eficácia de desbridamento de canal e istmo de duas técnicas de agitação de irrigantes em um sistema fechado. Int Endod J 2010;43: 1077–90.
Tay FR, Gu LS, Schoeffel GJ, et al. Efeito do bloqueio de vapor no desbridamento de canal radicular usando uma agulha de ventilação lateral para entrega de irrigante sob pressão positiva. J Endod 2010;36: 745–50.
Haapasalo M, Shen Y, Wang Z, Gao Y. Irrigação em endodontia. Br Dent J 2014;216: 299–303.
Gu LS, Kim JR, Ling J, et al. Revisão das técnicas e dispositivos contemporâneos de agitação de irrigantes. J Endod 2009;35:791–804.
Nusstein JM. Irrigação sônica e ultrassônica. In: Bettina B, ed. Irrigação Endodôntica: Desinfecção Química do Sistema de Canal Radicular. Basel, Suíça: Springer; 2015:173–98.
Metzger Z, Teperovich E, Zary R, et al. O arquivo autoajustável (SAF). Parte 1: respeitando a anatomia do canal radicular—um novo conceito de arquivos endodônticos e sua implementação. J Endod 2010;36:679–90.
Versiani MA, Pécora JD, Sousa-Neto MD. Análise de microtomografia computadorizada da morfologia do canal radicular de caninos mandibulares de raiz única. Int Endod J 2013;46: 800–7.

/public-service/media/default/158/GMj69_65311b2333f75.jpg)
/public-service/media/default/148/ix2WY_6531196adc6ec.jpg)
/public-service/media/default/145/GbhGY_65311921a3b65.jpg)
/public-service/media/default/460/aU9ju_671a20a2e53f3.png)