Avaliação de Detritos Acumulados de Tecido Duro Usando Microtomografia Computadorizada e Software Livre para Processamento e Análise de Imagens
Tradução automática
O artigo original está escrito em EN language (link para lê-lo).
Resumo
Introdução: A acumulação de detritos ocorre após procedimentos de preparação de canal radicular, especificamente em fins, istmos, irregularidades e ramificações. O objetivo deste estudo foi apresentar uma descrição passo a passo de um novo método utilizado para identificar, medir e mapear tridimensionalmente a acumulação de detritos de tecido duro dentro do canal radicular após a preparação biomecânica, utilizando software gratuito para processamento e análise de imagens.
Métodos: Três molares mandibulares apresentando a raiz mesial com uma largura de istmo grande e uma configuração de canal tipo II de Vertucci foram selecionados e escaneados. Os espécimes foram atribuídos a 1 de 3 abordagens experimentais: (1) 5,25% de hipoclorito de sódio + 17% de EDTA, (2) água bidistilada e (3) sem irrigação. Após a preparação do canal radicular, escaneamentos de alta resolução dos dentes foram realizados, e pacotes de software gratuitos foram utilizados para registrar e quantificar a quantidade de detritos de tecido duro acumulados tanto no espaço do canal quanto nas áreas do istmo.
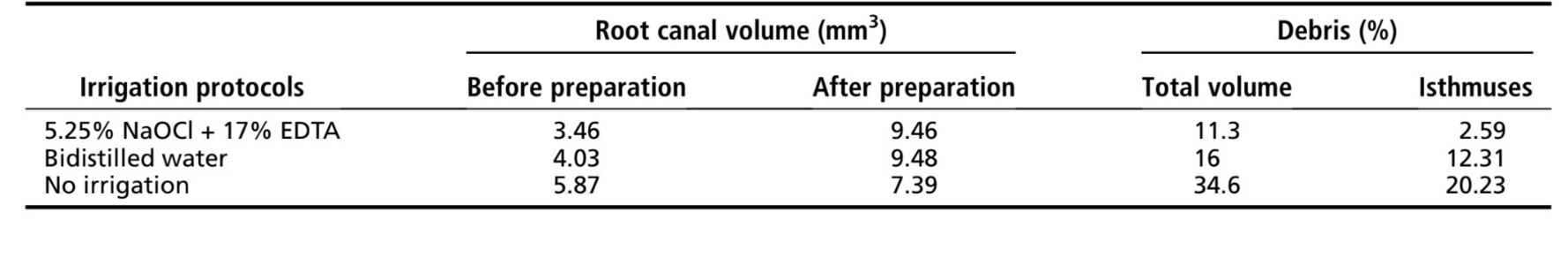
Resultados: A preparação do canal sem irrigação resultou em 34,6% de seu volume preenchido com detritos de tecido duro, enquanto o uso de água bidistilada ou NaOCl seguido de EDTA mostrou uma redução na porcentagem de volume de detritos para 16% e 11,3%, respectivamente. Quanto mais próxima a distância da área do istmo, maior a quantidade de detritos acumulados, independentemente do protocolo de irrigação utilizado.
Conclusões: Através do método presente, foi possível calcular o volume de detritos de tecido duro nos istmos e no espaço do canal radicular. Pacotes de software livre utilizados para reconstrução, registro e análise de imagens mostraram-se promissores para aplicação pelo usuário final. (J Endod 2014;40:271–276)
Desde a primeira descrição de uma camada de resíduos na dentina radicular instrumentada, o conceito de camada de resíduos desempenhou um papel fundamental na pesquisa e prática endodôntica. A camada de resíduos foi definida como um filme superficial de detritos retidos na dentina e em outras superfícies após a instrumentação com instrumentos rotatórios ou limas endodônticas. Ela consiste em partículas de dentina, restos de tecido pulpar vital ou necrótico, componentes bacterianos e irrigante retido. Infelizmente, os resultados de estudos anteriores foram parcialmente contraditórios, e a maioria das recomendações clínicas foi baseada apenas em avaliações descritivas ou semiquantitativas limitadas in vitro com microscopia eletrônica de varredura. Por outro lado, Paqué et al reabriram uma discussão interessante sobre o acúmulo substancial de detritos que ocorre após a preparação biomecânica, especificamente em fins, istmos, irregularidades e ramificações da complexa rede do canal radicular. O acúmulo de detritos de tecido duro tem sido considerado um efeito colateral dos procedimentos de limpeza e modelagem e pode ser mais clinicamente relevante do que a camada de resíduos, pois sua quantidade considerável poderia facilmente abrigar biofilme bacteriano dos procedimentos de desinfecção. A avaliação do acúmulo de detritos de tecido duro foi possibilitada através da combinação de imagens de microtomografia computadorizada (CT) não destrutiva e do desenvolvimento de software robusto de análise e processamento de imagens. Através da imagem de micro-CT, os dentes podem ser escaneados antes e depois dos procedimentos de limpeza e modelagem, e, com a ajuda de software apropriado, os volumes de imagem resultantes de ambos os procedimentos de escaneamento podem ser co-registrados geometricamente (ou seja, diferentes conjuntos de dados podem ser transformados e integrados em 1 sistema de coordenadas).
Isso permite, em certa medida, a identificação dos detritos de dentina que foram compactados no espaço original do canal radicular após a preparação. A justificativa por trás dessa abordagem tem uma base simples, que foi descrita primeiro por Paqué et al e foi recentemente bem definida por Robinson et al como ‘‘pixels que estavam ocupados por ar e depois se tornaram dentina devem ser detritos.’’
Descobertas interessantes sobre o efeito dos atuais procedimentos de limpeza e modelagem na acumulação de detritos de tecido duro foram mostradas em estudos recentes.
- EDTA e irrigação ultrassônica passiva reduziram a acumulação de detritos de tecido duro, mas aproximadamente 50% dos detritos ainda permaneceram no espaço do canal radicular.
- O uso de um quelante compatível com hipoclorito possibilitou a redução da acumulação de detritos de tecido duro.
- Sistemas de arquivos autoajustáveis (ReDent-Nova, Ra’anana, Israel) resultaram em menos detritos de tecido duro acumulados em sistemas de canais radiculares contendo istmo do que a instrumentação rotatória com ProTaper (Dentsply/Maillefer, Ballaigues, Suíça) e irrigação com agulha/siringa.
Esses achados precisam ser enfatizados porque foram fornecidos por experimentos metodologicamente sólidos utilizando tecnologia de micro-CT e análise de imagem. Assim, um ponto que vale a pena discutir é a recente mudança metodológica no estudo da acumulação de detritos de tecido duro. Portanto, algumas preocupações em relação à tecnologia de micro-CT devem ser apontadas, considerando que este é um procedimento de alto custo, que exige muito trabalho e tempo, e que demanda uma curva de aprendizado extensa para adquirir a expertise necessária para extrair dados quantitativos. Uma das razões para o alto custo dos procedimentos experimentais utilizando essa tecnologia está relacionada aos pacotes de software proprietários, que costumam ser caros. Este é um dos pontos que impedem a disseminação mundial dessa metodologia útil.
Portanto, o objetivo deste estudo foi apresentar uma descrição passo a passo de um novo método utilizado para identificar, medir e mapear tridimensionalmente a acumulação de detritos de tecido duro dentro do espaço do canal radicular após a preparação biomecânica, utilizando software gratuito para processamento e análise de imagem. Suas vantagens em relação aos pacotes de software de análise de imagem proprietários e suas limitações também são cuidadosamente abordadas.
Materiais e Métodos
Critérios de Seleção dos Dentes
Este estudo foi revisado e aprovado pelo Comitê de Ética, Núcleo de Estudos em Saúde Coletiva (protocolo nº 2223-CEP/HUPE). Cento e vinte primeiros e segundos molares mandibulares humanos com raízes completamente separadas foram obtidos de um banco de dentes extraídos. Os dentes foram extraídos por razões não relacionadas a este estudo e inicialmente selecionados com base em radiografias digitais tomadas na direção bucolingual para detectar qualquer possível obstrução do canal radicular e para determinar o ângulo de curvatura da raiz mesial, conforme descrito por Schneider. O ângulo de curvatura foi medido usando um programa de análise de imagem de código aberto (Fiji v.1.47n; Madison, WI), e apenas dentes com uma raiz mesial com curvatura moderada (variando de 10◦–20◦) foram selecionados. Além disso, os critérios de inclusão compreendiam apenas molares nos quais a medição apical final dos canais mesiais permitia a colocação de um arquivo manual tamanho 10 (Dentsply Maillefer, Ballaigues, Suíça) até o comprimento de trabalho. Além disso, o comprimento dos espécimes foi padronizado entre 20 e 22 1 mm para evitar a introdução de variáveis de confusão, que poderiam contribuir para variações nos procedimentos de preparação. Como resultado, 52 molares mandibulares foram selecionados e armazenados em solução de timol a 0,1% a 5◦C.
Para obter um esboço geral da anatomia do canal radicular, esses dentes foram pré-escanados em uma resolução isotrópica relativamente baixa (70 mm) usando um scanner de microtomografia computadorizada (SkyScan 1172; Bruker-microCT, Kontich, Bélgica) a 70 kV e 114 mA. Com base nos modelos tridimensionais (3D) deste conjunto de imagens pré-escanadas, 37 molares mandibulares apresentando uma raiz mesial com um sistema de configuração de canal tipo II de Vertucci com uma largura de istmo grande entre os canais mesiais foram selecionados. Após a ressecção da raiz distal no nível da furcação, 3 dentes foram selecionados aleatoriamente para o estudo presente e escaneados novamente em uma resolução isotrópica de 14,16 mm. Os outros dentes foram mantidos para uso posterior.
Preparação e Irrigação do Canal Radicular
Os ápices dos 3 dentes foram selados com cola quente e embutidos em polissiloxano de polivinila para simular o efeito de aprisionamento de gás apical em um sistema de canal fechado durante a preparação do canal radicular. Em seguida, para agilizar ainda mais os processos de coregistro, cada dente foi colocado coronalmente apicalmente dentro de um suporte de resina epóxi feito sob medida (Ø = 18 mm) para se ajustar suavemente ao suporte de amostra do dispositivo de micro-CT. Os espécimes foram aleatoriamente designados para 1 dos 3 abordagens experimentais, e o lançamento de uma moeda foi usado para definir quais dentes seriam tratados com os seguintes protocolos de irrigação:
- 5,25% hipoclorito de sódio (NaOCl) + 17% EDTA
- Água bidistilada
- Sem irrigação (controle positivo)
Os dentes foram preparados utilizando uma técnica de reciprocidade em níquel-titânio de forma padronizada. Os dentes foram acessados, e a permeabilidade do canal radicular foi confirmada pela inserção de um K-file tamanho 10 (Dentsply Maillefer) através do forame apical antes e após a conclusão da preparação do canal radicular. O comprimento de trabalho foi estabelecido subtraindo 1 mm do comprimento do canal. O Reciproc R25 (VDW GmbH, Munique, Alemanha) foi introduzido no canal até que a resistência fosse sentida e, em seguida, ativado em um movimento de reciprocidade gerado por uma peça de mão contra-ângulo 6:1 (Sirona, Bensheim, Alemanha) alimentada por um motor elétrico (VDW Silver; VDW GmbH, Munique, Alemanha) usando a configuração pré-definida "Reciproc ALL". O instrumento foi movido na direção apical usando um movimento de picote para dentro e para fora de cerca de 3 mm de amplitude com uma leve pressão apical. Após 3 movimentos de picote, o instrumento foi removido do canal e limpo. Um único operador com experiência em realizar tratamento de canal radicular utilizando técnicas de reciprocidade realizou todas as preparações.
Para os protocolos de irrigação 1 (5,25% NaOCl + 17% EDTA) e 2 (água bidistilada), os irrigantes foram continuamente entregues por uma bomba peristáltica VATEA (ReDent-Nova, Ra’anana, Israel) a uma taxa de 2 mL/min conectada a uma ponta Endo-Eze 30-G (Ultradent Products Inc, South Jordan, UT) inserida no canal sem obstrução até 2 mm do forame apical. A aspiração foi realizada com um SurgiTip (Ultradent Products Inc) conectado a uma bomba de sucção de alta velocidade. Entre cada etapa de preparação, os canais radiculares foram irrigados com 2 mL de irrigante por 1 minuto. Como resultado, um volume total de 20 mL de 5,25% NaOCl (protocolo 1) e água bidistilada (protocolo 2) foi utilizado por canal radicular durante a preparação biomecânica. Após a preparação do canal radicular, uma enxaguagem adicional com 20 mL do irrigante foi realizada por 10 minutos. Assim, em cada protocolo, um volume total de 40 mL de irrigante foi utilizado por canal durante um tempo total de 30 minutos. Após esta etapa, a camada de smear foi removida com 3 mL de 17% EDTA (pH = 7,7) administrados a uma taxa de 1 mL/min por 3 minutos. Em seguida, todos os canais foram secos com pontos de papel absorvente (Dentsply Maillefer). Para o protocolo 3, os canais mesiais foram preparados sem solução de irrigante.
Micro-CT Scans
Escaneamentos de alta resolução, antes e depois da preparação do canal radicular, foram realizados por dente usando os mesmos parâmetros selecionados. Os dentes foram escaneados (SkyScan 1172) a 70 kV, 114 mA, e um tamanho de pixel isotrópico de 14,16 mm. O escaneamento foi realizado por rotação de 360◦ ao redor do eixo vertical com um tempo de exposição da câmera de 7.000 milissegundos, passo de rotação de 0,5◦, e média de quadros de 5. Os raios-X foram filtrados com um filtro de alumínio de 1 mm. Uma correção de campo plano foi feita antes dos procedimentos de escaneamento para corrigir variações na sensibilidade do pixel da câmera. As imagens foram reconstruídas usando NRecon v.1.6.3 (Brucker-microCT) com uma correção de endurecimento do feixe de 40% e correção de artefato de anel de 10, resultando na aquisição de 700–800 seções transversais por dente em formato bitmap. O volume de interesse foi selecionado estendendo-se do nível de furcação até o ápice da raiz mesial.
Análise de Imagem Quantitativa
Para a análise quantitativa, as imagens originais em escala de cinza das seções transversais das raízes antes e depois da preparação foram processadas com um limiar de segmentação interativo para separar a dentina e os detritos do espaço do canal radicular usando a interface de software Seg3D v.2.1.4 (National Institutes of Health Center for Integrative Biomedical Computing, University of Utah Scientific Computing and Imaging Institute, Salt Lake City, UT). Este processo envolve escolher a faixa de níveis de cinza necessária para reconhecer regiões de uma determinada imagem, dividindo-a em suas partes componentes específicas de interesse. O resultado final é uma imagem binária composta apenas por pixels pretos ou brancos, nos quais os pixels pretos representam os espaços vazios e os pixels brancos o objeto de interesse. Em seguida, uma máscara de rótulo foi aplicada às regiões segmentadas de interesse e salva como camadas opacas coloridas. Usando o mesmo software, as pilhas de imagens da máscara de rótulo da raiz, dos dentes antes e depois da preparação do canal, foram selecionadas e coregistradas por um processo automático de sobreposição baseado no contorno externo da raiz usando 1.000 interações. Para validar esse processo, dentes não preparados foram submetidos duas vezes ao processo de digitalização, sendo removidos e reinseridos no suporte de amostra do dispositivo de micro-CT. Depois, a diferença entre os conjuntos de dados pré e pós-digitalização, obtida por uma operação de subtração morfológica, mostrou um erro computacional de apenas 1% (~2 voxels), o que confirmou a confiabilidade do processo de registro.
As máscaras de rótulo dos conjuntos de dados registrados de cada dente foram importadas para o software Fiji e normalizadas. No procedimento de normalização, todos os valores de pixel nos arquivos de máscara foram classificados e divididos em um número de quantis. Depois disso, cada um dos valores em um dado quantil foi substituído pelo valor médio nesse quantil, resultando em uma distribuição de valores de histograma muito semelhante em todas as imagens.
Em seguida, o espaço do canal foi segmentado como resultado de uma operação bit a bit automática de exceção entre a sequência de imagens da raiz com dentina segmentada, e essa mesma sequência foi duplicada e invertida. A sequência de imagens resultante dessa operação foi utilizada para identificar os detritos de tecido duro acumulados por meio de operações morfológicas. A quantificação dos detritos foi realizada pela diferença entre o espaço do canal radicular não preparado e o preparado, utilizando procedimentos de pós-processamento no software Fiji (Fig. 1A–H). A presença de um material com densidade semelhante à da dentina em regiões anteriormente ocupadas por ar no espaço do canal radicular não preparado foi considerada detrito e quantificada pela interseção entre imagens antes e depois da instrumentação do canal. A identificação de detritos de tecido duro foi resultado da interseção (E) da imagem do canal radicular preparado sem nenhum detrito e a mesma imagem invertida, mas com detrito dentro. O volume do espaço do canal correspondente antes e depois da preparação e o volume total de detritos de tecido duro acumulados foram calculados em valores absolutos.

O resultado de A ou B; canal preparado sem detritos; o canal não preparado não possui. (D) Uma imagem invertida de B. (E) O resultado de C e D; as áreas comuns
representam os espaços vazios que foram preenchidos após a preparação. (F–H) Detritos totais. (F) Canal preparado segmentado sem detritos. (G) O resultado de F ou C. (H) O resultado de G e D; detritos em istmos e no espaço do canal instrumentado.
Subsequentemente, o conjunto de imagens obtidas após a quantificação de detritos (Fig. 2A–E) foi renderizado em 3 dimensões usando um plug-in de visualização 3D (Internationale Medieninformatik; HTW Berlin, Berlim, Alemanha). Modelos tridimensionais do canal não preparado, canal preparado e total de detritos foram renderizados (Fig. 2F–H). O software CTVol v.2.2.1 (Bruker-microCT) foi utilizado para visualização e avaliação qualitativa dos modelos 3D.
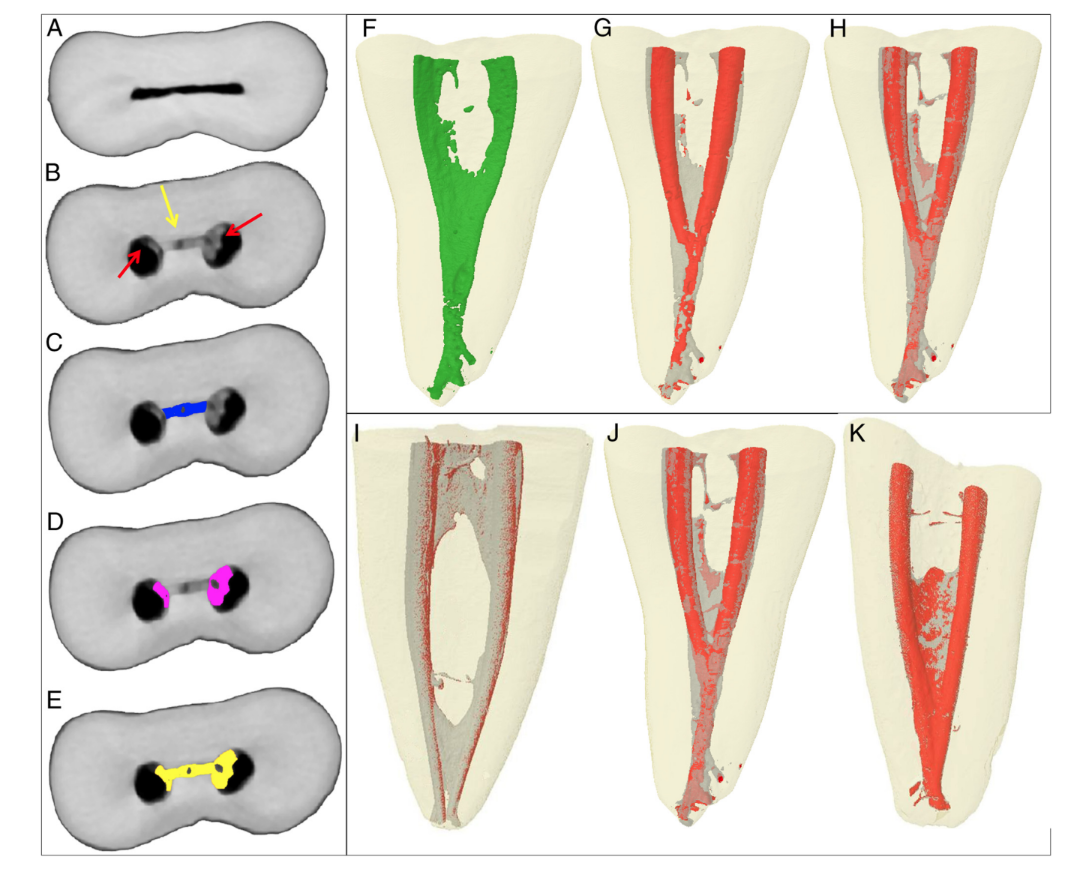
Resultados
Foi possível identificar e medir os detritos de tecido duro acumulados após a preparação nos canais radiculares mesiais para todos os protocolos testados (Fig. 2I–K). Tabela 1 mostra o volume percentual de tecido duro acumulado após a preparação dos canais mesiais de molares mandibulares utilizando diferentes protocolos de irrigação. A preparação do canal radicular sem irrigação (grupo controle positivo) resultou em 34,6% de seu volume preenchido com detritos de tecido duro, enquanto o uso de água bidestilada ou 5,25% de NaOCl seguido de 17% de EDTA mostrou uma redução no volume percentual de detritos para 16% e 11,3%, respectivamente; isso foi claramente observado nos modelos 3D em Figura 2. Essa redução também foi observada quando a área do istmo foi analisada separadamente.
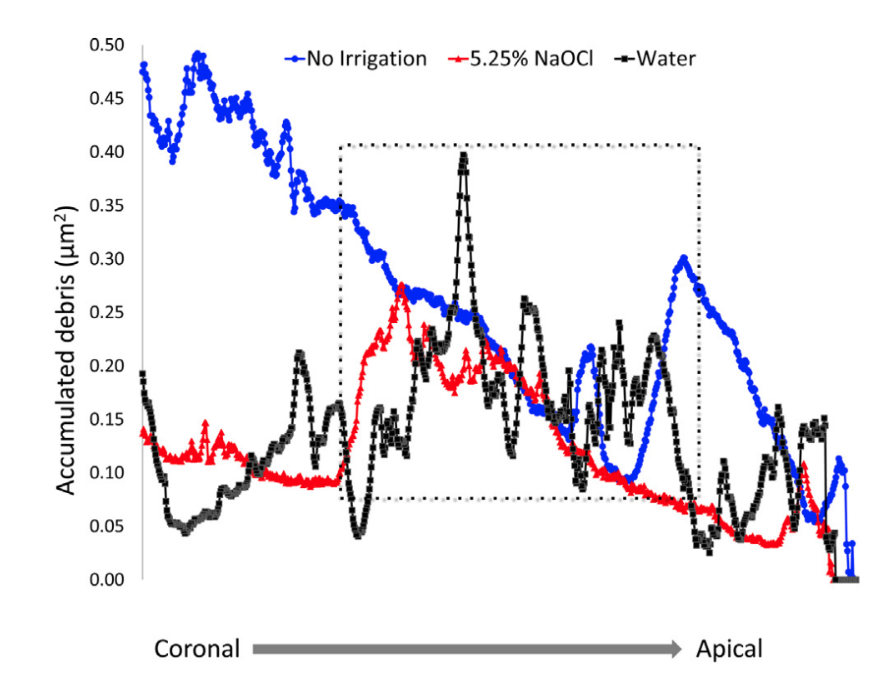
Após a avaliação qualitativa dos modelos 3D e das seções transversais dos espécimes, foi possível observar que detritos de tecido duro se acumularam não apenas nas áreas dos istmos, mas também nas irregularidades das paredes dentinárias (Fig. 2D e G), ressaltando que esse foi um padrão ao longo de todo o comprimento do canal radicular. A distribuição dos detritos de tecido duro acumulados ao longo dos níveis do canal radicular é mostrada no gráfico em Figura 3.
Discussão
Na endodontia, a tecnologia de micro-CT não destrutiva tem sido utilizada com sucesso para medir detritos em experimentos ex vivo. Através do método presente, foi possível calcular o volume de detritos de tecido duro acumulados nas istmuses e no espaço do canal radicular instrumentado de forma separada (Fig. 2A–E). A capacidade de avaliar independentemente os detritos, seja na área do istmo não instrumentado ou no espaço do canal radicular instrumentado, é adequada na medida em que permite entender o efeito de uma determinada técnica de preparo ou protocolo de irrigação em cada uma dessas áreas ou no sistema do canal radicular como um todo. Até onde os autores sabem, este é um aspecto inovador em comparação com estudos anteriores nos quais as medições estavam limitadas à área do istmo. Pode-se supor que o processamento e a análise de imagem utilizados nos estudos anteriores não foram capazes de discernir entre o espaço do canal radicular preparado e os detritos acumulados densamente. Isso pode explicar por que os detritos acumulados estavam sobrepostos à anatomia original do canal radicular em vez de à anatomia após o preparo.
De acordo com alguns relatórios anteriores, a solução de hipoclorito de sódio combinada com diferentes protocolos de irrigação não foi capaz de remover completamente os detritos de áreas de canal radicular de difícil acesso, como istmos, aletas e irregularidades; os resultados atuais corroboram essas descobertas, que podem ser facilmente observadas nos modelos 3D dos dentes preparados (Fig. 2). Neste relatório inicial, as medições foram realizadas apenas para mostrar que o método é capaz de calcular de forma confiável os detritos de tecido duro acumulados tanto nas áreas de istmo quanto no canal radicular preparado; essa foi a razão pela qual apenas 3 dentes foram utilizados, e, portanto, nenhuma comparação estatística foi feita. Mesmo assim, pode-se supor que os canais irrigados com água bidestilada mostraram uma maior tendência a reter detritos em comparação com o protocolo de irrigação convencional, mesmo que a mesma taxa de fluxo da solução e o mesmo tempo de irrigação tenham sido aplicados em ambos os casos (Fig. 2I–K). O objetivo geral deste estudo foi testar se um método de abordagem de software livre seria eficaz na medição do acúmulo de detritos e também apontar diferenças na medição dos resultados. Por essa razão, nenhum grupo experimental considerável foi criado, e apenas 3 dentes foram utilizados. Portanto, além dos dados quantitativos, uma análise descritiva qualitativa foi realizada, e foi suficiente para exibir as diferenças entre os 3 protocolos, pois o tamanho do efeito testado é grande e forte.
Como esperado, o volume percentual de detritos de tecido duro acumulados foi maior nos canais não irrigados (34,6%) e nos canais irrigados com água bidestilada (16%) em comparação com o protocolo de irrigação convencional, que mostrou notavelmente menos detritos remanescentes (11,3%). A capacidade de dissolução de tecido do hipoclorito aquoso combinado com EDTA pode explicar o menor percentual de detritos remanescentes no canal radicular. Da mesma forma, na área do istmo, o menor volume percentual de detritos também foi observado quando os canais foram irrigados com 5,25% de NaOCl mais 17% de EDTA. Como esperado, o dente não irrigado apresentou notavelmente mais detritos acumulados, certamente devido à falta do efeito do fluxo líquido. Isso está em linha com um estudo clássico de Baker et al, que encontrou 70% mais detritos quando a instrumentação do canal foi realizada sem qualquer irrigação.
É uma descoberta notável que o volume percentual de detritos no presente estudo foi menor do que os previamente relatados. Isso é, de fato, esperado e pode ser explicado porque, nesses estudos, o volume do canal radicular antes da preparação foi utilizado para comparação, enquanto no estudo atual o parâmetro de referência foi o volume do canal após a preparação. A suposição por trás dessa nova abordagem é baseada na lógica de que o volume final do canal é o volume real do canal após o alargamento mecânico.
Normalmente, pacotes de software proprietários são bastante caros, e sua disponibilidade para a comunidade de pesquisa em geral é limitada. Além disso, a maioria deles não atende a funções especiais necessárias para a pesquisa em endodontia. Para este artigo, a seleção de software de processamento e visualização de imagens foi baseada em uma principal restrição de estar disponível gratuitamente. Resumidamente, o pacote NRecon (Brucker micro-CT) foi utilizado para reconstruir imagens em seções transversais a partir de imagens de projeção de tomografia. Em seguida, o software Seg3D (Institutos Nacionais de Saúde - Centro de Computação Biomédica Integrativa) foi utilizado para registrar conjuntos de dados antes e depois da preparação do canal radicular. Finalmente, a quantidade de detritos foi calculada com o software Fiji. Este é um aspecto importante e pode beneficiar grupos de pesquisa de todos os orçamentos. Como consequência, softwares gratuitos podem ajudar a disseminar o uso de métodos de reconstrução 3D e micro-CT em geral.
Por um lado, o software utilizado aqui possui muitas ferramentas automáticas para processamento e registro de dados que tornam a análise de imagens um procedimento menos trabalhoso e demorado. Por outro lado, essa gama de ferramentas automáticas pode levar a alguns erros processuais que refletem nas medições finais. Portanto, uma atenção especial foi direcionada à precisão do processo de registro realizado com o software Seg3D e à precisão da análise e processamento de imagens digitais com o software Fiji através do uso de rolamentos de esferas de alumínio. No entanto, ao contrário das descobertas de Robinson et al., o erro computacional para as maiores esferas foi menor para todas as amostras, enquanto as menores mostraram resultados iguais para volume. Consequentemente, as medições realizadas pelo software Fiji foram consideradas confiáveis para quantificar volume mesmo em pequenas amostras.
Um grande esforço também foi feito para garantir a criação de uma linha de base robusta em relação ao comprimento e curvatura do canal radicular, bem como à configuração anatômica. Este é um passo crítico com o objetivo de minimizar o efeito da anatomia nos resultados finais. No presente estudo, apenas canais com a classificação tipo II de Vertucci foram escolhidos para garantir a presença de istmos e comunicação entre os canais mesiais, bem como áreas de difícil acesso onde os detritos teciduais tendem a se acumular.
Um design de canal de extremidade fechada foi utilizado para simular configurações in vivo nas quais o forame está enclausurado dentro do osso alveolar e do ligamento periodontal; de acordo com Tay et al, o sistema de canal fechado produz aprisionamento de gás, o que muitas vezes impede que o irrigante alcance os últimos milímetros apicais do espaço do canal. Essa mesma abordagem foi utilizada em outros estudos, o que enfatiza a preocupação científica em entender o efeito do aprisionamento de gás nos protocolos de irrigação.
Istmos conectando múltiplos canais são o tipo de configuração anatômica que apresenta um desafio clínico diretamente relacionado aos protocolos de irrigação, pois todas as técnicas de preparação frequentemente deixam para trás resíduos acumulados de tecidos duros e moles, bem como microrganismos nessas áreas de difícil acesso. Para melhorar a entrega e o fluxo do irrigante, diferentes dispositivos e soluções estão disponíveis. Neste estudo, foi utilizada uma solução de NaOCl a 5,25% seguida de EDTA a 17%, pois é a solução de irrigação mais comumente utilizada em todo o mundo e possui propriedades de ser um solvente eficiente de tecido inorgânico e orgânico. Água bidistilada foi utilizada como um protocolo de irrigação controle presumido como menos eficaz, pois a água é uma solução inerte e, assim, apenas o efeito físico do fluxo do irrigante seria esperado. Além disso, o tempo (30 minutos) e o volume total (40 mL) dos irrigantes foram cuidadosamente observados para garantir condições de irrigação física comparáveis entre esses protocolos experimentais, reproduzindo um padrão clínico sólido. Seguindo o estudo de Paqué et al, nenhum protocolo de irrigação foi utilizado aqui; assim, foi possível garantir um padrão para comparação com um grande empacotamento de detritos originado da ação mecânica direta do instrumento nas paredes dentinárias e também sem contar com qualquer efeito de fluxo da solução irrigante.
Uma vez que se sabe que a limpeza e a modelagem são processos relevantes para o resultado da terapia endodôntica, novos experimentos são necessários para avaliar estratégias antidebris e testar a potencial correlação entre os detritos de tecido duro acumulados e a penetração da solução irrigante, a sobrevivência microbiana dentro da complexa anatomia do canal radicular e o preenchimento do canal radicular.
Em conclusão, apesar da longa curva de aprendizado necessária para lidar com essas novas tecnologias de imagem, os pacotes de software livre utilizados para reconstrução, registro e análise de imagens no presente estudo mostraram-se promissores para a aplicação do usuário final na pesquisa endodôntica contemporânea.
Autores: Gustavo De-Deus, Juliana Marins, Aline de Almeida Neves, Claudia Reis, Sandra Fidel, Marco A. Versiani, Haimon Alves, Ricardo Tadeu Lopes, Sidnei Paciornik
Referências:
- McComb D, Smith DC. Um estudo preliminar de microscopia eletrônica de varredura de canais radiculares após procedimentos endodônticos. J Endod 1975;1:238–42.
- De-Deus G, Reis C, Paciornik S. Avaliação crítica de estudos publicados sobre remoção de camada de detritos: questões metodológicas. Oral Surg Oral Med Oral Pathol Endod 2011;112: 531–43.
- Glossário de Termos de Endodontia, 8ª ed. Chicago, IL: Associação Americana de Endodontistas; 2012.
- Paqué F, Laib A, Gautschi H, et al. Análise da acumulação de detritos de tecido duro por meio de tomografias computadorizadas de alta resolução. J Endod 2009;35:1044–7.
- Robinson JP, Lumley PJ, Claridge E, et al. Uma metodologia analítica de Micro CT para quantificar detritos inorgânicos de dentina após preparação interna do dente. J Dent 2012;40:999–1005.
- Versiani MA, Leoni GB, Steier L, et al. Estudo de microtomografia computadorizada de canais de formato oval preparados com os sistemas Self-adjusting File, Reciproc, WaveOne e Pro-Taper Universal. J Endod 2013;39:1060–6.
- Paqué F, Boessler C, Zehnder M. Níveis acumulados de detritos de tecido duro nas raízes mesiais de molares mandibulares após etapas sequenciais de irrigação. Int Endod J 2010; 44:148–53.
- Paqué F, Rechenberg D-K, Zehnder M. Redução da acumulação de detritos de tecido duro durante a instrumentação rotatória do canal radicular por ácido etidrônico em um irrigante de hipoclorito de sódio. J Endod 2012;38:692–5.
- Paqué F, Al-Jadaa A, Kfir A. Acumulação de detritos de tecido duro criada pela instrumentação rotatória convencional versus instrumentação de arquivo autoajustável em sistemas de canal radicular mesial de molares mandibulares. Int Endod J 2012;45:413–8.
- Schneider SW. Uma comparação das preparações de canais em canais radiculares retos e curvos. Oral Surg Oral Med Oral Pathol Endod 1971;32:271–5.
- Schindelin J, Arganda-Carreras I, Frise E, et al. Fiji: uma plataforma de código aberto para análise de imagens biológicas. Nature methods 2012;9:676–82.
- Vertucci FJ. Morfologia do canal radicular e sua relação com os procedimentos endodônticos. Endod Topics 2005;10:3–29.
- Susin L, Liu Y, Yoon JC, et al. Eficácia da desinfecção de canal e istmo de duas técnicas de agitação de irrigantes em um sistema fechado. Int Endod J 2010;43: 1077–90.
- Tay FR, Gu LS, Schoeffel GJ, et al. Efeito do bloqueio de vapor na desinfecção do canal radicular usando uma agulha com ventilação lateral para entrega de irrigante sob pressão positiva. J Endod 2009;36: 745–50.
- Peters OA, Boessler C, Paqué F. Preparação do canal radicular com um novo instrumento de níquel-titânio avaliado com microtomografia computadorizada: preparação da superfície do canal ao longo do tempo. J Endod 2010;36:1068–72.
- Peters OA. Desafios e conceitos atuais na preparação de sistemas de canal radicular: uma revisão. J Endod 2004;30:559–67.
- Gao Y, Peters OA, Wu H, et al. Uma estrutura de aplicação de reconstrução e medição tridimensional para pesquisa endodôntica. J Endod 2009;35:269–74.
- Johnson M, Sidow SJ, Looney SW, et al. Eficácia da desinfecção de canal e istmo usando uma técnica de irrigação sônica em um sistema de canal fechado. J Endod 2012;38: 1265–8.
- Baker NA, Eleazer PD, Averbach RE, et al. Estudo de microscopia eletrônica de varredura da eficácia de várias soluções irrigantes. J Endod 1975;1:127–35.
- Peters OA, Peters CI, Schönenberger K, et al. Preparação rotatória do canal radicular ProTaper: efeitos da anatomia do canal na forma final analisada por micro CT. Int Endod J 2003;36:86–92.
- Versiani MA, P´ecora JD, Sousa-Neto MD. Análise de microtomografia computadorizada da morfologia do canal radicular de caninos mandibulares de raiz única. Int Endod J 2013;46: 800–7.
- De Pablo OV, Estevez R, Péix Sánchez M, et al. Anatomia radicular e configuração do canal do primeiro molar mandibular permanente: uma revisão sistemática. J Endod 2010;36: 1919–31.
- Adcock JM, Sidow SJ, Looney SW, et al. Avaliação histológica da eficácia da desinfecção de canal e istmo de duas técnicas diferentes de entrega de irrigantes em um sistema fechado. J Endod 2011;37:544–8.
- Parente JM, Loushine RJ, Susin L, et al. Desinfecção do canal radicular usando agitação dinâmica manual ou o EndoVac para irrigação final em um sistema fechado e um sistema aberto. Int Endod J 2010;43:1001–12.
- Gu Li-sha, Kim Jong Ryul, Ling Junqi, et al. Revisão das técnicas e dispositivos contemporâneos de agitação de irrigantes. J Endod 2009;35:791–804.
- Saleh IM, Ruyter IE, Haapasalo M, et al. Penetração bacteriana ao longo de diferentes materiais de preenchimento de canal radicular na presença ou ausência de camada de detritos. Int Endod J 2008;41:32–40.
- Siqueira JJ, Alves FR, Versiani MA, et al. Análise bacteriológica e microtomográfica correlativa dos canais mesiais de molares mandibulares preparados pelos sistemas SAF, Reciproc e Twisted File. J Endod 2013;39: 1044–50.
- De-Deus G, Reis C, Beznos D, et al. Capacidade limitada de três técnicas de guta-percha termoplástica comumente usadas no preenchimento de canais de formato oval. J Endod 2008;34: 1401–5.


