Eficácia de 3 Protocolos de Irrigação Suplementar na Remoção de Detritos de Tecido Duro do Sistema de Canal Radicular Mesial de Molares Mandibulares
Tradução automática
O artigo original está escrito em EN language (link para lê-lo) .
Resumo
Introdução: A instrumentação do sistema de canais radiculares mesiais de molares mandibulares pode dificultar a desinfecção ao empacotar detritos de tecido duro dentro dos istmos. A remoção de detritos de tecido duro acumulados (DTDA) por 3 sistemas de irrigação suplementares, 2 ativados ultrassonicamente e 1 multissônico, foi avaliada com imagens de microtomografia computadorizada.
Métodos: Vinte e quatro molares mandibulares extraídos com 2 canais mesiais conectados por um istmo e convergindo para um único forame foram selecionados. Após a preparação dos canais mesiais com instrumentos WaveOne Gold (Dentsply Maillefer, Ballaigues, Suíça), espécimes anatomicamente correspondentes foram atribuídos a 3 protocolos finais de irrigação (n = 8): ultrassônico intermitente (IU) com um fio de 200 mm energizado ultrassonicamente (Irrisafe; Satelec, Bordeaux, França), ultrassônico contínuo (CU) com uma agulha de irrigação ultrassônica (ProUltra PiezoFlow, Dentsply Maillefer) e sistema GentleWave (GW) (Sonendo Inc, Laguna Hills, CA). Os espécimes foram escaneados (SkyScan 1176; Bruker-microCT, Kontich, Bélgica) com tamanho de pixel de 17,18 mm antes e depois dos protocolos de preparação e irrigação. Os conjuntos de dados foram coregistrados, e a porcentagem de redução de DTDA calculada dentro dos canais e do istmo para cada espécime foi comparada estatisticamente usando análise de variância unidirecional e testes post hoc de Tukey com um nível de significância de 5%.
Resultados: A redução percentual média de AHTD em canais e istmos foi significativamente maior para GW (96,4% e 97,9%, respectivamente) do que para CU (80,0% e 88,9%, respectivamente) (P ˂ .05). A redução de AHTD para IU (91,2% e 93,5%, respectivamente) não diferiu significativamente de GW e CU (P ˃ .05).
Conclusões: GW alcançou maior eficácia na remoção de AHTD do sistema de canal radicular mesial de molares mandibulares em comparação com CU, mas não com IU. A eficácia de CU e IU foi comparável. (J Endod 2019;■:1–7.)
A desinfecção do canal radicular, realizada rotineiramente usando protocolos quimio-mecânicos, pode ser comprometida pela incapacidade de instrumentos e soluções antibacterianas de alcançar áreas inacessíveis do canal. Ramificações apicais, canais laterais e istmos conectando canais radiculares principais têm mostrado abrigar células bacterianas frequentemente organizadas em estruturas semelhantes a biofilmes. Um istmo é definido como uma comunicação estreita entre 2 canais na mesma raiz que contém tecido derivado da polpa. Também foi descrito como um corredor, uma conexão lateral e uma anastomose transversal.
Em raízes com istmos, a instrumentação dos canais principais inadvertidamente transporta detritos de tecido duro para os istmos, onde permanecem compactados apesar da irrigação copiosa durante e após a instrumentação. Detritos de tecido duro acumulados (DTDA) são um efeito colateral indesejável dos procedimentos de desinfecção quimio-mecânica, pois podem abrigar microrganismos persistentes enquanto impedem o acesso a soluções de irrigação antibacterianas.
Os primeiros molares mandibulares são os dentes mais frequentemente tratados endodonticamente. Esses dentes frequentemente apresentam configurações complexas de canais radiculares, com comunicações de istmo presentes em 55% das raízes mesiais e 20% das raízes distais. A incidência de istmo é maior a 3–5 mm do ápice, onde foi observado clinicamente durante a cirurgia apical em 83% das raízes mesiais e 36% das raízes distais dos primeiros molares mandibulares.
Considerando a alta incidência de istmos no sistema de canais radiculares e sua inacessibilidade à instrumentação mecânica, sua desinfecção depende criticamente da entrega eficaz de soluções antibacterianas.
Desde a entrega tradicional por agulha de seringa até sistemas de agitação assistidos por máquina, os métodos de irrigação foram refinados ao longo dos anos para melhorar a entrega de soluções de irrigação em áreas mecanicamente inacessíveis do complexo sistema de canais radiculares. A aplicação de soluções de irrigação e agitação ultrassônica durante a irrigação ativada ultrassonicamente pode ser intermitente ou contínua.
Enquanto o método de irrigação ativada ultrassonicamente contínua (CU) é realizado por meio de uma agulha de irrigação ativada ultrassonicamente, a irrigação ativada ultrassonicamente intermitente (IU) requer um instrumento vibratório dentro do canal e reabastecimento da solução com uma seringa após cada ciclo de ativação.
O sistema GentleWave (GW) (Sonendo Inc, Laguna Hills, CA) é um dispositivo de desinfecção por pressão negativa apical inovador que requer mínima instrumentação do canal radicular, conforme o fabricante. O sistema aplica dinâmica de fluidos avançada, acústica e química de dissolução de tecidos para remover tecido, detritos e biofilmes de todo o sistema de canais radiculares simultaneamente. O dispositivo foi recentemente aprovado para uso clínico em endodontia, e uma avaliação independente é necessária. Até o momento, apenas 1 estudo mostrou histologicamente a eficácia do sistema GW na remoção de detritos dos istmos de molares maxilares e mandibulares. O uso de métodos de avaliação não destrutivos é necessário para investigar a capacidade do sistema GW de melhorar a limpeza dos istmos.
Portanto, o objetivo do presente estudo foi avaliar a eficácia do sistema GW em comparação com a irrigação ativada ultrassonicamente intermitente e contínua na remoção de AHTD de canais radiculares e istmos dentro das raízes mesiais de molares mandibulares usando imagem de microtomografia computadorizada (micro-CT). A hipótese nula testada foi que não haveria diferença na redução de AHTD entre esses 3 protocolos de irrigação suplementares.
Materiais e métodos
Tamanho da amostra
O tamanho da amostra foi estimado com base em dados preliminares obtidos de 5 espécimes. Seguindo os mesmos protocolos de instrumentação e irrigação final descritos posteriormente, 2 espécimes foram atribuídos aos grupos GW e CU e 1 espécime ao grupo IU. O tamanho do efeito do grupo IU foi estabelecido a partir do anteriormente relatado por Leoni et al (1,25). Usando o software G*Power 3.1.9.2
(Heinrich Heine Universität, Düsseldorf, Alemanha) para análise de variância unidirecional e os dados do estudo piloto, uma amostra total mínima de 18 espécimes suportaria a análise com 99% de poder e um nível de significância de 5% para substanciar estatisticamente as diferenças entre os grupos experimentais. Um total de 24 espécimes foi incluído na análise final.
Seleção de Espécimes
O protocolo do estudo foi aprovado por ambos os comitês de ética institucionais da Universidade de Toronto e da Universidade de São Paulo (protocolo #35314). Inicialmente, 50 molares mandibulares extraídos com raízes mesiais moderadamente curvadas (10◦–20◦, método de Schneider) nas direções mesiodistal e buccolingual foram imageados com um scanner de micro-CT (SkyScan 1176; Bruker-microCT, Kontich, Bélgica) a 17,18 mm (tamanho do pixel), 90 kV, 278 mA, rotação de 180◦ ao redor do eixo vertical, e um passo de rotação de 0,4◦ usando um filtro de alumínio de 0,5 mm de espessura. As imagens de projeção adquiridas foram reconstruídas (NRecon v.1.6.10.4, Bruker-microCT) com uma correção de endurecimento do feixe de 10%, suavização de 2, correção de artefato de anel de 3, e um coeficiente de atenuação variando de 0,006–0,04, resultando na aquisição de aproximadamente 550 cortes por raiz. Em seguida, 24 dentes apresentando 2 canais independentes na raiz mesial conectados por um istmo do terço médio ao terço apical e saindo em um único forame (configuração tipo II de Vertucci) foram selecionados. Nenhum dos dentes tinha obturações radiculares, cáries radiculares, fissuras, fraturas, reabsorção interna ou externa. Para garantir uma similaridade anatômica entre os espécimes, o comprimento (em mm), volume (em mm3), área de superfície (em mm2), e o Índice de Modelo de Estrutura (SMI) dos canais radiculares mesiais antes dos procedimentos experimentais foram calculados (CTAn v.1.15, Bruker-microCT) (Tabela 1). O volume de interesse foi selecionado estendendo-se do nível da junção cemento-esmalte até o ápice da raiz mesial definido pela integração de todas as seções transversais.
Preparação do Canal Radicular
Os canais radiculares mesiais em todos os espécimes foram preparados por 1 operador (R.C.) experiente no uso de instrumentos reciprocantes. Após a preparação da cavidade de acesso, os canais mesiais foram negociados com arquivos tipo K tamanho 10 (Dentsply Maillefer, Ballaigues, Suíça), e a emergência da ponta no forame apical foi verificada sob 10X de ampliação (Carl Zeiss, Oberkochen, Alemanha). O comprimento de trabalho (WL) foi estabelecido 0,5 mm antes do forame. Em seguida, o forame foi selado cobrindo a ponta apical das raízes mesiais com cola quente para simular um sistema de canal de extremidade fechada. Um caminho de deslizamento foi estabelecido até o WL com um instrumento ProGlider (Dentsply Maillefer), e os canais radiculares foram progressivamente alargados com instrumentos WaveOne Gold Small e Primary (Dentsply Maillefer) até o WL ativado em um movimento reciprocante (ProMark Endo Motor, Dentsply Maillefer). Para facilitar a acumulação de detritos na área do istmo, a irrigação e aspiração durante os procedimentos de preparação foram realizadas apenas no nível do orifício com um total de 5 mL de água destilada por canal usando uma agulha de irrigação ProRinse Endo 30-G (Dentsply Maillefer) adaptada a uma seringa plástica descartável.
Cada canal foi levemente seco com 1 ponto de papel absorvente (WaveOne Small, Dentsply Maillefer), e as amostras foram submetidas a uma nova varredura e análise seguindo os parâmetros mencionados. As varreduras pós-operatórias foram coregistradas com seu respectivo conjunto de dados pré-operatórios usando o módulo de registro afim do software 3D Slicer 4.10 (disponível em http://www.slicer.org), e os parâmetros 3D pós-operatórios (volume, área de superfície e SMI) também foram adquiridos (Tabela 1). Em seguida, modelos de superfície registrados espacialmente das raízes foram comparados em relação à área não preparada do canal radicular (Tabela 1) calculada pela fórmula (SAu/SAb)*100, onde SAu representa a área de superfície do canal não preparado e SAb a área de superfície do canal radicular antes da preparação, para garantir a consistência do protocolo de instrumentação. Uma nova análise das imagens correspondentes também foi realizada para calcular os detritos de tecido duro acumulados dentro do sistema de canal radicular mesial após os procedimentos de instrumentação usando o software CTAn v.1.15 (Bruker micro-CT).
A quantificação do AHTD foi realizada pela diferença entre o espaço do canal radicular não preparado e o preparado, utilizando procedimentos de pós-processamento. A presença de um material com densidade semelhante à da dentina em regiões anteriormente ocupadas por ar no espaço do canal radicular não preparado foi considerada detrito e quantificada pela interseção entre imagens antes e depois da instrumentação do canal. O volume total de AHTD foi calculado em milímetros cúbicos (mm3) e expresso como a porcentagem do volume total do sistema do canal e da área do istmo após a preparação (Tabela 1).
Protocolos Finais de Irrigação
Com o objetivo de aumentar a validade interna do experimento, os canais radiculares mesiais foram pareados para criar 8 grupos de 3 com base na morfologia do sistema do canal radicular (comprimento, volume, área de superfície e SMI), a superfície do canal não preparada e a porcentagem do volume de AHTD após a preparação. Em seguida, 1 espécime de cada grupo foi aleatoriamente atribuído a 1 dos seguintes 3 grupos experimentais (n = 8) de acordo com os protocolos finais de irrigação, que seguiram as diretrizes dos fabricantes:
- Grupo 1: IU; um arquivo ultrassônico de aço inoxidável de 200 mm (Irrisafe; Satelec, Bordeaux, França) não cortante, acionado pelo sistema ultrassônico P5 Newtron (Acteon North America, Mount Laurel, NJ) em uma configuração de potência de 9, foi colocado a 2 mm da WL e agitado em um movimento para cima e para baixo de 1 a 2 mm. O protocolo final de irrigação começou com 6% de NaOCl por 3 X 20 segundos, seguido por 17% de EDTA por 3 X 20 segundos e um enxágue final com 6% de hipoclorito de sódio (NaOCl) por 3 X 20 segundos. A irrigação foi realizada a uma taxa de fluxo de 15 mL/min por canal.
- Grupo 2: CU; uma agulha de irrigação ultrassônica ProUltra PiezoFlow (ProUltra, Dentsply Maillefer) foi conectada ao sistema ultrassônico P5 Newtron (Acteon North America) em uma configuração de potência de 9. A agulha de irrigação ultrassônica de 500 mm foi posicionada 1 mm antes do ponto de contato, não mais profunda que 75% do comprimento de trabalho, e agitada em um movimento para cima e para baixo de 1 a 2 mm. O protocolo final de irrigação começou com 6% de NaOCl, seguido por 17% de EDTA e um enxágue final com 6% de NaOCl. A irrigação foi realizada a uma taxa de fluxo de 15 mL/min por 1 minuto por canal.
- Grupo 3: GW; antes do protocolo final de irrigação, uma plataforma oclusal foi fabricada com um material de resina (SoundSeal, Sonendo Inc) e uma matriz plástica pré-formada para garantir um selo hermético entre a cavidade de acesso e o instrumento de procedimento. O protocolo final de irrigação começou com 3% de NaOCl por 5 minutos, seguido por água destilada por 30 segundos, 8% de EDTA por 2 minutos e um enxágue final com água destilada por 15 segundos a uma taxa de fluxo de 50 mL/min.
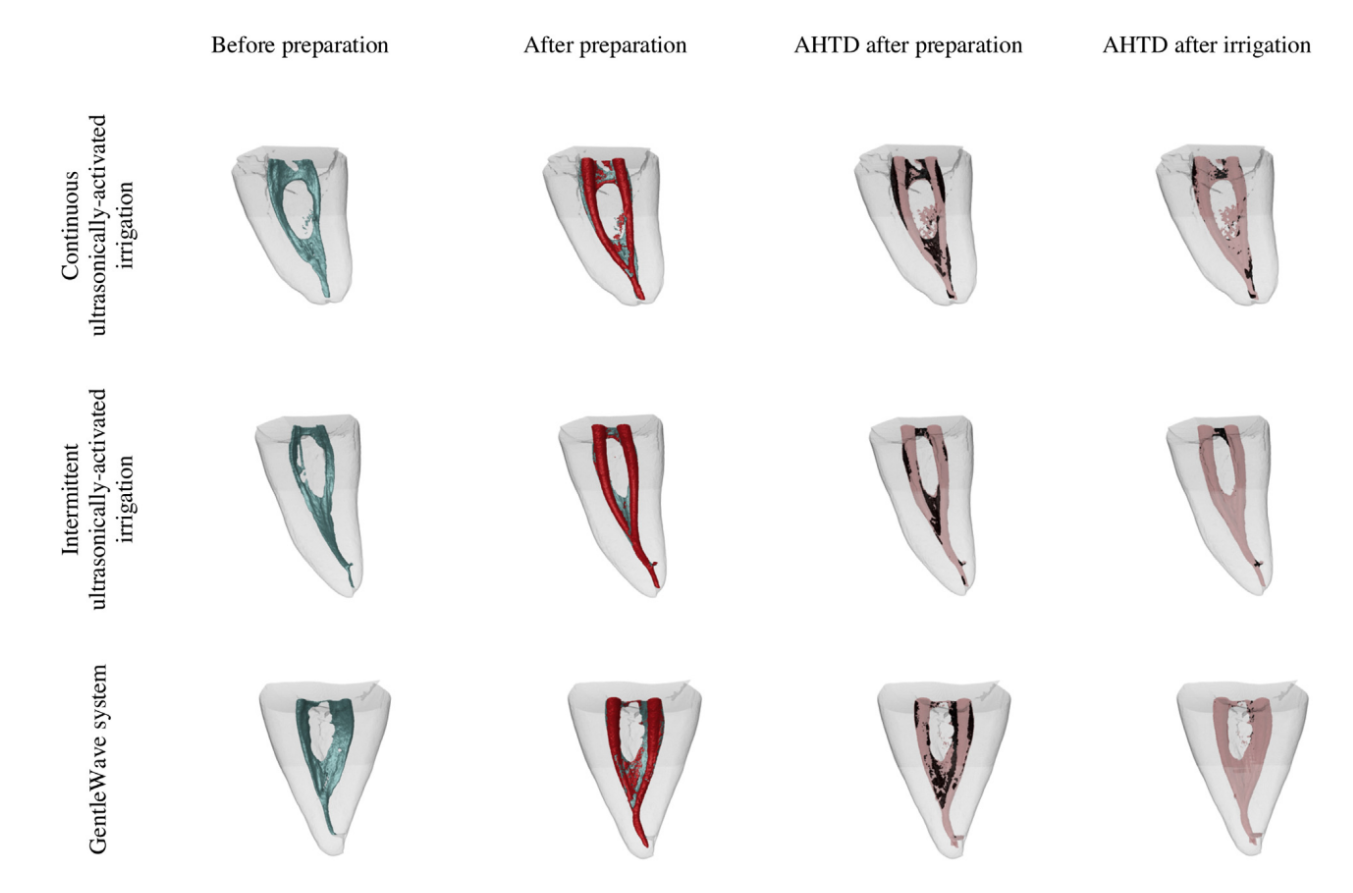
A varredura pós-irrigação foi realizada após a conclusão dos protocolos finais de irrigação designados. Os conjuntos de dados foram registrados com seus respectivos contrapartes pós-preparação, e a porcentagem de redução de AHTD foi calculada de acordo com a seguinte fórmula: 100 – ([VAF X 100)/VBF), onde VBF e VAF são o volume de AHTD antes e depois do protocolo de irrigação, respectivamente. Um examinador cego para a atribuição do grupo das amostras realizou todas as medições. Modelos de canais radiculares codificados por cores correspondentes (cores verde e vermelha indicando superfícies do canal pré e pós-operatórias, respectivamente) e detritos (na cor preta) possibilitaram a comparação qualitativa da distribuição do AHTD em cada porção dos canais radiculares antes e depois dos procedimentos experimentais.
Microscopia Eletrônica de Varredura
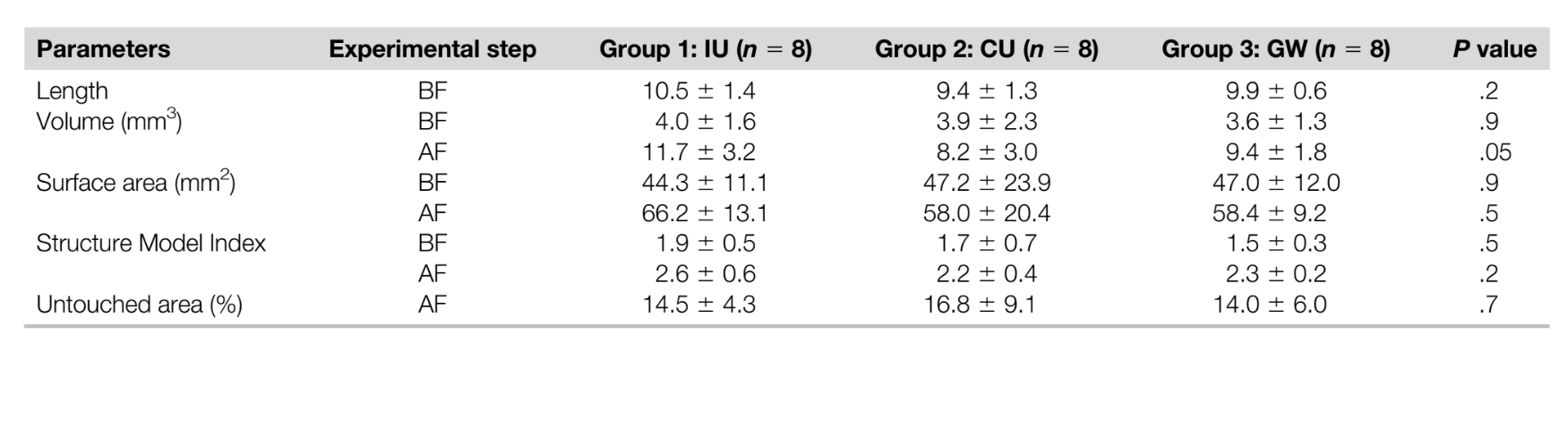
Para validar o método, após as varreduras pós-irrigação, seções transversais axiais nos terços coronal, médio e apical da raiz de 2 amostras selecionadas aleatoriamente foram examinadas sob microscopia eletrônica de varredura ambiental (S-3400N; Hitachi, Tóquio, Japão) até 420X de magnificação para corroborar a presença de detritos nas áreas do istmo após o protocolo final de irrigação (Fig. 1A–E). Resumidamente, após a remoção das raízes distais no nível da junção cemento-esmalte, sulcos foram cortados nas raízes mesiais com um disco revestido de diamante próximo, mas sem expor os canais e áreas do istmo em níveis predeterminados a partir das varreduras de micro-CT correspondentes onde AHTD residual estava presente. As amostras foram então divididas horizontalmente com um cinzel afiado e um martelo. As amostras não processadas foram imagens a uma tensão de aceleração de 5 kV e a uma distância de trabalho de 15 mm.
Análise Estatística
A distribuição normal dos dados foi avaliada, e a morfologia tridimensional dos canais radiculares (comprimento, volume, área de superfície e SMI), superfície do canal não preparada e porcentagem de AHTD após os protocolos de preparação e irrigação foram expressas como média e desvio padrão e comparadas entre os grupos usando análise de variância unidirecional e testes post hoc de Tukey com um nível de significância de 5%.
Resultados
O grau de homogeneidade dos 3 grupos experimentais foi confirmado em relação aos parâmetros morfológicos pré e pós-operatórios (comprimento do canal, volume, área de superfície e SMI), superfície do canal não preparada e o volume de AHTD após a preparação do canal (Tabela 1, P . .05). A observação qualitativa das imagens de microscopia eletrônica de varredura correspondeu bem às áreas radiopacas dentro dos istmos e ao AHTD representado na reconstrução tridimensional de micro-CT do mesmo espécime (Fig. 1).
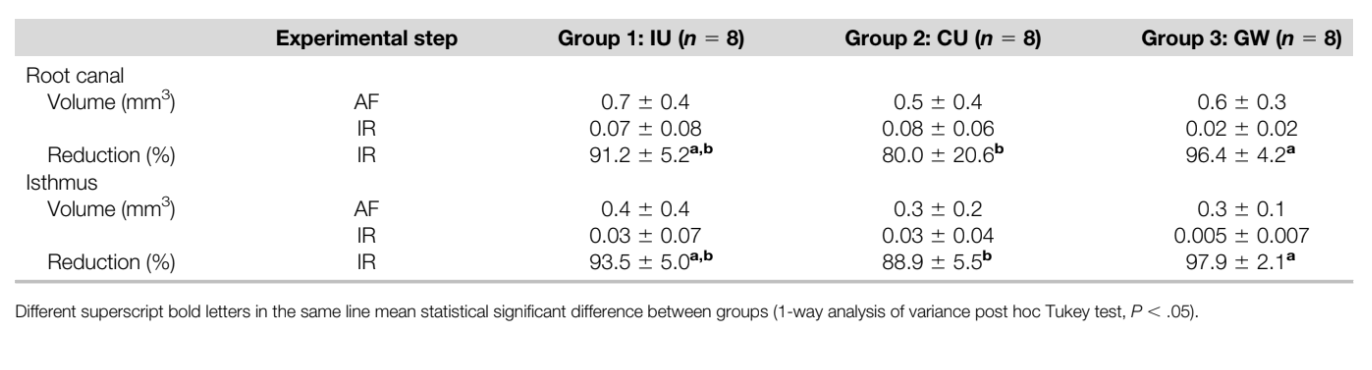
Protocolos de irrigação suplementar reduziram consideravelmente a AHTD em todos os grupos (Tabela 2); no entanto, a redução percentual média da AHTD foi significativamente maior para GW nos canais (96,4%) e nas áreas do istmo (97,9%) quando comparado com CU (80,0% e 88,9%, respectivamente) (P , .05). Por outro lado, a redução da AHTD para IU nos canais e nas áreas do istmo (91,2% e 93,5%, respectivamente) não diferiu significativamente de GW e CU (P . .05) (Tabela 2, Fig. 2). A maior parte da AHTD residual após a irrigação final estava localizada nos terços coronal e apical dos canais radiculares em todos os grupos (Fig. 2).
Discussão
A periodontite apical é uma doença mediada por biofilme, e a incapacidade de impactar os biofilmes em áreas do sistema de canal radicular que são inacessíveis aos protocolos convencionais de desinfecção quimomecânica pode comprometer os resultados do tratamento. A busca por uma eficácia de desinfecção aprimorada no complexo sistema de canal radicular tem se concentrado nos últimos anos nos efeitos dentro das áreas de istmo como um alvo potencial para a erradicação de biofilmes. Bactérias com flora polimicrobiana organizadas como biofilmes foram identificadas nas áreas de istmo de primeiros molares mandibulares humanos, tanto imediatamente após a conclusão do tratamento endodôntico em uma única visita quanto em um dente associado à periodontite apical pós-tratamento. Este estudo avaliou a capacidade dos protocolos de desinfecção do canal radicular de remover detritos de tecido duro de irregularidades e istmos de canal não instrumentados como indicação de possível acesso a biofilmes nessas áreas bastante inacessíveis.
O desenho experimental utilizado aqui teve como objetivo avaliar as propriedades de irrigação dos dispositivos de irrigação testados sob condições padronizadas, desconsiderando assim diretrizes de aplicação clínica selecionadas.
Assim, embora o fabricante do GW recomende a instrumentação do canal até o tamanho 20/.06, neste estudo todos os canais mesiais foram instrumentados até o tamanho 25/.07 com irrigação mínima para padronizar o volume e o padrão de distribuição do AHTD. Além disso, de acordo com uma metodologia previamente estabelecida, os instrumentos reciprocantes Small e Primary WaveOne Gold foram utilizados em sequência para produzir quantidades suficientes de AHTD que permitirão a quantificação de sua eficácia de remoção. O volume de AHTD produzido, aproximadamente 15% do volume total do canal, foi comparável aos 19% relatados em um estudo anterior no qual os instrumentos reciprocantes WaveOne foram utilizados.
Na presente investigação, a redução do AHTD diferiu significativamente entre os protocolos de irrigação final testados; portanto, a hipótese nula foi rejeitada. O sistema GW removeu AHTD em 96,4% dentro dos canais radiculares mesiais e em 97,9% dentro das áreas do istmo. Esses resultados apoiaram a eficácia do GW na limpeza do complexo sistema de canais radiculares nos canais mesiais dos molares. O grupo IU reduziu AHTD em 91,2% e 93,5% das áreas dos canais e do istmo, respectivamente. Sua eficácia foi estatisticamente comparável ao sistema GW e parecia superior àquela relatada em estudos anteriores de micro-CT nos quais etapas de irrigação sequenciais semelhantes mostraram uma redução de 50,8% e 55,6%, respectivamente. A maior eficácia do IU relatada no presente estudo poderia ser atribuída à configuração de potência de ativação mais alta neste estudo em comparação com os anteriores. Em contraste, o grupo CU mostrou a menor redução de AHTD, apesar de sua eficácia comparável ao IU, o que está de acordo com relatos anteriores. No entanto, foi inferior à do GW. Uma limitação do presente estudo é o uso de uma sequência diferente de solução de irrigação nos grupos experimentais de irrigação ativada ultrassonicamente em comparação com o grupo GW.
Embora sua significância clínica ainda precise ser elucidada, a erosão da dentina foi observada in vitro quando NaOCl é utilizado como solução de irrigação final após agentes desmineralizantes. O uso de NaOCl como enxágue final nos grupos de irrigação ativados ultrassonicamente poderia ter potencialmente criado paredes de canal radicular mais limpas com menos detritos de dentina, permitindo uma penetração mais profunda de NaOCl em áreas anteriormente cobertas pela camada de smear.
Embora a eficácia na remoção de AHTD tenha sido comparável para o sistema GW e IU, a maior penetração da irrigação fornecida pelo sistema GW em comparação com sistemas de irrigação ativados ultrassonicamente foi sugerida anteriormente. Dispositivos de irrigação ultrassônica dependem da transmissão de energia acústica de um arquivo oscilante, no qual o movimento do arquivo provavelmente é impedido à medida que o canal radicular se estreita em direção à porção apical. Em contraste, o sistema GW utiliza um amplo espectro de ondas sonoras para distribuir fluidos por todo o sistema de canal radicular. Comparado à energia ultrassônica que é dispersa em uma única frequência, a energia multissônica emitida pelo sistema GW permite a entrega eficaz de irrigação energizada em túbulos dentinários de tamanho microscópico a uma alta taxa de fluxo. A interação entre o fluxo contínuo da solução de irrigação e o fluido estacionário dentro da câmara pulpar cria uma forte força de cisalhamento que induz uma nuvem de cavitação. A implosão das bolhas de cavitação gera energia multissônica produzida por um amplo espectro de ondas acústicas, bem como fluxo acústico com um padrão de fluxo vortical. Os efeitos hidrodinâmicos são ainda mais aprimorados pelo uso de fluidos de irrigação desgasificados, que podem minimizar a perda de energia e otimizar a entrega de fluidos por todo o sistema de canal radicular.
Embora as implicações clínicas da AHTD permaneçam desconhecidas, os detritos de dentina mostraram alterar significativamente a eficácia biológica dos desinfetantes intracanais. Além disso, os detritos de dentina exibem efeitos inibitórios sobre as soluções de irrigação comumente usadas, diminuindo o cloro livre disponível e as propriedades antibacterianas do NaOCl.
Além disso, a AHTD pode proteger microrganismos entupidos em áreas inacessíveis, fornecendo uma barreira espacial entre as bactérias e a irrigação antimicrobiana.
A AHTD também pode interferir na vedação proporcionada pelo preenchimento radicular. As preocupações potenciais mencionadas destacam a necessidade de desenvolver medidas para prevenir e interromper a AHTD, a fim de melhorar o acesso a biofilmes dentro de áreas inacessíveis do sistema de canais radiculares na busca por melhorar o prognóstico a longo prazo. Mais investigações são necessárias para definir a relação entre detritos de tecido duro e biofilmes. Com um refinamento metodológico adicional na imagem de micro-CT, estudos futuros também devem visar a imagem e quantificar biofilmes dentro do sistema de canais radiculares.
Conclusão
Dentro das limitações deste estudo in vitro, nenhum dos protocolos de irrigação testados foi capaz de deixar os canais radiculares mesiais e as áreas de istmo dos molares mandibulares livres de detritos de dentina. O sistema GW mostrou melhor eficácia na remoção de AHTD dos canais mesiais e áreas de istmo quando comparado com CU, mas não com IU. A eficácia dos sistemas de irrigação IU e CU foi comparável.
Autores: Rebecca Chan, Marco A. Versiani, Shimon Friedman, Gevik Malkhassian, Manoel D. Sousa-Neto, Graziela B. Leoni, Yara T.C. Silva-Sousa, Bettina Basrani
Referências:
- Byström A, Sundqvist G. Avaliação bacteriológica do efeito de 0,5 por cento de hipoclorito de sódio na terapia endodôntica. Oral Surg Oral Med Oral Pathol 1983;55:307–12.
- Nair PN, Henry S, Cano V, Vera J. Status microbiano do sistema de canal radicular apical de molares mandibulares humanos com periodontite apical primária após tratamento endodôntico de "uma visita". Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2005;99:231–52.
- Ricucci D, Siqueira Jr JF. Biofilmes e periodontite apical: estudo de prevalência e associação com achados clínicos e histopatológicos. J Endod 2010;36:1277–88.
- Carr GB, Schwartz RS, Schaudinn C, et al. Exame ultraestrutural de retratamento de molares falhados com periodontite apical secundária: uma análise de biofilmes endodônticos em uma falha de retratamento endodôntico. J Endod 2009;35:1303–9.
- Weller RN, Niemczyk SP, Kim S. Incidência e posição do istmo do canal. Parte 1. Raiz mesiobucal do primeiro molar maxilar. J Endod 1995;21:380–3.
- Green D. Canais duplos em raízes únicas. Oral Surg Oral Med Oral Pathol 1973;35:689–96.
- Piñeda F, Kuttler Y. Investigação radiográfica mesiodistal e bucolingual de 7.275 canais radiculares. Oral Surg Oral Med Oral Pathol 1972;33:101–10.
- Vertucci FJ. Anatomia do canal radicular dos dentes permanentes humanos. Oral Surg Oral Med Oral Pathol 1984;58:589–99.
- Paqué F, Laib A, Gautschi H, Zehnder M. Análise da acumulação de detritos de tecido duro por meio de tomografias computadorizadas de alta resolução. J Endod 2009;35:1044–7.
- Paqué F, Boessler C, Zehnder M. Níveis de detritos de tecido duro acumulados nas raízes mesiais de molares mandibulares após etapas sequenciais de irrigação. Int Endod J 2011;44:148–53.
- Wayman BE, Patten JA, Dazey SE. Frequência relativa de dentes que necessitam de tratamento endodôntico em 3350 pacientes endodônticos consecutivos. J Endod 1994;20:399–401.
- de Pablo OV, Estevez R, Peix Sanchez M, et al. Anatomia radicular e configuração do canal do primeiro molar mandibular permanente: uma revisão sistemática. J Endod 2010;36:1919–31.
- Teixeira FB, Sano CL, Gomes BP, et al. Um estudo preliminar in vitro da incidência e posição do istmo do canal radicular em molares maxilares e mandibulares. Int Endod J 2003;36:276–80.
- von Arx T. Frequência e tipo de istmos de canal em primeiros molares detectados por inspeção endoscópica durante cirurgia perirradicular. Int Endod J 2005;38:160–8.
- Cameron JA. O efeito da endodontia ultrassônica na temperatura da parede do canal radicular. J Endod 1988;14:554–9.
- Charara K, Friedman S, Sherman A, et al. Avaliação da extrusão apical durante a irrigação do canal radicular com o novo sistema GentleWave em um ambiente apical simulado. J Endod 2016;42:135–9.
- Haapasalo M, Shen Y, Wang Z, et al. Pressão apical criada durante a irrigação com o sistema GentleWave comparado à irrigação convencional com seringa. Clin Oral Investig 2016;20:1525–34.
- Haapasalo M, Wang Z, Shen Y, et al. Dissolução de tecido por um novo sistema de ultralimpagem multissônica e hipoclorito de sódio. J Endod 2014;40:1178–81.
- Molina B, Glickman G, Vandrangi P, Khakpour M. Avaliação da desbridamento do canal radicular de molares humanos utilizando o sistema GentleWave. J Endod 2015;41:1701–5.
- Leoni GB, Versiani MA, Silva-Sousa YT, et al. Avaliação ex vivo de quatro protocolos de irrigação final na remoção de detritos de tecido duro do sistema de canal radicular mesial de molares mandibulares. Int Endod J 2016;50:398–406.
- Schneider SW. Uma comparação de preparações de canal em canais radiculares retos e curvados. Oral Surg Oral Med Oral Pathol 1971;32:271–5.
- Nair PN. Estudos microscópicos de luz e eletrônicos da flora do canal radicular e lesões periapicais. J Endod 1987;13:29–39.
- Robinson JP, Lumley PJ, Cooper PR, et al. A técnica de canal radicular reciprocante induz maior acumulação de detritos do que uma técnica rotativa contínua, conforme avaliado por tomografia microcomputadorizada tridimensional. J Endod 2013;39:1067–70.
- Freire LG, Iglecias EF, Cunha RS, et al. Avaliação tomográfica microcomputadorizada da remoção de detritos de tecido duro após diferentes métodos de irrigação e sua influência no preenchimento de canais curvados. J Endod 2015;41:1660–6.
- van der Sluis L, Wu MK, Wesselink P. Comparação de 2 métodos de lavagem utilizados durante a irrigação ultrassônica passiva do canal radicular. Quintessence Int 2009;40:875–9.
- Tanomaru FM, Torres FF, Chavez-Andrade GM, et al. Irrigação ativada ultrassonicamente intermitente ou contínua: avaliação tomográfica microcomputadorizada da limpeza do sistema de canal radicular. Clin Oral Investig 2016;20:1541–6.
- Vandrangi P. Avaliando a profundidade de penetração de fluidos de tratamento nos túbulos dentinários usando o Sistema GentleWave. Dentistry 2016;6:366.
- van der Sluis LW, Versluis M, Wu MK, Wesselink PR. Irrigação ultrassônica passiva do canal radicular: uma revisão da literatura. Int Endod J 2007;40:415–26.
- Walmsley AD, Williams AR. Efeitos da restrição no padrão oscilatório de arquivos endossônicos. J Endod 1989;15:189–94.
- Ahmad M, Pitt Ford TJ, Crum LA. Desbridamento ultrassônico de canais radiculares: fluxo acústico e seu possível papel. J Endod 1987;13:490–9.
- Haapasalo HK, Siren EK, Waltimo TM, et al. Inativação de medicamentos locais de canal radicular pela dentina: um estudo in vitro. Int Endod J 2000;33:126–31.
- Portenier I, Haapasalo H, Rye A, et al. Inativação de medicamentos de canal radicular pela dentina, hidroxiapatita e albumina sérica bovina. Int Endod J 2001;34:184–8.
- Arias-Moliz MT, Morago A, Ordinola-Zapata R, et al. Efeitos de detritos de dentina nas propriedades antimicrobianas do hipoclorito de sódio e do ácido etidrônico. J Endod 2016;42:771–5.
- Paqué F, Rechenberg DK, Zehnder M. Redução da acumulação de detritos de tecido duro durante a instrumentação rotatória do canal radicular por ácido etidrônico em um irrigante de hipoclorito de sódio. J Endod 2012;38:692–5.
- Endal U, Shen Y, Knut A, et al. Um estudo tomográfico computadorizado de alta resolução das mudanças na área do istmo do canal radicular por instrumentação e preenchimento radicular. J Endod 2011;37:223–7.
