Passos Adicionais para Desinfecção do Sistema de Canal Radicular do Molar Mandibular: Uma Abordagem Correlativa Bacteriológica, Micro-Tomografia Computadorizada e Criopulverização
Tradução automática
O artigo original está escrito em EN language (link para lê-lo).
Resumo
Introdução: Este estudo avaliou a capacidade desinfetante da preparação quimomecânica com instrumentos rotatórios de níquel-titânio, seguida por 2 procedimentos adjuntos distintos nos canais radiculares de molares mandibulares extraídos por meio de uma abordagem analítica correlativa.
Métodos: Vinte e dois molares mandibulares extraídos foram selecionados e pareados anatomicamente entre os grupos com base na análise de microtomografia computadorizada. Na primeira fase do experimento, os canais radiculares foram contaminados com Enterococcus faecalis e submetidos à preparação quimomecânica com instrumentos BT RaCe e irrigação com NaOCl a 2,5%. Em seguida, foi utilizado o instrumento XP-Endo Finisher ou irrigação ultrassônica passiva para complementar a desinfecção. A microtomografia computadorizada foi utilizada para mostrar se a porcentagem de áreas não preparadas correlacionava-se com as contagens bacterianas. Na segunda fase, os mesmos dentes foram contaminados mais uma vez, e os procedimentos adjuntos foram utilizados. Amostras da área do istmo das raízes mesiais e do fragmento apical de 5 mm das raízes distais foram obtidas por criopulverização. Amostras coletadas antes e após as etapas de tratamento em ambas as fases foram avaliadas por reação em cadeia da polimerase quantitativa e analisadas estatisticamente.
Resultados: Na fase 1, a preparação em ambos os grupos resultou em uma diminuição substancial das contagens bacterianas (P < .001). As abordagens adjuntas levaram a uma pequena redução bacteriana adicional, que foi significativa para o XP-Endo Finisher (P < .05). Nenhuma diferença significativa foi observada entre os grupos para as contagens bacterianas persistentes. A análise correlacional não revelou relação estatisticamente significativa entre a redução bacteriana e a porcentagem de áreas não preparadas (P > .05). Na fase 2, ambos os métodos tiveram efeitos antibacterianos significativos no canal principal, mas nenhum deles conseguiu desinfetar de forma previsível as áreas de istmo/recesso.
Conclusões: Tanto o XP-Endo Finisher quanto a irrigação ultrassônica passiva exibiram eficácia antibacteriana, mas apenas o primeiro causou uma redução significativa nas contagens bacterianas após a preparação quimio-mecânica. Nenhum deles foi eficaz em desinfetar de forma previsível as áreas de istmo/recesso. (J Endod 2016;42:1667–1672).
Independentemente das técnicas de instrumentação, instrumentos e irrigantes, uma limpeza, desinfecção e modelagem completas do canal radicular não têm sido comumente alcançadas, especialmente em dentes com canais curvados ou anatomias incomuns. Estudos que utilizaram tecnologia de imagem microtomográfica de alta resolução (micro-CT) mostraram que 11%–48% das áreas principais do canal radicular permanecem intocadas após a instrumentação. Essas áreas podem ser colonizadas por biofilmes que têm o potencial de permanecerem inalterados e colocar o resultado do tratamento em risco. Além disso, certas complexidades anatômicas do sistema do canal radicular, como ramificações, recessos e istmos, não são comumente alcançadas por instrumentos e irrigantes. Bactérias localizadas nessas áreas podem persistir e levar à periodontite apical persistente. Na verdade, estudos bacteriológicos clínicos demonstraram que bactérias ainda são detectadas em cerca de 30%–60% dos canais após a preparação quimio-mecânica. Bactérias persistentes no canal são o fator de risco mais importante para a periodontite apical pós-tratamento. Esforços têm sido feitos para desenvolver abordagens auxiliares para melhorar a desinfecção do canal radicular. Isso envolve abordagens que direcionam irrigantes para áreas de difícil acesso ou permitem que o instrumento alcance e desbrave mecanicamente regiões não afetadas. Uma dessas abordagens auxiliares é a irrigação ultrassônica passiva (PUI), que compreende a ativação ultrassônica de um irrigante. Dados de estudos in vitro e in vivo que avaliam os benefícios em termos de efeitos antibacterianos da abordagem auxiliar PUI com NaOCl têm sido inconclusivos.
O XP-Endo Finisher (FKG Dentaire, La Chaux-de-Fonds, Suíça) foi recentemente introduzido com a promessa de melhorar a limpeza e desinfecção do canal radicular. Este é um instrumento de tamanho 25 não cônico, feito de liga de níquel-titânio (NiTi) MaxWire (Martensite-Austenite Electropolish FleX). À temperatura ambiente, o instrumento é reto em sua fase martensita, mas à temperatura do corpo, ele muda para a fase austenita e desenvolve uma forma de colher; quando rotacionado e movido para cima e para baixo no canal, essa forma faz com que o instrumento se expanda e contraia para tocar as paredes do canal e agitar a solução irrigante. Um estudo recente mostrou que o XP-Endo Finisher e o PUI conseguiram reduzir significativamente os níveis de detritos de tecido duro no sistema do canal radicular mesial em comparação com a irrigação convencional e um protocolo modificado do sistema de Arquivo Autoajustável. Até agora, apenas 1 estudo investigou os benefícios antibacterianos do uso do XP-Endo Finisher e relatou resultados melhores do que a irrigação convencional. Nenhum estudo avaliou os efeitos antibacterianos deste instrumento após procedimentos quimio-mecânicos.
O presente estudo teve como objetivo avaliar a capacidade desinfetante e de modelagem da preparação quimomecânica com instrumentos rotatórios de NiTi, seguida por 2 abordagens adjuntas distintas nos canais radiculares de molares mandibulares extraídos, por meio de uma análise bacteriológica e micro-CT correlativa. Uma abordagem de criopulverização foi utilizada para avaliar as condições bacteriológicas das áreas de istmo e recessos após o uso do instrumento XP-Endo Finisher ou procedimentos adjuntos de PUI.
Materiais e Métodos
Seleção e Preparação dos Dentes
O protocolo do estudo foi aprovado pelo Comitê de Ética da Universidade Estácio de Sá, Rio de Janeiro, RJ, Brasil. Vinte e dois molares mandibulares extraídos com 2 canais independentes unidos apicalmente por um istmo na raiz mesial (tipo II de Vertucci) e um único canal distal (tipo I de Vertucci) foram selecionados de uma coleção de 185 molares mandibulares com base em radiografias tiradas nas direções bucolingual e mesiodistal, exploração com pequenos arquivos após a preparação de acesso e imagens de micro-CT utilizando um scanner SkyScan 1174v2 (Bruker-microCT, Kontich, Bélgica) operado a 50 Kv, 800 mA, resolução isotrópica de 19,86 mm, e rotação de 180◦ ao redor do eixo vertical com um passo de rotação de 1,0 utilizando um filtro de alumínio de 0,5 mm de espessura.
As imagens de cada espécime foram reconstruídas com uma correção de artefato de anel de 5, uma correção de endurecimento do feixe de 15% e suavização de 5 (NRecon v.1.6.9.16; Bruker-microCT). O software CTAn v.1.14.4 (Bruker-microCT) foi utilizado para a avaliação tridimensional (3D) do canal radicular em relação ao volume e área de superfície, e o software CTVol v.2.2.1 (Bruker-microCT) foi utilizado para visualização e avaliação qualitativa da configuração do sistema de canais radiculares. Os espécimes foram pareados com base nos aspectos morfológicos e anatômicos dos sistemas de canais radiculares mesial e distal, avaliados por micro-CT, e 1 espécime de cada par foi atribuído aleatoriamente a 1 dos 2 grupos experimentais.
Os canais radiculares foram explorados com arquivos manuais K #15 até que a ponta do instrumento alcançasse o forame apical, conforme visualizado por um estereomicroscópio. Essa medida foi registrada como o comprimento de patência, e os canais foram inicialmente alargados até esse ponto utilizando o instrumento BioRaCe BR2 (25/04) (FKG Dentaire) operado no motor VDW Gold (VDW, Munique, Alemanha) a 300 rpm, 1,5 N • cm, para padronizar o diâmetro inicial do canal e criar espaço para contaminação bacteriana. A camada de smear foi removida utilizando irrigação com 17% de EDTA e 2,5% de NaOCl. O NaOCl foi inativado com 5% de tiossulfato de sódio. Os dentes foram escaneados novamente em micro-CT utilizando os parâmetros mencionados anteriormente, e os conjuntos de dados obtidos foram usados como base para comparação com as imagens pós-preparação.
Fase 1
Para contaminação, os canais radiculares foram preenchidos com caldo de soja tripticase (Difco, Detroit, MI) utilizando agulhas Navitip (Ultradent Products Inc, South Jordan, UT) até que o caldo fluísse através do forame apical. Os dentes foram colocados em um frasco contendo 50 mL de caldo de soja tripticase e ultrassonificados por 1 minuto para liberar o ar aprisionado e permitir a penetração do meio de cultura nas irregularidades do canal radicular. Em seguida, os dentes foram esterilizados em um autoclave. Uma cultura fresca de Enterococcus faecalis ATCC 29212 cultivada por 24 horas a 37◦C foi utilizada como inóculo para contaminação do canal radicular. Os dentes foram incubados por 30 dias a 37◦C sob agitação suave, e o meio de cultura foi renovado a cada semana. Posteriormente, todos os dentes contaminados tiveram o excesso de meio de cultura gotejado, e suas superfícies radiculares externas foram limpas com gaze estéril. Dois dentes foram fixados em formalina tamponada a 10% e processados para microscopia eletrônica de varredura (MEV) para confirmar a colonização bacteriana, conforme descrito em outro lugar.
Os forames apicais de cada raiz foram selados com Topdam (FGM, Joinville, SC, Brasil) para prevenir a vazamento bacteriano apical e criar um sistema de extremidade fechada. Antes da preparação do canal radicular, as superfícies externas das raízes foram limpas com peróxido de hidrogênio a 3% e desinfetadas com NaOCl a 2,5%, seguidas pela inativação deste último com tiossulfato de sódio a 5%. Os dentes foram montados verticalmente até a região cervical em blocos feitos de material de impressão de silicone (President Jet; Coltène AG, Cuyahoga Falls, OH). A coroa do dente, incluindo as paredes da câmara pulpar, e a superfície de silicone foram desinfetadas com NaOCl a 2,5%, seguidas pela inativação dessa substância com tiossulfato de sódio a 5%. Amostras foram coletadas do canal radicular usando pontos de papel antes (P1S1) e após a preparação quimomecânica (P1S2) e após a abordagem adjunta (P1S3) (Fig. 1A). O canal radicular foi irrigado com 1 mL de solução salina estéril a 0,85% para remover células não aderidas, e 3–5 pontos de papel estéreis foram usados sequencialmente no comprimento de trabalho (WL), que foi estabelecido em 0,5 mm do comprimento de patência. Cada ponto de papel permaneceu no canal por 1 minuto. Os pontos de papel foram transferidos para tubos contendo 1 mL de tampão Tris-EDTA (10 mmol/L Tris-HCl, 1 mmol/L EDTA, pH 7,6) e congelados a –20◦C. Na raiz mesial, amostras foram coletadas de cada canal, mas foram agrupadas para análises bacteriológicas adicionais porque os 2 canais se fundiram em 1 na porção apical. Os canais foram preparados no WL usando o sistema BT RaCe (FKG Dentaire), operado no motor VDW Gold a 600 rpm, 1,5 N • cm, até o instrumento BT3. A irrigação foi realizada usando NaOCl a 2,5% entregue por agulhas Navitip até 2 mm antes do WL (Fig. 1A). Durante a instrumentação dos canais mesiais, o orifício do canal distal foi selado com Topdam (e vice-versa) para evitar a vazamento de irrigantes nele. Após a preparação apical, o canal foi irrigado com NaOCl, EDTA (para remoção da camada de smear), e então NaOCl novamente (Fig. 1A). Após a inativação do NaOCl com tiossulfato de sódio a 5%, a amostra P1S2 foi coletada conforme descrito acima, e os dentes de cada grupo foram submetidos a procedimentos adjuntos de PUI ou XP-Endo Finisher conforme a seguir.
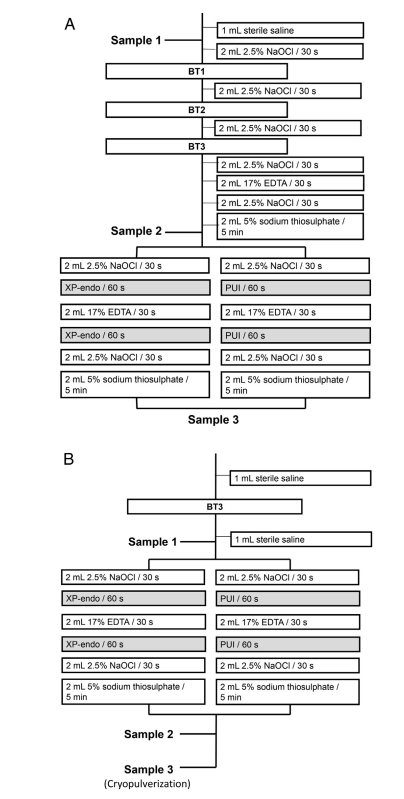
PUI.
Os canais radiculares foram irrigados com 2 mL de NaOCl a 2,5%, que foi ativado ultrassonicamente no canal por 1 minuto usando o dispositivo EndoUltra (Vista Dental Products, Racine, WI), com a ponta da sonda colocada 1 mm antes do WL. Os canais foram irrigados com 2 mL de EDTA, que foi ativado ultrassonicamente da mesma forma que acima, seguido de uma lavagem final com NaOCl a 2,5%. Finalmente, o NaOCl foi inativado com 2 mL de tiossulfato de sódio a 5%, e a amostra P1S3 foi coletada.
Instrumento XP-Endo Finisher.
O XP-Endo Finisher foi operado até o WL por 1 minuto após a irrigação com 2 mL de NaOCl a 2,5%. O instrumento foi acoplado ao motor VDW Gold a 800 rpm, 1 N • cm, com movimentos lentos para cima e para baixo de 7 a 8 mm de comprimento. Os canais radiculares foram então irrigados com 17% de EDTA, e o XP-Endo foi utilizado novamente. Após as irrig ações finais com NaOCl a 2,5% e tiossulfato de sódio, a amostra P1S3 foi coletada.
O mesmo volume final de irrigantes foi utilizado por grupo, com 14 mL de NaOCl por canal. Em ambos os grupos, os irrigantes foram pré-aquecidos a 37◦C para os procedimentos intracanais, que foram realizados a 37◦C dentro de um gabinete contendo um aquecedor (800-Heater; PlasLabs, Lansing, MI).
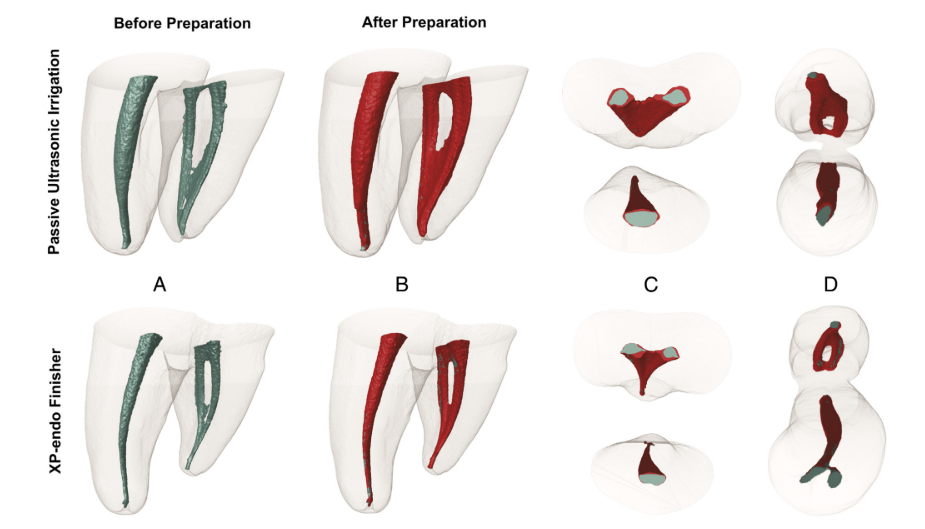
As amostras foram autoclavadas e submetidas a uma nova varredura de micro-CT usando os parâmetros de configuração mencionados. Modelos 3D coloridos pré-operatórios e pós-operatórios dos canais mesiais foram renderizados (CTVol v.2.2.1; Bruker-microCT) e co-registrados com seus respectivos conjuntos de dados pré-operatórios (verde e vermelho indicam superfícies de canal pré-operatórias e pós-operatórias, respectivamente) usando o módulo de registro rígido do software 3D Slicer 4.3.1 (disponível em http://www.slicer.org), com precisão superior a 1 voxel. Em seguida, as imagens correspondentes foram examinadas para calcular o volume (mm3) e a área de superfície (mm2) do sistema de canal radicular mesial antes e depois da preparação usando o software CTAn v.1.14.4 (Bruker micro-CT). A área da superfície do canal não tocada foi determinada calculando o número de voxels estáticos e expressa como uma porcentagem do número total de voxels presentes na superfície do canal.
Fase 2
Os mesmos espécimes dentários da fase 1 foram utilizados na segunda fase do experimento. Dezoito dentes ainda estavam disponíveis. Esta segunda fase foi realizada para aumentar o número de dentes com canais positivos para bactérias antes da aplicação das abordagens adjuntas, permitindo uma comparação estatística mais robusta. Além disso, foi possível testar ambas as abordagens contra cargas bacterianas iniciais mais controladas. Finalmente, a avaliação dos efeitos da abordagem adjunta isolada nas áreas do istmo foi incluída neste segundo experimento.
Os dentes foram esterilizados em autoclave, contaminados e montados conforme descrito na fase 1. Em seguida, os canais radiculares foram lavados com 1 mL de solução salina e instrumentados mais uma vez com um instrumento BT3 para reduzir ligeiramente a carga bacteriana inicial. P2S1 foi coletada como na fase 1. Cada canal foi irrigado com 2 mL de NaOCl a 2,5%, e o instrumento XP-Endo Finisher ou PUI foi utilizado conforme descrito anteriormente (Fig. 1B). Após a irrigação com EDTA, as abordagens adjuntas foram realizadas mais uma vez, e então o canal foi irrigado com NaOCl e tiossulfato de sódio. A amostra P2S2 foi coletada.
Com base nas imagens de micro-CT da seção transversal do canal radicular, a posição do istmo na raiz mesial foi estabelecida, e os espécimes foram cortados usando discos de diamante estéreis de dupla face para gerar fragmentos de raiz contendo istmo para análise. As raízes distais tinham um único canal achatado contendo recessos e foram seccionadas a 5 mm do ápice. Os fragmentos de raiz correspondentes à área do istmo da raiz mesial e à parte apical da raiz distal tiveram suas superfícies externas limpas com peróxido de hidrogênio a 3% e desinfetadas com NaOCl a 2,5%, que foi posteriormente inativado com tiossulfato de sódio. Em sequência, as superfícies externas das raízes foram amostradas usando um ponto de papel estéril #80 umedecido com tampão Tris-EDTA. Esta amostra serviu como controle de esterilidade e foi avaliada por meio de um ensaio de reação em cadeia da polimerase em tempo real quantitativa (qPCR). Esses procedimentos de desinfecção e amostragem de controle foram realizados sob um microscópio operatório. Um moinho criogênico 6750 (Spex, Metuchen, NJ) operado na temperatura do nitrogênio líquido foi utilizado para moer criogenicamente cada fragmento de raiz, conforme descrito em outro lugar. Após a moagem, amostras de pó de raiz apical (P2S3) foram suspensas em tampão Tris-EDTA e armazenadas a –20◦C.
Extração de DNA e Assay de qPCR
O DNA foi extraído das amostras de ambas as fases experimentais e utilizado como template para a quantificação de células de E. faecalis usando um ensaio de qPCR direcionado ao gene 16S rRNA. Os passos de extração de DNA e qPCR, controles e condições foram conforme descrito anteriormente. Todas as medições foram feitas em triplicata.
Análise Estatística
O teste de pares correspondentes de Wilcoxon foi utilizado para comparar a redução intragrupal nas contagens bacterianas de P1S1/P2S1 para P1S2/P2S2, P1S1/P2S1 para P1S3/P2S3, e P1S2/P2S2 para P1S3/P2S3. As amostras iniciais (P1S1/P2S1) foram comparadas entre os grupos usando o teste não paramétrico de Mann-Whitney U, que não revelou diferença significativa entre elas (P> .05). Portanto, o mesmo teste foi utilizado para comparar as contagens nas amostras P1S2/P2S2 e P1S3/P2S3 entre os grupos. Inicialmente, as análises foram realizadas para raízes mesiais e distais separadamente. Como não houve diferenças significativas entre os canais mesiais e distais, os dados também foram coletados para aumentar a robustez da análise estatística. A análise de correlação de Pearson foi utilizada para verificar as relações entre a redução bacteriana e a porcentagem de áreas não preparadas. As análises estatísticas foram realizadas com o STATISTICA versão 8 (StatSoft, Tulsa, OK) com um nível de significância estabelecido em 5%.
Resultados
A análise SEM revelou que E. faecalis colonizou as paredes do canal radicular, formando geralmente estruturas semelhantes a biofilme (dados não mostrados). A colonização do canal radicular foi confirmada por resultados positivos de qPCR nas amostras P1S1/P2S1 de todos os dentes.
Fase 1
Tabela 1 exibe a média, mediana e intervalo das contagens de E. faecalis observadas para os grupos de teste. No grupo XP-Endo Finisher, as contagens de E. faecalis foram substancialmente reduzidas de P1S1 para P1S2 (P < .001). Após o uso do instrumento XP-Endo (P1S3), houve uma redução adicional significativa (P < .05). Todas as 20 amostras foram positivas para E. faecalis em P1S1, 6 em P1S2 e 6 em P1S3. No grupo PUI, as contagens bacterianas iniciais (P1S1) também foram significativamente diminuídas após a preparação (P1S2) (P < .001). Embora as contagens bacterianas tenham sido ainda mais reduzidas em P1S3, não foram significativamente diferentes de P1S2 (P > .05). Todas as 20 amostras foram positivas em P1S1, 10 em P1S2 e 7 em P1S3. Nenhuma diferença significativa foi observada ao comparar P1S3 dos grupos XP-Endo e PUI (P > .05).

A análise estatística dos dados mesiais e distais separadamente mostrou ausência de significância para todas as comparações entre P1S2 e P1S3 (P > .05), exceto para os canais mesiais no grupo XP-Endo Finisher (P < .05). Os dados das raízes mesiais e distais separadamente estão mostrados na Tabela Suplementar S1.
A análise de Micro-CT não mostrou diferenças significativas nos volumes iniciais dos canais entre os grupos (P > .05). Quanto às áreas não preparadas, foi observado um valor percentual médio de voxels estáticos de 4,5% (mediana, 4,3%) para o grupo XP-Endo Finisher e 4,3% (mediana, 5,4%) para o grupo PUI (P > .05) (Fig. 2). A análise correlacional não revelou relação estatisticamente significativa entre a redução bacteriana e a porcentagem de áreas não preparadas (P > .05).
Fase 2
Tabela 2 retrata os dados quantitativos da fase 2. No grupo XP-Endo Finisher, as contagens de E. faecalis em P2S1 foram significativamente reduzidas após o uso deste instrumento (P< .001). Todas as 18 amostras foram positivas para bactérias em P2S1, 2 em P2S2 e 4 em P2S3 (amostras pulverizadas). O procedimento PUI também foi altamente eficaz na redução das contagens bacterianas no canal principal (P< .001). Todas as 18 amostras foram positivas para bactérias em P2S1, 1 em P2S2 e 6 em P2S3 (amostras pulverizadas). Nenhuma diferença significativa foi observada ao comparar os efeitos do XP-Endo e do PUI em P2S2 (canais principais) ou P2S3 (istmos/recessos) (P> .05). A análise estatística dos dados mesiais e distais separadamente não mostrou diferenças significativas entre os grupos também (P> .05) (Tabela Suplementar S2).
Discussão
Este estudo correlacionou diferentes ferramentas analíticas para avaliar, em 2 fases experimentais, os efeitos antibacterianos de abordagens adjuntas no sistema de canal radicular do molar mandibular. Na primeira fase, os efeitos dos 2 procedimentos utilizados imediatamente após a preparação quimomecânica com instrumentação rotatória de NiTi e irrigação com NaOCl foram avaliados. Esta análise foi restrita aos efeitos antibacterianos no canal radicular principal, conforme determinado pela amostragem com pontos de papel. Como 50% (grupo PUI) e 70% (grupo XP-Endo Finisher) dos casos mostraram resultados negativos para bactérias em P1S2, reduzindo o tamanho da amostra para a análise intergrupal de P1S3, uma segunda fase foi elaborada para aumentar o número de canais submetidos a ambas as abordagens e incluir a análise de seus efeitos não apenas nos canais principais, mas também nas áreas de istmo e recessos, moendo criogenicamente a raiz para a coleta de amostras.
Na primeira fase, a instrumentação quimomecânica com BT RaCe e irrigação com NaOCl promoveu uma eliminação bacteriana substancial em ambos os grupos, o que concorda com estudos anteriores. Enquanto a etapa adicional do procedimento com PUI não conseguiu reduzir significativamente as contagens bacterianas, as contagens intracanal de E. faecalis após o uso do XP-Endo Finisher foram significativamente menores do que aquelas obtidas imediatamente após a preparação. Os resultados significativamente melhores para XP-Endo ocorreram nas raízes mesiais. Na segunda fase, as amostras iniciais consistiram em uma carga bacteriana inicial mais baixa para permitir a comparação de ambas as abordagens em relação aos números bacterianos compatíveis com o que as procedimentos adjuntos são esperados enfrentar na situação clínica. Nesta fase, as abordagens PUI e XP-Endo Finisher foram semelhantes e altamente eficazes na redução das contagens bacterianas no canal principal.
No que diz respeito às áreas do istmo/recesso, a natureza destrutiva da abordagem de criopulverização não permitiu que uma análise longitudinal fosse realizada. Portanto, não é possível inferir se os resultados negativos foram devido aos efeitos das abordagens adjuntas ou à contaminação bacteriana malsucedida nessas áreas. No entanto, não houve diferenças significativas nas contagens bacterianas entre os grupos. As contagens na área do istmo (P2S3) foram de fato maiores do que no canal principal (P2S2), sugerindo que os efeitos do PUI e do XP-Endo Finisher nessa região não são previsíveis. Isso, juntamente com os achados de vários dentes com amostras negativas no canal e positivas no istmo, destaca a limitação da abordagem do ponto de papel na amostragem do sistema de canal radicular.
Os resultados gerais para o instrumento XP-Endo Finisher foram encorajadores porque ele geralmente apresentou desempenho comparável ao PUI, uma abordagem adjunta amplamente recomendada. Em um estudo recente, o instrumento XP-Endo Finisher foi mais eficiente do que outras técnicas na desinfecção do espaço do canal principal. O design e o movimento helicoidal do instrumento podem ter permitido que ele alcançasse áreas anteriormente intocadas e deslocasse biofilmes bacterianos. O aumento das áreas tocadas não foi avaliado por micro-CT devido à capacidade de corte mínima, se é que existe, do instrumento XP-Endo Finisher.
Nossos achados com PUI estão de acordo com vários estudos que relataram nenhuma melhoria significativa na desinfecção após a preparação. Os efeitos antibacterianos do PUI são sugeridos como relacionados à cavitação, fluxo acústico e aquecimento do irrigante, mas se esses fenômenos realmente ocorrem no canal radicular, eles não parecem ser suficientes para aumentar significativamente a eliminação bacteriana.
Não houve correlação entre a porcentagem de áreas não preparadas e os níveis bacterianos em P1S3, o que está em consonância com um estudo anterior. Existe a possibilidade de que em alguns espécimes as áreas não tocadas do canal principal podem não ter sido colonizadas por bactérias. Além disso, é possível que áreas não instrumentadas tenham sido de fato desinfetadas pela irrigação com NaOCl. As limitações do procedimento de amostragem pontual do artigo também podem ter contribuído para essa falta de correlação.
O presente desenho experimental possui alguns aspectos notáveis. Scans de micro-CT foram utilizados para selecionar e combinar os dentes de acordo com semelhanças anatômicas antes da distribuição entre os grupos, minimizando variáveis inerentes à anatomia. Além disso, irrigantes aquecidos foram utilizados ao longo dos experimentos. Isso teve que ser feito porque o instrumento XP-Endo Finisher passa por transformação de fase à temperatura corporal. Então decidimos incluir soluções aquecidas em todas as fases do experimento, que também foi realizado dentro de um gabinete com temperatura mantida a 37◦C. A maioria dos estudos anteriores em dentes extraídos foi conduzida à temperatura ambiente. Como a temperatura pode afetar a atividade antibacteriana do NaOCl, é aconselhável realizar testes antibacterianos sob uma temperatura semelhante à temperatura corporal. Outra vantagem deste estudo foi o uso de qPCR para quantificação bacteriana. Essa abordagem é muito sensível e poderia ser utilizada de forma confiável em amostras criopulverizadas (estudos piloto que utilizaram cultura mostraram perda de contagens bacterianas devido à abordagem de moagem). O uso de criopulverização, por sua vez, foi essencial para permitir a análise dos efeitos antibacterianos das abordagens testadas em áreas como istmos e recessos, que podem não ser adequadamente amostrados por pontos de papel.
Embora este estudo seja inovador ao combinar diferentes abordagens analíticas, ele também possui limitações. A coleta de amostras com pontos de papel geralmente é restrita ao canal principal, e algumas áreas, como irregularidades, istmos e recessos, podem não ser amostradas. A limitação da técnica do ponto de papel foi evidente na fase 2, quando mais canais foram positivos para bactérias em P2S3 do que em P2S2; contagens médias mais altas também foram mostradas para P2S3. Além disso, como a amostragem com pontos de papel não distingue o segmento do canal principal, permanece desconhecido em qual parte as bactérias permaneceram. A criopulverização pode contornar essas limitações, mas é um método destrutivo e só pode ser usado para análise transversal. Outra limitação pode referir-se ao uso de qPCR para detecção bacteriana. Há uma preocupação de que o DNA de células que morreram recentemente como consequência do tratamento antibacteriano também possa ser detectado por este método. No entanto, um estudo anterior que utilizou um protocolo in vitro semelhante não mostrou diferença significativa nas contagens bacterianas entre cultura e qPCR em amostras pós-tratamento. Isso, juntamente com a alta ocorrência de resultados negativos de qPCR em amostras pós-tratamento, sugere fortemente que o DNA de células mortas pode não ter sido um problema significativo no presente estudo. O DNA livre pode ser degradado por NaOCl ou pode ter sido lavado durante a irrigação.
Em conclusão, este estudo demonstrou que ambas as abordagens adjuntas causaram uma pequena redução nas contagens bacterianas após a preparação quimomecânica, que foi significativa apenas para o XP-Endo Finisher. Nem o XP-Endo nem o PUI foram eficazes em desinfetar de forma previsível as áreas de istmo/recesso dos molares mandibulares.
Autores: Flavio R.F. Alves, Carlos V. Andrade-Junior, Marílía F. Marceliano-Alves, Alejandro R. Perez, Isabela N. Rôças, Marco A. Versiani, Manoel D. Sousa-Neto, Jose C. Provenzano, Jose F. Siqueira
Referências:
- Siqueira JF Jr, Araujo MC, Garcia PF, et al. Avaliação histológica da eficácia de cinco técnicas de instrumentação para limpeza do terço apical dos canais radiculares. J Endod 1997;23:499–502.
- Peters OA, Schönenberger K, Laib A. Efeitos de quatro técnicas de preparação em Ni-Ti na geometria do canal radicular avaliados por microtomografia computadorizada. Int Endod J 2001;34: 221–30.
- Vera J, Siqueira JF Jr, Ricucci D, et al. Tratamento endodôntico de um ou dois atendimentos de dentes com periodontite apical: um estudo histobacteriológico. J Endod 2012;38: 1040–52.
- Paqué F, Zehnder M, De-Deus G. Comparação baseada em microtomografia da técnica de arquivo único reciprocante F2 ProTaper versus sequência rotativa completa. J Endod 2011; 37:1394–7.
- Markvart M, Darvann TA, Larsen P, et al. Análises de micro-CT de alargamento apical e complexidade do canal radicular de molares. Int Endod J 2012;45:273–81.
- Siqueira JF Jr, Alves FR, Versiani MA, et al. Análise bacteriológica e micro-tomográfica correlativa dos canais mesiais de molares mandibulares preparados por arquivo autoajustável, Reciproc e sistemas Twisted File. J Endod 2013;39:1044–50.
- Peters OA, Arias A, Paque F. Uma avaliação micro-tomográfica da preparação do canal radicular com um novo instrumento, TRUShape, em raízes mesiais de molares mandibulares. J Endod 2015;41:1545–50.
- Ricucci D, Siqueira JF Jr. Biofilmes e periodontite apical: estudo de prevalência e associação com achados clínicos e histopatológicos. J Endod 2010;36:1277–88.
- Ricucci D, Siqueira JF Jr, Bate AL, Pitt Ford TR. Investigação histológica de dentes tratados endodonticamente com periodontite apical: um estudo retrospectivo de vinte e quatro pacientes. J Endod 2009;35:493–502.
- Paiva SS, Siqueira JF Jr, Rôças IN, et al. Suplementando os efeitos antimicrobianos da desbridamento quimomecânico com irrigação ultrassônica passiva ou um enxágue final com clorexidina: um estudo clínico. J Endod 2012;38:1202–6.
- Byström A. Avaliação do tratamento endodôntico de dentes com periodontite apical [dissertação odontológica nº 27]. Umea, Suécia: Universidade de Umea; 1986.
- Vianna ME, Horz HP, Gomes BP, Conrads G. Avaliação in vivo da redução microbiana após a preparação quimomecânica de canais radiculares humanos contendo tecido pulpar necrótico. Int Endod J 2006;39:484–92.
- Sjögren U. Sucesso e fracasso em endodontia [dissertação odontológica nº 60]. Umea, Suécia: Universidade de Umea; 1996.
- Neves MA, Provenzano JC, Rôças IN, Siqueira JF Jr. Eficácia antibacteriana clínica da preparação do canal radicular com sistemas de instrumento único reciprocante ou de múltiplos instrumentos rotativos contínuos. J Endod 2016;42:25–9.
- Siqueira JF Jr, Rôças IN. Implicações clínicas e microbiologia da persistência bacteriana após procedimentos de tratamento. J Endod 2008;34:1291–13013.
- Siqueira JF Jr, Rôças IN. Otimizando a desinfecção em uma única visita com abordagens suplementares: uma busca por previsibilidade. Aust Endod J 2011;37:92–8.
- Alves FR, Almeida BM, Neves MA, et al. Desinfetando canais radiculares em forma oval: eficácia de diferentes abordagens suplementares. J Endod 2011;37:496–501.
- Tardivo D, Pommel L, La Scola B, et al. Eficiência antibacteriana da irrigação ultrassônica passiva versus irrigação sônica: irrigação ultrassônica do canal radicular. Odontostomatol Trop 2010;33:29–35.
- Carver K, Nusstein J, Reader A, Beck M. Eficácia antibacteriana in vivo do ultrassom após instrumentação manual e rotativa em molares mandibulares humanos. J Endod 2007; 33:1038–43.
- Paiva SS, Siqueira JF Jr, Rôças IN, et al. Avaliação microbiológica molecular da ativação ultrassônica passiva como um passo suplementar de desinfecção: um estudo clínico. J Endod 2013;39:190–4.
- Debelian G, Trope M. Limpando a terceira dimensão. Prática Endodôntica 2015;8: 22–4.
- Leoni GB, Versiani MA, Silva-Sousa YT, et al. Avaliação ex vivo de quatro protocolos de irrigação final na remoção de detritos de tecido duro do sistema de canal radicular mesial de molares mandibulares. Int Endod J 2016 Mar 18. http://dx.doi.org/ 10.1111/iej.12630. [Epub ahead of print].
- Azim AA, Aksel H, Zhuang T, et al. Eficácia de 4 protocolos de irrigação na eliminação de bactérias colonizadas nos túbulos dentinários examinados por uma nova análise de microscopia de varredura a laser confocal. J Endod 2016;42:928–34.
- Siqueira JF Jr, Alves FR, Almeida BM, et al. Capacidade da preparação quimomecânica com instrumentos rotativos ou arquivo autoajustável para desinfetar canais radiculares em forma oval. J Endod 2010;36:1860–5.
- Alves FR, Siqueira JF Jr, Carmo FL, et al. Perfil da comunidade bacteriana de amostras moídas criogenicamente dos segmentos radiculares apicais e coronais de dentes com periodontite apical. J Endod 2009;35:486–92.
- Antunes HS, Rôças IN, Alves FR, Siqueira JF Jr. Níveis bacterianos totais e específicos no sistema de canal radicular apical de dentes com periodontite apical pós-tratamento. J Endod 2015;41:1037–42.
- Alves FR, Rôças IN, Almeida BM, et al. Análises moleculares quantitativas e de cultura da eliminação bacteriana em canais radiculares em forma oval por uma técnica de instrumentação de arquivo único. Int Endod J 2012;45:871–7.
- van der Sluis LW, Versluis M, Wu MK, Wesselink PR. Irrigação ultrassônica passiva do canal radicular: uma revisão da literatura. Int Endod J 2007;40:415–26.
- Martin H. Desinfecção ultrassônica do canal radicular. Oral Surg Oral Med Oral Pathol 1976;42:92–9.
- Ahmad M, Pitt Ford TR, Crum LA. Desbridamento ultrassônico de canais radiculares: uma visão sobre os mecanismos envolvidos. J Endod 1987;13:93–101.
- Sirtes G, Waltimo T, Schaetzle M, Zehnder M. Os efeitos da temperatura na estabilidade a curto prazo do hipoclorito de sódio, capacidade de dissolução da polpa e eficácia antimicrobiana. J Endod 2005;31:669–71.
- Siqueira JF Jr, Rôças IN. Explorando métodos moleculares para investigar infecções endodônticas: parte 1—tecnologias moleculares atuais para diagnóstico microbiológico. J Endod 2005;31:411–23.
- McCarty SC, Atlas RM. Efeito do tamanho do amplicon na detecção de PCR de bactérias expostas ao cloro. PCR Methods Appl 1993;3:181–5.
- Fouad AF, Barry J. O efeito de antibióticos e antimicrobianos endodônticos na reação em cadeia da polimerase. J Endod 2005;31:510–3.
Para continuar aprendendo e ter acesso a todos os outros artigos, entre ou crie uma conta

/social-network-service/media/default/6758/89a8282e.png)
